迷迭香大豆分离蛋白膜的制备及其性能
程玉娇,应丽莎,李大虎,张 敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
迷迭香大豆分离蛋白膜的制备及其性能
程玉娇,应丽莎,李大虎,张 敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆 400715)
以大豆分离蛋白为基质,通过添加迷迭香来制备抗氧化薄膜,研究迷迭香抗氧化剂的添加对膜理化性质和抗氧化性能的影响。结果表明,迷迭香和大豆分离蛋白制备的活性蛋白膜材料具有光滑透明的外观和优秀的机械性能,其拉伸强度超过同厚度的低密度聚乙烯材料。迷迭香含量的不同导致其与蛋白基材料间的相互作用力不同,从而使活性蛋白膜出现不同的结构,其中迷迭香质量浓度为0.25 g/L的活性蛋白膜所具有疏松结构,为迷迭香与自由基的反应提供了便利,其对ABTS+自由基的抑制率大于其他活性蛋白膜,呈现出最佳的抗氧化性能。
迷迭香;大豆分离蛋白;蛋白膜;抗氧化性
氧化导致食品发生一系列品质劣变反应,如变色变味、异味生成、营养价值降低等,严重影响其货架稳定性,是食品企业面临的主要问题之一。为了延缓或抑制食品的氧化反应,通常向食品基质掺杂或食品表面喷洒抗氧化剂,但因为大部分氧化反应集中发生在食品表面,活性物质的直接添加使其迅速扩散进入食品体系,导致食品表面浓度降低[1-3]。且活性剂还可能与食品基质发生中和反应进一步降低了其抗氧化活性;而增加抗氧化剂的起始浓度可能会导致促氧化作用[4]。抗氧化控释包装材料可有效解决这一问题,其利用材料包埋抗氧化剂形成的活性包装系统,通过向食品表面持续释放适量的活性因子,实现长期有效抑制食品氧化反应的目的[1,4-5]。因此,活性包装系统不仅起到阻隔作用,而且在食品销售过程中对食品品质也起着积极的保护作用。
考虑到传统合成塑料材料对环境的巨大压力,天然可降解或可食性生物基材料,如多糖、蛋白质及脂类等具有广泛的发展前景。蛋白基薄膜由于其独特的气体选择透过性及低湿环境中对氧气、二氧化碳优秀的阻隔性能受到研究者的普遍关注[6]。其中,大豆分离蛋白(soybean protein isolated,SPI)还具有来源丰富、价格低廉、可生物降解、营养价值高及优秀的成膜性能等优点。此外,相比其他植物蛋白,SPI基薄膜具有更好的柔软性、光滑性、水溶性和清澈度[7];同时也具有较好的可食性、降解性及无环境污染性等优点,具有有效解决传统上不可降解塑料带来的“白色污染”问题的潜能,体现了“绿色环保”的理念,所以SPI膜替代普通的塑料材料是不可逆转的趋势[8]。
近年来,抗菌活性薄膜的制备及性能表征已成为研究热点之一[9-10],SPI涂层或薄膜加入抗菌剂如香芹酚[3,11]、百里香和牛至油[12]也均有研究,但目前在SPI基薄膜加入迷迭香抗氧化剂制备抗氧化薄膜的研究未见报道。迷迭香提取物具有高效的抗氧化活性[13-15],本实验将迷迭香添加到SPI中制备具有抗氧化活性蛋白基薄膜,研究不同迷迭香质量浓度对薄膜理化性质和抗氧化性能的影响,为其在食品工业、化妆品等领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
商用SPI(蛋白质含量≥85%) 北京奥博星生物技术有限责任公司;迷迭香粉末(鼠尾草酸质量分数为5%) 海南舒普生物科技有限公司;山梨醇(生化试剂)、甘油(分析纯) 成都科龙化工试剂厂;溴化钾(优级纯) 天津市光复精细化工研究所。
1.2 仪器与设备
JJ-1精密增力电动搅拌器 常州博远实验分析仪器厂;UV-2450PC紫外-可见分光光度计 日本岛津公司;UltraScan® PRO测色仪 美国HunterLab公司;PHS-3C pH计 上海精科仪器有限公司;XLW(G)-500N智能电子拉力机、Spectrun100红外光谱仪 美国PerkinElmer公司;S-3000N扫描电镜 日本日立公司。
1.3 方法
1.3.1 迷迭香SPI膜的制备
SPI溶液参照Cho等[16]方法制备。取5 g SPI缓慢溶解于90 mL蒸馏水中,分别加入1.25 g甘油和山梨醇作为增塑剂,用0.3 mol/L NaOH溶液调整该混合体系pH值为10,然后置于70 ℃水浴中加热搅30 min。采用质量分别为0、0.025、0.05、0.1、0.2 g的迷迭香溶解于10 mL无水乙醇中,将迷迭香溶液加入到成膜溶液中,并用蒸馏水平衡膜液体积到100 mL,配成迷迭香质量浓度分别为0、0.025、0.05、0.1、0.2 g/100 mL的5 组膜液,分别记为spi0、sr250、sr500、sr1000和sr2000。为了排除乙醇对薄膜性能的影响,本实验增设一个对照组,即用10 mL的蒸馏水代替迷迭香溶液加入到成膜溶液中,记为spi,膜液在8 000 r/min条件下均质10 min,分别流延于聚丙烯塑料板上,于室温条件下干燥过夜,选取厚度为(62.22±6.48)mm的薄膜作为蛋白基薄膜的性能表征测定的样品。
1.3.2 蛋白基薄膜的性能表征
1.3.2.1 颜色及不透明度测定
SPI基薄膜的颜色根据CIE L*a*b*颜色标准采用色差仪于室温条件下测得。使用D65照明光源,10°标准观察角。每个样品取上表面均匀分布的6 处不同位置进行测量并求其平均值。薄膜的色相(Hue)和饱和度(Chroma)用式(1)、(2)计算:

SPI基薄膜的不透明度参照Cao等[17]方法由紫外-可见分光光度计测得。薄膜样品被切成矩形样条,直接置于紫外分光光度计比色盒内,以空气作为参比。薄膜的不透明度用其在600 nm波长处的吸光度与薄膜厚度(mm)的比值表示[18]。
1.3.2.2 机械性能测定
薄膜的拉伸强度(tensile strength,TS)与断裂伸长率(elongation at break,EAB)主要是根据美国材料与试验协会标准[19]在拉力机下测得,设置夹具的速率为50mm/min。使用螺旋测微器在低密度聚乙烯(low density polyethylene,LDPE)薄膜上随机选取5 点进行测定,取平均值,最后选出与实验中制备的SPI基薄膜相同厚度的LDPE作为测量样品。将LDPE和SPI基薄膜样品置于(23±2)℃、(50±10)%相对湿度条件下平衡至少48 h。
薄膜的拉伸强度与断裂伸长率按照式(3)、(4)进行计算:

式中:F为膜断裂时承受的最大张力/N;W 为膜的宽/mm;T为膜的厚度/mm;d为膜断裂时被拉伸的长度/mm;L为试样原始标线间的距离/mm。
1.3.2.3 扫描电镜测定
薄膜扫描电镜测试采用20 kV加速电压,分别对薄膜的下表面和截面进行扫描。
1.3.2.4 水蒸气透过系数(water vapor transmission rate,WVTR)和透过率(water vapor permeability,WVP)的测定
薄膜WVP根据ASTM标准采用模拟透视杯法测定。采用称量瓶作为模拟透视杯,内装1/3干燥硅胶(0%相对湿度),称量瓶开口面积为12.5 cm2,将蛋白膜覆于瓶口,密封。将“透视杯”置于干燥器内并放置于23 ℃室温条件下。干燥器内相对湿度用Mg(NO3)2•6H2O溶液调节为50%。将覆有薄膜的“透视杯”每12 h称量一次,持续称量7 d。在坐标系上记录“透视杯”质量与时间的关系,得到一条拟合直线,并用线性回归计算拟合直线的斜率。WVTR和WVP分别用公式(5)、(6)计算:

式中:w为透视杯的质量增加量/g;t为时间/s;A为透视面积/cm2;l为薄膜的平均厚度/cm;ΔP为薄膜两侧的水蒸气分压/Pa。
1.3.2.5 红外光谱测定
SPI基薄膜的分子结构用红外光谱测定。薄膜样品在60 ℃条件下干燥、粉碎,与溴化钾以1∶120充分混匀制备溴化钾压片。红外光谱的扫描频率为4000~400 cm-1,扫描次数16,分辨率4 cm-1。
1.3.2.6 抗氧化活性测定
参照Re等[20]方法采用ABTS法对薄膜的整体抗氧化活性进行评估。7 mmol/L ABTS与2.45 mmol/L K2S8O2在黑暗条件下于室温反应12~16 h,得到ABTS存储液。然后,将该存储液用pH为7.4的磷酸盐缓冲液稀释至734 nm波长处的吸光度为(0.7±0.02),得到ABTS反应液。将各组薄膜样品均裁成2 cm×2 cm大小,分别放入100 mL ABTS反应液中,持续搅拌,在734 nm波长处测得该反应液的吸光度,通过式(7)求得ABTS+自由基的抑制率,并将其转化成VC当量,结果以mmol VC/m2表示。

式中:A0代表样品的吸光度,Ac代表对照组的吸光度。
原有普通盘根盒盘根垫大头朝上,小头朝下,光杆上冲程的过程没有起到拉紧盘根垫的作用,密封效果不好(图2)。
1.4 数据分析
采用Origin 8.0软件绘图和SPSS 13.0软件对各指标进行相关性和差异性分析。
2 结果与分析
2.1 颜色与不透明度
如表1所示,迷迭香的添加导致SPI膜的色相发生显著改变(P<0.01)。受迷迭香提取物中存在色素的影响,薄膜的红度a*值随着迷迭香含量增加呈明显的增加趋势(P<0.01),相反,薄膜的亮度L*呈现下降趋势(P<0.01),Wu等[21]也报道薄膜的亮度与掺杂的儿茶素含量呈负相关,这说明了活性剂的色素可能会对薄膜亮度造成不利影响;b*值从(0.82±0.16)~(6.63±0.14)变化,表示了制备的蛋白膜颜色趋向黄色的程度;同时饱和度值从(0.90±0.18)~(6.99±0.1)变化,代表了不同迷迭香质量浓度制备的蛋白膜接近自然色的程度。实验也发现了乙醇和迷迭香的添加对薄膜的不透明度均产生了一定影响,薄膜的不透明度随添加的迷迭香质量浓度的增加而增大,这可能与迷迭香对薄膜色相的改变有关,统计分析发现薄膜的不透明度与色相值呈显著负相关(P<0.01)。
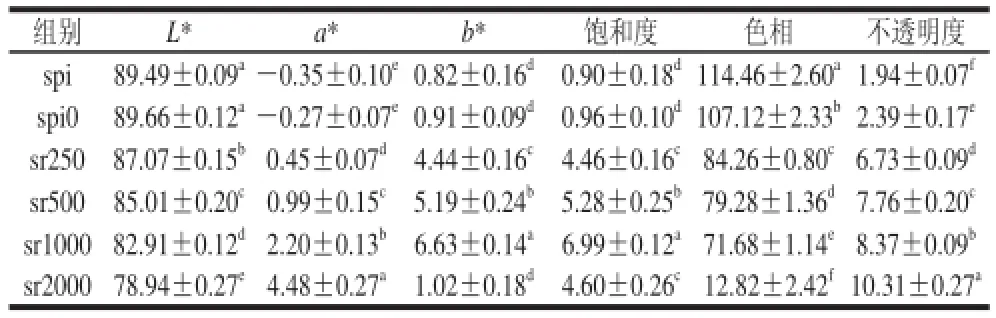
表1 含迷迭香的SPI基薄膜的颜色与不透明度Table 1 Color values and optical indexes of SPI films incorporated with rosemary
2.2 结构特征

图1 含迷迭香的SPI基薄膜表面扫描电镜图Fig.1 Scanning electron microscopy images of SPI films incorporated with rosemary on plate-contacting surfaces
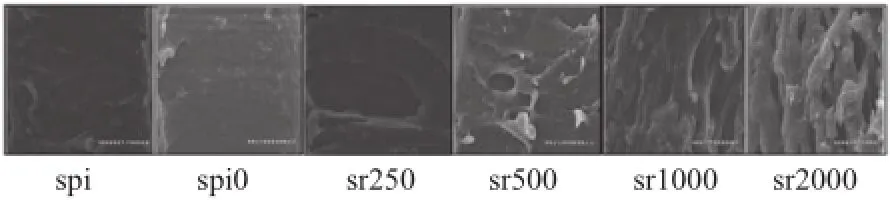
图2 含迷迭香的SPI基薄膜扫描电镜截面图Fig.2 Cross-sectional scanning electron microscopic images of SPI films incorporated with rosemary
如图1所示,各组蛋白膜均呈现光滑平整的外观,表面无明显孔洞。薄膜截面却因迷迭香含量不同呈现明显的结构差异,如图2所示,纯SPI膜截面比较致密,迷迭香的添加导致薄膜截面出现大孔径的孔洞,其中sr250样品截面中间沿垂直薄膜表面方向向下凹,形成一个巨型洞穴,表明sr250材料中的迷迭香和SPI相容性较差。sr1000和sr2000则沿平行薄膜表面方向形成明显的纤维状纹理,且形成的孔洞分别较含低质量浓度迷迭香的薄膜更为均匀,这可能是因为迷迭香与SPI之间存在一定的相互作用力,随着迷迭香含量增加,两组分间的相互作用加强,从而改变了薄膜的形态结构。这与Denavi等[22]报道的SPI薄膜的截面会出现平行于薄膜表面的纤维结构的结果不一致,本实验中含高质量浓度迷迭香的SPI膜才形成平行状纹理,这可能是由蛋白原料和制备工艺的差异性造成的。
2.3 机械性能

图3 含迷迭香的SPI基薄膜的拉伸强度和断裂伸长率Fig.3 Tensile strength and elongation at break of SPI films incorporated with rosemary
由图3可知,SPI膜的拉伸强度受乙醇和迷迭香的影响,添加乙醇的薄膜即spi0其拉伸强度有轻微增加,但并不显著(P>0.05)。而低质量浓度迷迭香的添加明显降低了薄膜的拉伸强度,sr250和sr500的拉伸强度均低于对照组spi(P<0.01)。这可能是由于迷迭香的存在增大了蛋白质分子间的距离,从而限制了蛋白质分子间的相互作用,降低了薄膜的拉伸强度。Cho等[23]指出SPI膜的形成要经历蛋白在碱性条件下的热变性(蛋白展开)和蛋白在干燥阶段的交联(重新折叠)两个阶段。在热变性阶段,蛋白疏水残基发生解折叠,当蛋白分子之间的距离靠的足够近,蛋白质即发生分子间聚合反应[25]。而SPI薄膜掺杂迷迭香会减少蛋白质分子间氢键或疏水键合的含量,从而使成型的sr250和sr500薄膜拉伸强度下降。但是当薄膜中迷迭香质量浓度增加,迷迭香对薄膜拉伸强度的影响并不明显,含高质量浓度迷迭香的薄膜,如sr1000和sr2000的拉伸强度大于含低质量浓度迷迭香的薄膜sr250和sr500(P<0.05),且sr1000和sr2000的拉伸强度与对照组spi无明显差异(P>0.05),这可能是由于蛋白质与迷迭香之间存在较强的相互作用力,如扫描电镜显示sr1000和sr2000形成平行纤维状结构。Hoque等[26]报道明胶薄膜掺杂肉桂、丁香、八角茴芹提取物提高了其机械性能,并将其归功于多酚与蛋白质之间存在的疏水作用。实验发现乙醇和迷迭香添加降低了SPI薄膜的断裂伸长率(P<0.01)。Altiok等[27]报道当壳聚糖薄膜中百里香油含量增加时,薄膜的孔隙率和孔径大小增加,薄膜的断裂伸长率降低。本实验中含迷迭香的活性薄膜的断裂伸长率均低于纯蛋白膜spi,其中sr2000的断裂伸长率虽然低于对照组spi,但与sr250、sr500和sr1000相比有所增加(P<0.05),这可能是由于sr2000样品中迷迭香、乙醇和蛋白质三者相互作用,形成较均匀、数量多而深的洞穴,其增加了SPI与水蒸气的接触面积,更多的水分被sr2000吸收,水的增塑作用减少了聚合物链之间的分子力,可能使薄膜变得更为柔韧[28],从而增加了薄膜的伸长率。Ojagh等[9]指出对于大部分亲水性薄膜来说,不能忽视水的增塑作用。
2.4 WVP和WVTR

图4 含迷迭香的SPI基薄膜的WVTR和WVPFig. 4 Water vapor transmission rate and water vapor permeability of SPI films incorporated with rosemary
食性薄膜,如SPI基薄膜的水蒸气透过行为主要由3 个现象组成:水分吸附、水分在聚合物内的扩散及水分解吸[29]。纯乙醇添加使蛋白膜的WVP和WVTR略有降低(P>0.05),这可能是由于乙醇与水之间形成的氢键阻碍了水的解吸。而迷迭香添加增加了薄膜的WVP和WVTR,与壳聚糖薄膜掺杂丁香油的报道相似[27],这可能由于迷迭香的添加使薄膜形成多孔结构。由图2可知,sr250薄膜结构较为疏松,薄膜截面中部沿垂直于薄膜表面方向形成较大的孔洞,从而加速了水蒸气在薄膜内部的扩散,增加了水蒸气的透过(P<0.05)。而随着迷迭香质量浓度的增加,如sr500、sr1000和sr2000三组薄膜的WVTR和WVP明显低于sr250(P<0.05),这是因为这3 组材料的致密性强于sr250,而sr1000和sr2000形成的平行于薄膜表面的纤维结构会增加水蒸气的扩散路径,从而降低WVTR和WVP值。但sr500、sr1000和sr2000三组的WVTR和WVP与对照组spi相比无明显差异,这可能因为迷迭香的添加虽然降低了材料的致密性、加快水蒸气的通过,但迷迭香中的酚类化合物会限制亲水基团与水的氢键键合,继而降低薄膜的亲水性[30]、减少了材料对水分的吸附。此外,蛋白质和迷迭香可能通过疏水键合和氢键相互作用,减少聚合物基质的自由体积、降低薄膜的WVTR[26]。
2.5 红外光谱分析
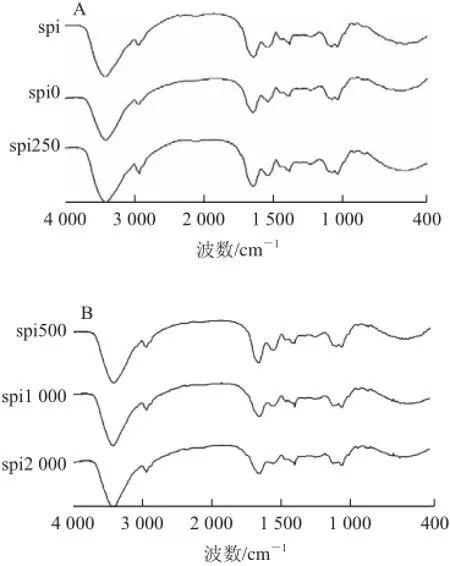
图5 5 SPISPI基薄膜的红外光谱图Fig.5 FTIR spectra of SPI films incorporated with rosemary
如图5所示,SPI的主要特征吸收峰为1 645 cm-1处的C=O伸缩振动(酰胺Ⅰ),1 546 cm-1处的N—H弯曲振动(酰胺Ⅱ)和1 236 cm-1处的C—N伸缩振动(酰胺Ⅲ)。3 418 cm-1处的宽峰为游离或结合的O—H和N—H基团,该基团可以与蛋白质肽键上的羰基基团形成氢键键合[31],spi0在3 418 cm-1处的峰向低频方向移至3 401 cm-1,且峰形变宽,而处于2 931 cm-1(C—H伸缩振动),1 645 cm-1和1 385 cm-1处的峰向高频方向移动,spi0 的光谱变化表明乙醇的羟基与蛋白质的氨基可能存在一定的相互作用。
由图5可知,掺杂迷迭香后,薄膜在1 047 cm-1左右的峰强度增加,这与C1和C3中的C—O键的伸缩振动有关[32]。同时,迷迭香的添加使薄膜在3 418 cm-1处的峰向低频方向移至3 412 cm-1。含低质量浓度迷迭香的薄膜,如sr250和sr500使1 645cm-1(酰胺Ⅰ)处的峰强度增加并向高波数移动。而高质量浓度迷迭香添加对活性材料红外谱图酰胺Ⅱ的改变更为显著,如sr1000和sr2000明显降低了1 546 cm-1处的峰强度。Jongjareonrak等[33]报道活性化合物可能诱导蛋白质的次级结构发生变化,从而导致酰胺Ⅰ和酰胺Ⅱ类谱带改变。实验结果表明SPI与迷迭香提取物之间存在一定的相互作用力,且该作用力因迷迭香含量的不同呈现一定的差异性,同时也有研究报道酚类物质与蛋白质[33]或多糖基薄膜[31]均会形成相互作用力。
2.6 抗氧化活性

图6 含迷迭香的SPI基薄膜的抗氧化活性Fig.6 Antioxidant activity of SPI films incorporated with rosemary
迷迭香蛋白基薄膜的抗氧化活性主要包括两个方面,即固定的抗氧化活性及释放的抗氧化活性。其中,薄膜的固定抗氧化活性特征主要体现在SPI的亲水性,导致薄膜浸渍到ABTS+自由基溶液中时发生溶胀,溶液逐渐进入薄膜内部,使迷迭香对自由基的清除可能在薄膜内部及表面同时发生;同时,虽然迷迭香为脂溶性提取物,但是薄膜的溶胀会增加迷迭香在其内的扩散系数,可能会导致迷迭香向外部溶液的释放,这也体现了薄膜的释放抗氧化活性。考虑到这两个过程可能同时发生,本实验并未对两个过程分开讨论,而是评估其总体抗氧化活性。由图6可知,sr250对ABTS+自由基表现出很强的抑制能力,虽然sr250中迷迭香含量最低,但其作用效果大于其他薄膜,且sr250在前10 min的清除速率大于其他薄膜。然而,Gomez-Estaca等[34]报道抗氧化能力一般与活性提取物添加量成比例,这与本实验的结果不一致。这可能与薄膜掺杂不同含量迷迭香形成的不同结构有关,与其他薄膜相比,sr250薄膜相容性较差,材料中存在大的空穴贯穿整个蛋白基质(图2),加速了ABTS+自由基溶液的进入及迷迭香的释放。相反,含高质量浓度迷迭香的蛋白基薄膜,如sr1000和sr2000由于存在平行于薄膜表面的纤维状结构,迷迭香或ABTS溶液在薄膜中的扩散路径增加,因此与含较低质量浓度迷迭香的蛋白基薄膜相比,迷迭香对ABTS+自由基的抑制率低。
3 结 论
本实验制备的蛋白基薄膜具有光滑平整的外观及较高的透明度,迷迭香由于其自身存在的色素使制备的活性蛋白基薄膜的a*值和不透明度增加。虽然低质量浓度迷迭香的添加降低了蛋白膜的拉伸强度,但本实验得到的迷迭香活性蛋白膜材料仍具有非常优秀的机械性能,其拉伸强度甚至超过了传统LDPE材料,当迷迭香含量增加时,蛋白膜的拉伸强度与纯蛋白膜相比无明显差异。由扫描电镜和红外光谱图得出,迷迭香与SPI基质存在一定的相互作用力,且迷迭香含量的不同造成其与大豆蛋白的作用力呈现差异性,其中sr250材料的相容性较差,而sr1000和sr2000薄膜出现平行于薄膜表面的纤维状组织结构。实验发现迷迭香的添加虽然使薄膜的水蒸气透过率略有增加,但除sr250外,其余各组与对照组差异并不显著。此外,sr250较为疏松的结构为迷迭香与自由基的反应提供了便利,对薄膜的抗氧化评价实验发现sr250即0.25g/L迷迭香对ABTS+自由基表现出最大的抑制率,其作用效果大于含高质量浓度的迷迭香蛋白膜。
[1] GEMILI S, YEMENICIOGLU A, ALTINKAYA S A. Development of antioxidant food packaging materials with controlled release properties[J]. Journal of Food Engineering, 2010, 96(3): 325-332.
[2] MASTROMATTEO M, MASTROMATTEO M, CONTE A, et al. Advances in controlled release devices for food packaging applications[J]. Trends in Food Science & Technology, 2010, 21(12): 591-598.
[3] CHALIER P, BEN ARFA A, GUILLARD V, et al. Moisture and temperature triggered release of a volatile active agent from soy protein coated paper: effect of glass transition phenomena on carvacrol diffusion coefficient[J]. Journal of Agricultural and Food Chemistry, 2009, 57(2): 658-665.
[4] KOONTZ J L, MOFFITT R D, MARCY J E, et al. Controlled release of α-tocopherol, quercetin, and their cyclodextrin inclusion complexes from linear low-density polyethylene (LLDPE) films into a coconut oil model food system[J]. Food Additives and Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment, 2010, 27(11): 1598-1607.
[5] 应丽莎, 赵东方, 付海姣, 等. 控释技术在食品活性包装中应用与研究[J]. 食品科学, 2012, 33(9): 335-340.
[6] GONTARD N, THIBAULT R, CUQ B, et al. Influence of relative humidity and film composition on oxygen and carbon dioxide permeabilities of edible films[J]. Journal of Agricultural and Food Chemistry, 1996, 44(4): 1064-1069.
[7] BRANDENBURG A, WELLER C, TESTIN R. Edible films and coatings from soy protein[J]. Journal of Food Science, 1993, 58(5): 1086-1089.
[8] 白莹, 王晓敏, 焦利勇. 可食性大豆分离蛋白包装膜的性能及应用前景[J]. 广东包装, 2009(1): 52-53.
[9] OJAGH S M, REZAEI M, RAZAVI S H, et al. Development and evaluation of a novel biodegradable film made from chitosan and cinnamon essential oil with low affinity toward water[J]. Food Chemistry, 2010, 122(1): 161-166.
[10] SEYDIM A C, SARIKUS G. Antimicrobial activity of whey protein based edible films incorporated with oregano, rosemary and garlic essential oils[J]. Food Research International, 2006, 39(5): 639-644.
[11] ARFA A B, PREZIOSI-BELLOY L, CHALIER P, et al. Antimicrobial paper based on a soy protein isolate or modified starch coating including carvacrol and cinnamaldehyde[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2155-2162.
[12] EMIROGLU Z K, YEMIS G P, COSKUN B K, et al. Antimicrobial activity of soy edible films incorporated with thyme and oregano essential oils on fresh ground beef patties[J]. Meat Science, 2010, 86(2): 283-288.
[13] 阮英, 侯有德, 陈玉珍, 等. 迷迭香抗氧化剂抗氧化性能的研究[J].云南化工, 2013, 40(3): 25-28.
[14] 陈如, 翁新楚. 引进香料: 迷迭香抗氧化活性的研究[J]. 上海大学学报: 自然科学版, 2006, 12(1): 78-83.
[15] 应丽莎, 赵东方, 傅阳, 等. 迷迭香对生鲜猪肉颜色变化与抗氧化稳定性的影响[J]. 食品科学, 2012, 33(5): 1-6.
[16] CHO S Y, LEE S Y, RHEE C. Edible oxygen barrier bilayer film pouches from corn zein and soy protein isolate for olive oil packaging[J]. LWTFood Science and Technology, 2010, 43(8): 1234-1239.
[17] CAO N, FU Y, HE J. Preparation and physical properties of soy protein isolate and gelatin composite films[J]. Food Hydrocolloids, 2007, 21(7): 1153-1162.
[18] HAN J H, FLOROS J D. Casting antimicrobial packaging films and measuring their physical properties and antimicrobial activity[J]. Journal of Plastic Film and Sheeting, 1997, 13(4): 287-298.
[19] ASTM, Standard test method for tensile properties of thin plastic sheeting, designation: D882-01, in annual book of ASTM standards[S]. American Society for Testing Materials: Philadelphia, 2001.
[20] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237.
[21] WU J G, WANG P J, CHEN S C. Antioxidant and antimicrobial effectiveness of catechin-impregnated pva-starch film on red meat[J]. Journal of Food Quality, 2010, 33(6): 780-801.
[22] DENAVI G, TAPIA-BLACIDO D R, ANON M C, et al. Effects of drying conditions on some physical properties of soy protein films[J]. Journal of Food Engineering, 2009, 90(3): 341-349.
[23] CHO S Y, RHEE C. Mechanical properties and water vapor permeability of edible films made from fractionated soy proteins with ultrafiltration[J]. Lebensmittel-Wissenschaft Und-Technologie-Food Science and Technology, 2004, 37(8): 833-839.
[24] GONZALEZ A, STRUMIA M C, IGARZABAL C I A. Crosslinked soy protein as material for biodegradable films: synthesis, characterization and biodegradation[J]. Journal of Food Engineering, 2011, 106(4): 331-338.
[25] KUMAR R, ZHANG L. Soy protein films with the hydrophobic surface created through non-covalent interactions[J]. Industrial Crops and Products, 2009, 29(2/3): 485-494.
[26] HOQUE M S, BENJAKUL S, PRODPRAN T. Properties of film from cuttlefish (Sepia pharaonis) skin gelatin incorporated with cinnamon, clove and star anise extracts[J]. Food Hydrocolloids, 2011, 25(5): 1085-1097.
[27] ALTIOK D, ALTIOK E, TIHMINLIOGLU F. Physical, antibacterial and antioxidant properties of chitosan films incorporated with thyme oil for potential wound healing applications[J]. Journal of Materials Science-Materials in Medicine, 2010, 21(7): 2227-2236.
[28] ZHONG Q P, XIA W S. Physicochemical properties of edible and preservative films from chitosan/cassava starch/gelatin blend plasticized with glycerol[J]. Food Technology and Biotechnology, 2008, 46(3): 262-269.
[29] IMRAN M, El-FAHMY S, REVOL-JUNELLES A M, et al. Cellulose derivative based active coatings: effects of nisin and plasticizer on physicochemical and antimicrobial properties of hydroxypropyl methylcellulose films[J]. Carbohydrate Polymers, 2010, 81(2): 219-225.
[30] SIRIPATRAWAN U, HARTE B R. Physical properties and antioxidant activity of an active film from chitosan incorporated with green tea extract[J]. Food Hydrocolloids, 2010, 24(8): 770-775.
[31] GUERRERO P, HANANI Z A N, KERRY J P, et al. Characterization of soy protein-based films prepared with acids and oils by compression[J]. Journal of Food Engineering, 2011, 107(1): 41-49.
[32] GUERRERO P, RETEGI A, GABILONDO N, et al. Mechanical and thermal properties of soy protein films processed by casting and compression[J]. Journal of Food Engineering, 2010, 100(1): 145-151.
[33] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al. Antioxidative activity and properties of fish skin gelatin films incorporated with BHT and alpha-tocopherol[J]. Food Hydrocolloids, 2008, 22(3): 449-458.
[34] GOMEZ-ESTACA J, BRAVO L, GOMEZ-GUILLEN M C, et al. Antioxidant properties of tuna-skin and bovine-hide gelatin films induced by the addition of oregano and rosemary extracts[J]. Food Chemistry, 2009, 112(1): 18-25.
Preparation and Physicochemical Prosperities of Soy Protein Isolate Film Incorporated with Rosemary
CHENG Yu-jiao, YING Li-sha, LI Da-hu, ZHANG Min*
(Chongqing Special Food Programme and Technology Research Center, Laboratory of Quality and Safety Risk Assessment for Argo-products on Storage and Preservation (Chongqing), Ministry of Agriculture, College of Food Science, Southwest University, Chongqing 400715, China)
Edible films with antioxidant activity were prepared from soy protein isolate (SPI) incorporated with rosemary. The effect of rosemary addition as an antioxidant on properties of SPI films was investigated. The active protein film was smooth and transparent with excellent mechanical properties and had a better tensile strength than low-density polyethylene (LDPE) material of the same thickness. Active protein-based films with different structures were obtained when rosemary was added in different amounts to SPI, consequently resulting in various interactions between these two materials. The film with 0.25 g/L rosemary had a relatively loose structure which facilitates the reaction of rosemary with free radicals. Thus it exhibited significant inhibition against ABTS+free radical and had the strongest antioxidant activity among the tested concentrations of rosemary.
rosemary; soy protein isolate; protein-based film; antioxidant capacity
TS201.2
A
1002-6630(2014)22-0033-06
10.7506/spkx1002-6630-201422007
2014-05-09
重庆市科技攻关应用技术研发类重点项目(cstc2012gg-yyjsB80003);中央高校基本科研业务费专项(XDJK2013C130)
程玉娇(1990—),女,硕士研究生,研究方向为食品包装材料及技术。E-mail:haixyzi@sina.com
*通信作者:张敏(1975—),男,副教授,硕士,研究方向为食品包装材料及技术。E-mail:zmqx123@163.com

