响应面法优化锐孔法制备大米抗氧化肽微胶囊工艺
陈 丽,张 喻,*,谭亦成,林亲录
(1.湖南农业大学 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2.中南林业科技大学 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
响应面法优化锐孔法制备大米抗氧化肽微胶囊工艺
陈 丽1,张 喻1,*,谭亦成1,林亲录2
(1.湖南农业大学 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;2.中南林业科技大学 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
为提高大米抗氧化肽的稳定性,以海藻酸钠为壁材,采用锐孔法对大米抗氧化肽进行微胶囊化。以包埋率为考察指标,在单因素试验基础上,进一步采用响应面分析法对芯材与壁材质量比、海藻酸钠质量分数、包埋温度、CaCl2质量分数、蔗糖脂肪酸酯质量分数工艺条件进行分析和优化,并对所制备的微胶囊进行了存放实验和电镜扫描。响应面优化试验结果表明:制备大米抗氧化肽微胶囊的最佳工艺条件为芯材与壁材质量比0.3∶1、海藻酸钠质量分数1.4%、包埋温度50 ℃、CaCl2质量分数1.8%、蔗糖脂肪酸酯质量分数0.26%,经验证,在上述最优条件下制备的微胶囊包埋率为81.24%,与模型预测值81.75%相比,相对误差仅为0.6%。存放实验结果表明微胶囊中抗氧化肽的稳定性明显提高;扫描电镜结果显示微胶囊表面形态结构完整。实验结果表明微胶囊化是保护抗氧化肽活性的一种较好方法,可为大米抗氧化肽微胶囊的实际生产提供参考。
锐孔法;大米抗氧化肽;微胶囊;包埋率
抗氧化肽能有效地清除体内过剩的活性氧自由基,具有抑制延缓脂质氧化、保护人体组织器官免受自由基侵害的作用,在食品、制药和化妆品行业中具有极大的潜在利用价值[1]。大米蛋白质通过水解作用得到的抗氧化肽因具有分子质量小、安全性高、抗氧化性强和易被吸收等特点而成为研究热点。但目前大米抗氧化肽的相关研究主要集中在制备、分离纯化并分析氨基酸的组成、肽序等方面[2-4]。和其他功能性多肽一样,大米抗氧化肽稳定性差,易受氧气、温度、湿度等环境因素的影响而变性,并且大米抗氧化肽易被胃中的胃酸和胃蛋白酶水解失活,使它的应用受到限制。因此,如何提高大米抗氧化肽的稳定性,扩大其应用范围是一个亟待解决的问题。
微胶囊技术是利用天然的或者合成的高分子材料对固体、液体或气体等核心物质进行包埋的技术[5]。通过微胶囊技术可达到保护芯材免受环境影响、掩盖不良口感和难闻气味及控制释放的目的[6-8]。而微胶囊的壁材是决定微胶囊性能的关键因素之一[6]。海藻酸钠具有生物相容性良好、天然、无毒、可生物降解、廉价易得等特点,且海藻酸钠成胶机制简单,与钙离子在室温条件下即可生成具有“蛋盒”结构的海藻酸钙凝胶[9]。此外,海藻酸钠在酸性介质中几乎不溶胀而能在碱性介质中溶胀,可用来保护芯材免受胃酸和胃蛋白酶的影响[10],在口服缓释制剂中具有良好的应用前景。
制备微胶囊的常用方法有喷雾干燥法[11]、锐孔法[12]、分子包埋法[13]、复凝聚法[14]、界面聚合法[15]等。其中锐孔法因技术装置简单、投资少,且能制备出形态较为均一的微球而尤为受到重视[16],已有研究采用锐孔法对猕猴桃油[17]、还原型谷胱甘肽[18]、葡萄籽原花青素[19]和红枣色素[20]等物质进行微胶囊化,但采用锐孔法制备大米抗氧化肽微胶囊的研究在国内外鲜见报道。
本实验以海藻酸钠为壁材、CaCl2为凝固剂,采用锐孔-凝固浴法对大米抗氧化肽进行微胶囊包埋。以包埋率为主要考察指标,在单因素试验基础上,进一步采用响应面分析法优化制备工艺参数,并对所得抗氧化肽微胶囊进行了存放实验和电镜扫描,以期得到包埋率高且稳定性好的微胶囊产品。
1 材料与方法
1.1 材料与试剂
海藻酸钠(食品级) 青岛奥福隆生物科技有限公司;蔗糖脂肪酸酯(食品级) 河南天博食品添加剂有限公司;无水CaCl2(分析纯) 国药集团化学试剂有限公司;SephadexG-25凝胶 上海江莱生物科技有限公司。
1.2 仪器与设备
HH-8数显恒温水浴锅、SHZ-82水浴恒温振荡器 上海浦东物理光学仪器厂;JJ-1精密增力电动搅拌器 金坛市城西春兰实验仪器厂;紫外-可见分光光度计 北京莱伯泰科仪器有限公司;注射器(针头孔径为0.5 mm) 圣光医用制品有限公司;JSM-6380LV扫描电子显微镜 日本电子株式会社。
1.3 方法
1.3.1 大米抗氧化肽的制备
参照文献[21]的方法,实验室自制,所得大米抗氧化肽粗品经SephadexG-25凝胶分离纯化,收集抗氧化活性最高的组分,冷冻干燥后于-20 ℃冰箱保存备用。
1.3.2 大米抗氧化肽微胶囊的制备
1.3.2.1 壁材溶液的配制
精确称取一定质量的海藻酸钠,加入蒸馏水充分搅拌,待其溶解后,在50~60 ℃恒温条件下静置过夜,使海藻酸钠完全吸水溶胀后备用[17-18]。
1.3.2.2 芯材和壁材混合液的配制
在一定温度条件下,向壁材溶液中按一定比例加入大米抗氧化肽和促进致密微胶囊膜形成的蔗糖脂肪酸酯,搅拌30 min并保温备用。
1.3.2.3 凝固液的配制
配制不同质量分数的CaCl2溶液,冷却到室温,备用。
1.3.2.4 造粒
保持离液面15 cm的高度,用注射器将芯材和壁材混合液缓慢滴入凝固液中,形成微胶囊[22]。
1.3.2.5 固化、干燥
将微胶囊室温搅拌固化30 min,分离出微胶囊,用清水洗去微胶囊表面残留的CaCl2,置于40 ℃烘箱干燥,即得微胶囊产品。
1.3.3 包埋率与载药量的测定
1.3.3.1 标准曲线的绘制
精确称取抗氧化肽600 mg于100 mL容量瓶中,用按文献[23]配制的人工模拟胃液溶解并定容,振荡摇匀后分别精确移取0、1、2、3、4、5、6、7、8、9、l0 mL于50 mL容量瓶中,用模拟胃液定容,280 nm波长处测定吸光度A[24]。以吸光度A对质量浓度C作线性回归。
1.3.3.2 包埋率与载药量的计算
精密称取干燥的微囊100 mg,置100 mL具塞锥形瓶中,加入0.5 mol/L的柠檬酸钠溶液50 mL,于40 ℃、50 r/min振摇6 h,5 000 r/min离心l0 min,取上清液l mL稀释至10 mL。按1.3.1节方法制备不添加芯材的空白微囊,同样方法处理后得到的上清液作为对照,于280 nm波长处测定吸光度A,用回归方程求出质量浓度,按式(1)、(2)分别计算微胶囊包埋率和多肽质量分数。

1.3.4 单因素试验
单因素试验在芯材与壁材质量比0.3∶1、海藻酸钠质量分数1.5%、包埋温度50 ℃、CaCl2质量分数2.0%、蔗糖脂肪酸酯质量分数0.2%的基础上,相应变换某因素的水平:芯材与壁材质量比选择0.1∶1、0.2∶1、0.3∶1、0.4∶1、0.5∶1;海藻酸钠质量分数选择0.5%、1.0%、1.5%、2.0%、2.5%;包埋温度选择40、45、50、55、60 ℃;CaCl2质量分数选择1.0%、1.5%、2.0%、2.5%、3.0%;蔗糖脂肪酸酯质量分数选择0.10%、0.15%、0.20%、0.25%、0.30%。按1.3.1节的方法制备大米抗氧化肽微胶囊,考察各因素对微胶囊包埋率的影响。
1.3.5 响应面试验设计
为探求大米抗氧化肽微胶囊的最佳制备工艺条件,在单因素试验基础上,通过方差分析选取对微胶囊包埋率影响显著的因素进行了响应面优化试验[25]。以芯材与壁材质量比、海藻酸钠质量分数、CaCl2质量分数、蔗糖脂肪酸酯质量分数为自变量,以包埋率为响应值设计四因素三水平响应面试验,并采用Design-Expert软件进行回归模型分析。试验因素水平编码如表1所示。

表1 试验设计因素及编码水平Table 1 Coded levels for factors used in response surface design
1.3.6 大米抗氧化肽微胶囊的存放实验
称取1 g大米抗氧化肽,以及按多肽含量计算含有相同质量抗氧化肽的微胶囊,分别用透明塑料自封袋包装后,于常温((25±5)℃)条件下存放30 d,每隔5 d取样1 次,参照文献[21]方法测定大米抗氧化肽对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基的清除率。
1.3.7 微胶囊产品表面形态的观察
将微胶囊产品置于105 ℃烘箱中干燥至质量恒定,在红外灯下用导电胶将样品固定在样品台上,喷金后用扫描电镜观察微胶囊产品的表面结构。
1.4 数据统计分析
数据分析采用SPSS 19.0和Design-Expert 8.0,利用Microsoft Excel 2007和Design-Expert 8.0作图。
2 结果与分析
2.1 单因素试验
2.1.1 芯材与壁材质量比对微胶囊包埋率的影响
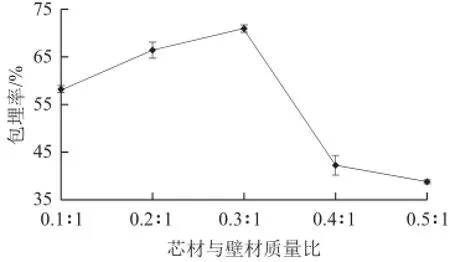
图1 芯材与壁材质量比对包埋率的影响Fig.1 Effect of mass ratio of core to coating on microencapsulation efficiency
从图1可以看出,当芯材与壁材质量比不超过0.3∶1时,包埋率随芯材与壁材质量比的增加而增加;当芯材与壁材质量比大于0.3∶1时,包埋率下降。这可能是因为海藻酸钙的三维网状结构的包埋能力有限[26],达到最大包埋量后,继续增加芯材会导致芯材无法被壁材完全包埋,包埋率受到影响。初步确定芯材与壁材质量比为0.3∶1。
2.1.2 海藻酸钠质量分数对微胶囊包埋率的影响
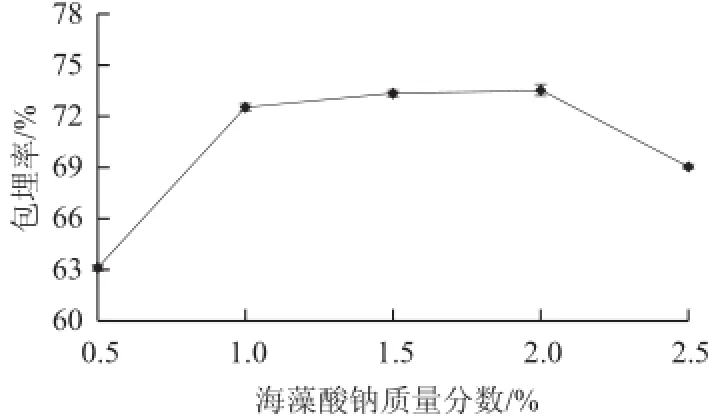
图2 海藻酸钠质量分数对包埋率的影响Fig.2 Effect of sodium alginate concentration on microencapsulation efficiency
由图2可知,海藻酸钠质量分数在0.5%~1.0%范围内,微胶囊包埋率逐渐上升;在1.0%~2.0%时,包埋率上升趋势缓慢;在2.0%~2.5%时,包埋率反而下降。因为当海藻酸钠质量分数较低时,其不能与CaCl2充分反应,形成的微囊膜较薄,易破损,导致微胶囊包埋率较低;而当海藻酸钠质量分数过高时,其溶液黏度增加,不利于抗氧化肽与其充分混合,从而微胶囊包埋率降低[27-28]。
海藻酸钠质量分数还影响微胶囊的机械强度、成球难易及微胶囊的形状[18]。试验过程中也发现,海藻酸钠质量分数小于1.5%时,微球干燥后有塌陷现象;海藻酸钠质量分数为2.0%时则难以通过锐孔,造粒困难,甚至出现拖尾现象。因此,海藻酸钠的适宜质量分数在1.5%左右。
2.1.3 包埋温度对微胶囊包埋率的影响
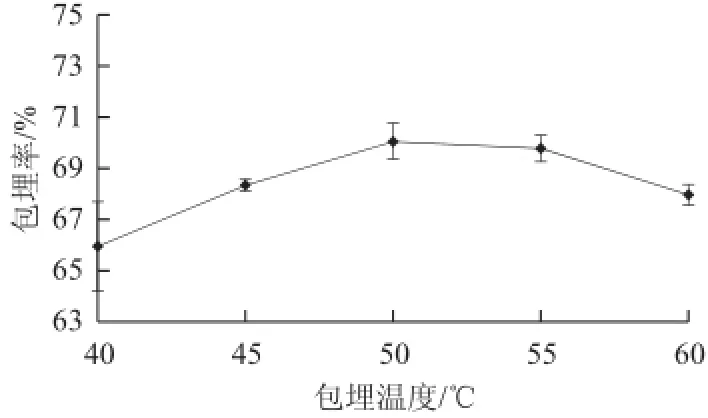
图3 包埋温度对包埋率的影响Fig.3 Effect of embedding temperature on microencapsulation efficiency
图3表明,包埋温度为50 ℃时,微胶囊包埋率最高。这是因为温度低时海藻酸钠黏度大,不利于锐孔造粒。随着温度升高,海藻酸钠分子间链段缠结得到一定舒展,更容易与Ca2+结合成网络结构,但温度过高,海藻酸钠分子中的α-1,4-L-古罗糖醛酸(G段)与β-1,4-D-甘露糖醛酸(M段)的结构单元容易分开,不易与钙离子形成网络结构,凝胶性能变差[29]。方差分析结果表明操作温度对包埋率影响不显著(P>0.05),同时考虑到温度过高易造成大米抗氧化肽失活,最终确定包埋温度为50 ℃,在响应面优化试验中不再将操作温度列为试验因素。
2.1.4 CaCl2质量分数对微胶囊包埋率的影响
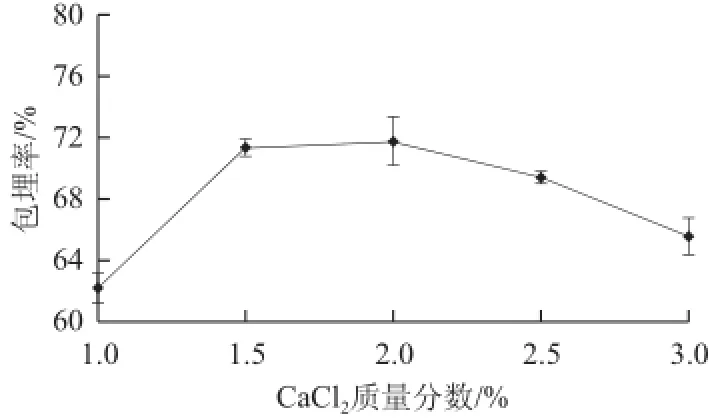
图4 CaCl2质量分数对包埋率的影响Fig.4 Effect of calcium chloride concentration on microencapsulation efficiency
从图4可知,CaCl2质量分数在1.0%~1.5%范围内,微胶囊包埋率逐渐上升;在1.5%~2.0%时,包埋率上升趋势趋于平衡;在2.0%~3.0%时,包埋率反而下降。因为凝固液中的CaCl2质量分数越低,海藻酸钠与Ca2+交联越不完全,所形成的海藻酸钙微球的皮层越薄,强度差,影响包埋率;而CaCl2质量分数过高时,外层迅速凝固,在内层固化前形成致密的皮层,阻碍了凝固剂向内层的继续扩散和内层的充分固化,同样不利于微球强度的提高[30]。
CaCl2还影响微胶囊的外形和颜色[31]。试验过程中发现,CaCl2质量分数小于2.0%时,海藻酸钙微球形成速度慢,且有黏连现象。质量分数大于2.0%时,成品有涩味,色泽较深。初步确定CaCl2质量分数的适宜水平为2.0%。
2.1.5 蔗糖脂肪酸酯质量分数对微胶囊包埋率的影响
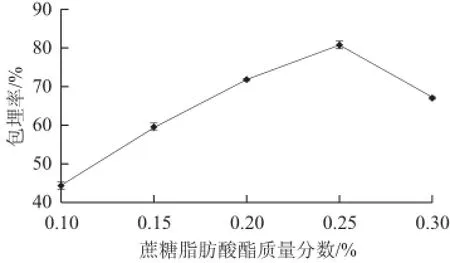
图5 蔗糖脂肪酸酯质量分数对包埋率的影响Fig.5 Effect of sucrose fatty acid ester concentration on microencapsulation efficiency
图5显示,微胶囊包埋率在蔗糖脂肪酸酯质量分数为0.25%时达到最大,随后开始下降。这可能是因为蔗糖脂肪酸酯质量分数较低时,它不仅可以通过范德华力、疏水键、静电力、氢键和大米抗氧化肽形成脂-多肽复合物,还可以填充在海藻酸钠的网络结构中[32],使形成的微胶囊膜致密,可更好地包住芯材。而质量分数过高的蔗糖脂肪酸酯进入到海藻酸钠分子链的间隙后,会使海藻酸钠分子链间的空隙增大,链间作用力减小[33],导致形成的微胶囊膜强度减弱,包埋率下降。初步确定蔗糖脂肪酸酯质量分数为0.25%。
2.2 响应面试验
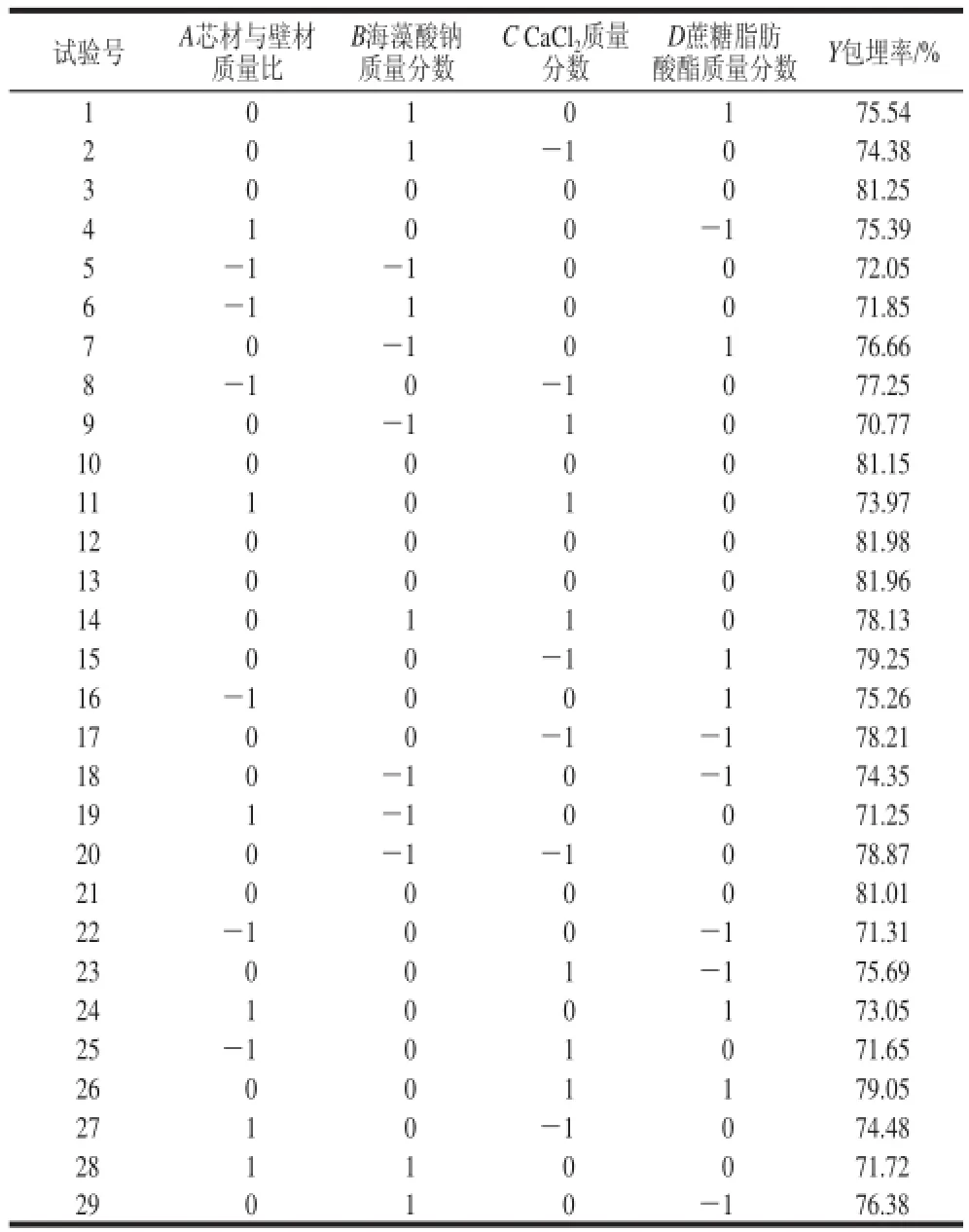
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken Experimental design and results
根据单因素试验结果,对影响微胶囊包埋率的4 个主要因素(芯材与壁材质量比、海藻酸钠质量分数、CaCl2质量分数、蔗糖脂肪酸酯质量分数)进行了Box-Behnken响应面优化。Box-Behnken试验设计与结果见表2。
利用Design-Expert 8.0软件对表2数据进行分析,得到响应值包埋率(Y)对芯材与壁材质量比(A)、海藻酸钠质量分数(B)、CaCl2质量分数(C)和蔗糖脂肪酸酯质量分数(D)的二次多项式回归模型:
Y=81.47+0.082A+0.34B-1.10C+0.62D+0.34AB+ 2.54AC-3.15AD+2.96BC-0.79BD+0.58CD-22.74A2-4.10B2-1.63C2-1.82D2
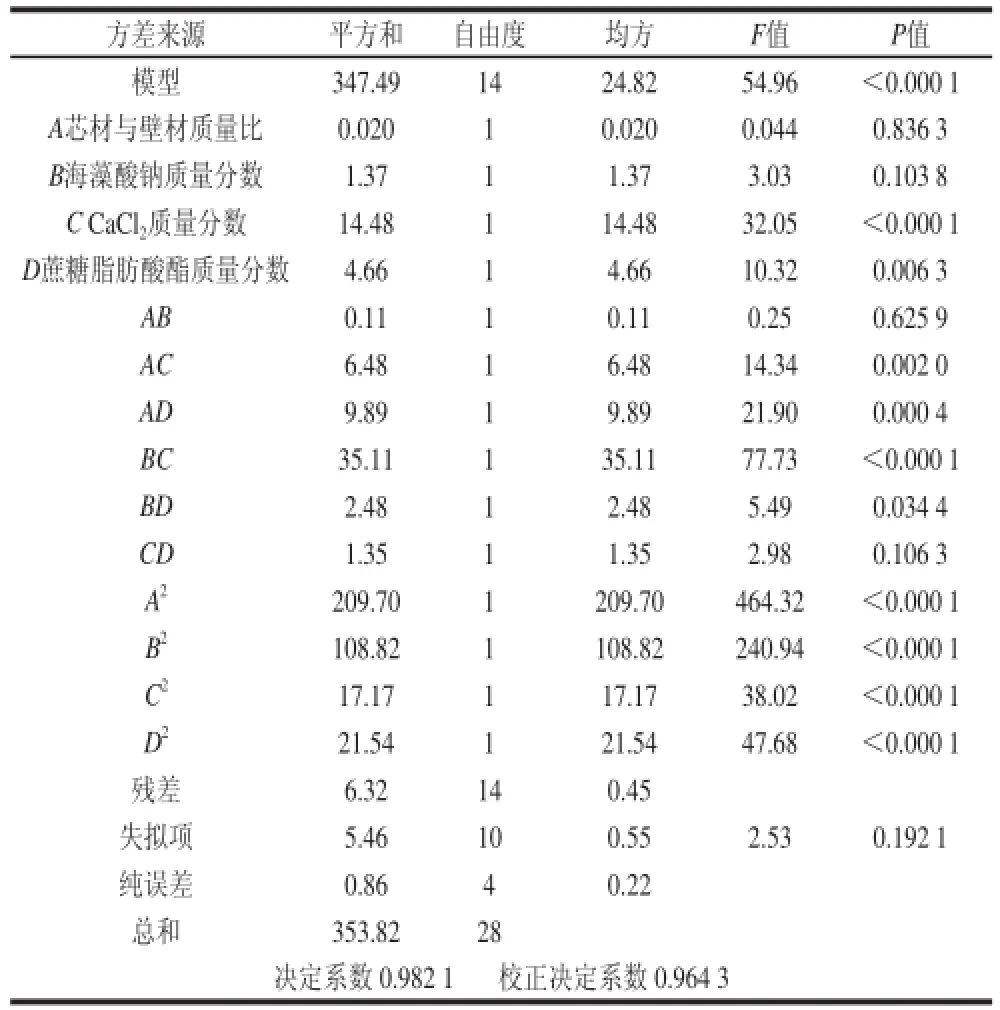
表3 响应面回归方程方差分析Table 3 ANOVA for the response surface quadratic model
由表3可知,所得的回归方程极显著(P<0.000 1),且失拟检验不显著(P=0.192 1>0.05),说明此回归模型理想,用方程拟合4 个因素与包埋率之间的关系是可行的。决定系数R2=0.982 1,说明包埋率的实测值与预测值之间有较好的拟合度。综合以上分析可知:该模型与实际情况拟合较好,可用于预测包埋率的变化情况。
从对包埋率的影响来看,一次项C(CaCl2质量分数)与D(蔗糖脂肪酸酯质量分数)对包埋率影响极显著,一次项A(芯材与壁材质量比)与B(海藻酸钠质量分数)对包埋率没有显著影响,影响顺序为C>D>B>A;二次项A2、B2、C2和D2对结果影响极显著;交互项AC、AD和BC对结果影响极显著,BD影响显著,而AB和CD则无显著影响。
此外,对影响微胶囊包埋率显著因素(P<0.01)之间的交互作用进行考察,并绘制如图6所示的响应面图。
从图6a可看出,芯材与壁材质量比不变,随着CaCl2质量分数的增加,微胶囊包埋率呈先增后减趋势,在1.9%~2.1%达到最大值;随着芯材与壁材质量比的增加,微胶囊包埋率呈先增加后下降的趋势,最适范围在0.25∶1~0.3∶1。在试验设计的条件范围内,两者交互作用表现为微胶囊包埋率的增加。
如图6b所示,当蔗糖脂肪酸酯质量分数较低或较高时,随着芯材与壁材质量比的增加,微胶囊的包埋率均呈先升高后下降的趋势,在0.25∶1~0.3∶1达到最适值,但蔗糖脂肪酸酯质量分数较低时的增幅比较高时的增幅大。在蔗糖脂肪酸酯添加量过多的情况下,阻碍了海藻酸钠与CaCl2的交联反应,所以增加反应体系中的芯材含量对提高包埋率的作用影响较小。从响应面图中包埋率出现的最大值区域来看,适当地提高芯材与壁材质量比和蔗糖脂肪酸酯质量分数有利于包埋率的增加。
图6c表明,当CaCl2质量分数不变,随着海藻酸钠质量分数的增加,微胶囊包埋率呈相应增加趋势,在1.4%~1.6%达到最适值;随着CaCl2质量分数的增加,包埋率呈先增加后下降的趋势,最适值在1.7%~1.9%。在微球成型这个反应体系中,海藻酸钠和CaCl2是造粒成功的关键因素,提高海藻酸钠质量分数所起到的增加包埋率的作用要高于提高CaCl2质量分数所起到的作用。当海藻酸钠质量分数和CaCl2质量分数的过高或者过低时,都会导致微胶囊包埋率的降低,这与吴彩娥等[17]研究结果是一致的。
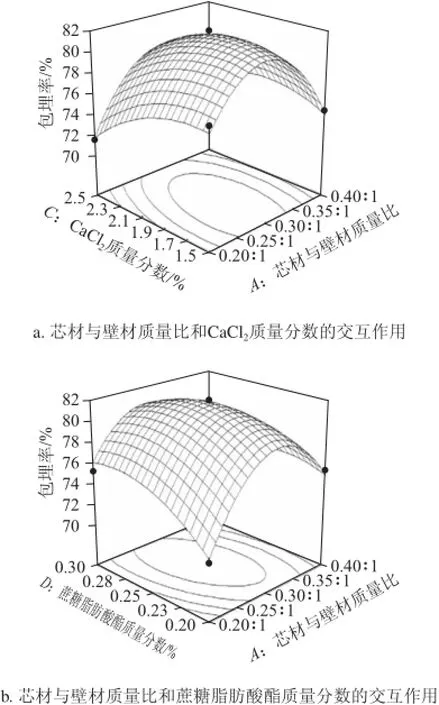
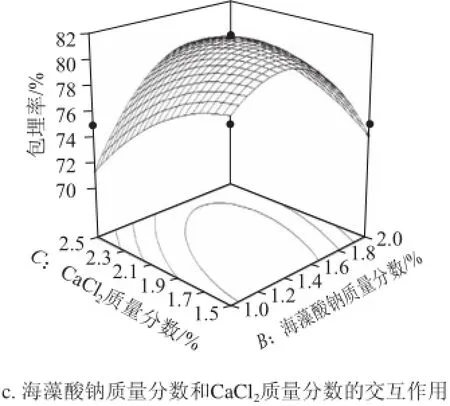
图6 试验因素交互作用的响应面图Fig.6 Response surface plot showing interactive effects of experimental conditions on microencapsulation efficiency
对回归方程求一阶偏导数解方程后得A=0.29∶1、B=1.43%、C=1.76%、D=0.26%,即制备大米抗氧化肽微胶囊的最优工艺参数为芯材与壁材质量比0.29∶1、海藻酸钠质量分数1.43%、CaCl2质量分数1.76%、蔗糖脂肪酸酯质量分数0.26%、包埋温度50 ℃。为便于操作,选取芯材与壁材质量比0.3∶1、海藻酸钠质量分数1.4%、CaCl2质量分数1.8%、蔗糖脂肪酸酯质量分数0.26%及包埋温度50 ℃进行3 次验证实验,包埋率平均值为81.24%,与预测结果81.75%基本吻合(相对误差约0.6%),表明所建模型准确、可行。
2.3 大米抗氧化肽微胶囊存放实验
常温((25±5)℃)贮存条件下,微胶囊化前后大米抗氧化肽对DPPH自由基和羟自由基清除率变化情况见表4。
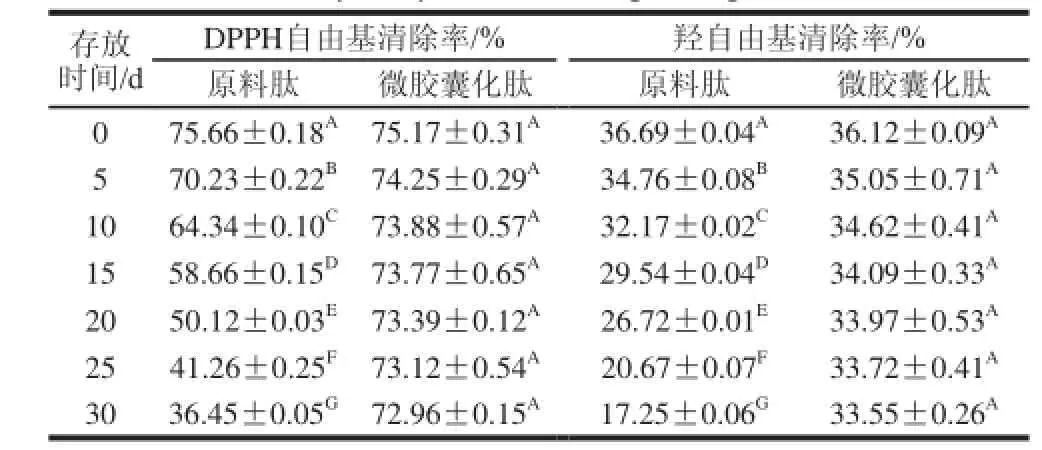
表4 存放期间大米抗氧化肽对DPPH自由基和羟自由基清除率变化Table 4 Changes in scavenging capabilities of original and microencapsulated rice antioxidant peptide against DPPH radical and hydroxyl radical during storage
从表4可以看出,在常温条件下((25±5)℃)存放时,未经包埋的原料肽对DPPH自由基和羟自由基的清除率下降极显著(P<0.01),存放30 d后,其对DPPH自由基和羟自由基的清除率分别由75.66%和36.69%降至36.45%和17.25%,各自下降了39.21%和19.44%;微胶囊化抗氧化肽对DPPH自由基和羟自由基的清除率显著高于原料肽(P<0.05),仅下降了2.21%和2.57%。由此可见,微胶囊化处理对大米抗氧化肽活性起到了很好的保护作用。
2.4 微胶囊产品的表面形态

图7 微胶囊产品干燥前的表面形态Fig.7 Surface morphology of microcapsule products

图8 微胶囊产品的扫描电镜图Fig.8 Microstructure of microcapsule products
如图8所示,以海藻酸钠为壁材、CaCl2为凝固剂制备的大米抗氧化肽微胶囊的形态呈圆球形,且大小均一,与图7相比微球无变形现象,结构仍较完整,表面没有裂缝产生,壁材结构的完整性和致密性较好,表明锐孔法制备的微胶囊对芯材具有良好的保护作用。
3 结 论
1)利用响应面设计优化锐孔法制备大米抗氧化肽微胶囊的工艺条件,建立了制备大米抗氧化肽微胶囊的数学模型,得到了合适的工艺条件为:芯材与壁材质量比0.3∶1、海藻酸钠质量分数1.4%、CaCl2质量分数1.8%、蔗糖脂肪酸酯质量分数0.26%、包埋温度50 ℃。在此条件下,所制得微胶囊的包埋率为81.24%,与模型预测值81.75%基本吻合,说明所建模型准确可行。2)常温((25±5)℃)条件下存放时,未包埋的大米抗氧化肽对DPPH自由基和羟自由基的清除率下降极显著(P<0.01),存放30 d后,其对DPPH自由基和羟自由基的清除率分别下降了39.21%和19.44%,而微胶囊化抗氧化肽对DPPH自由基和羟自由基的清除率仅下降了2.21%和2.57%,表明微胶囊化是提高抗氧化肽稳定性的一种较好方法。3)大米抗氧化肽微胶囊产品的扫描电镜结果显示,微胶囊产品的表面结构均保持完整,形态较均一,无裂痕、空洞和破裂现象产生,表明壁材对芯材起到了保护作用。
参考文献:
[1] 张晖, 唐文婷, 王立, 等. 抗氧化肽的构效关系研究进展[J]. 食品与生物技术学报, 2013, 31(7): 673-679.
[2] 张君慧, 张晖, 王兴国, 等. 大米蛋白酶解制备抗氧化肽的研究[J].食品与发酵工业, 2008, 34(5): 71-75.
[3] 马海乐, 刘斌, 李树君, 等. 酶法制备大米抗氧化肽的蛋白酶筛选[J].农业机械学报, 2010, 41(11): 119-123.
[4] 王章存, 崔胜文, 袁道强, 等. 高压酶解大米蛋白抗氧化活性及其分子质量分布[J]. 中国粮油学报, 2013, 28(7): 1-4.
[5] 井乐刚, 赵新淮. 复合维生素微胶囊制备中壁材用量及浓度对成品的影响[J]. 农业工程学报, 2008, 24(3): 303-306.
[6] 杨宝玲, 陈烨. 玉米淀粉-辛烯基琥珀酸淀粉酯制备亚麻油微胶囊[J].农业工程学报, 2010, 26(7): 364-368.
[7] 皮钰珍, 刘长江, 岳喜庆, 等. β-环糊精鹿胎盘肽微胶囊的制备[J]. 食品科学, 2009, 30(4): 69-71.
[8] LI Ranran, ZHANG Xingxiang, SHI Haifeng. Effect of manufacturing parameters on the release profiles of casein-loaded alginate microspheres prepared by emulsification/internal gelation[J]. Journal of Controlled Release, 2011, 152(1): 154-155.
[9] ZHU Aimei, CHEN Jian, LIU Qinglin, et al. Controlled release of berberine hydrochloride from alginate microspheres embedded within carboxymethyl chitosan hydrogels[J]. Journal of Applied Polymer Science, 2011, 120(4): 2374-2380.
[10] 陈超, 杨剑, 朱俊晨, 等. 益生菌微胶囊化壁材与方法的研究进展[J].食品工业科技, 2012, 33(14): 403-407.
[11] DESAI K G, PARK H J. Effect of manufacturing parameters on the characteristics of vitamin C encapsulated tripolyphosphatechitosan microspheres prepared by spray-drying[J]. Journal of Microencapsulation, 2006, 23(1): 91-103.
[12] 杨芙莲, 刘文彦. 锐孔法制备黄酮类化合物微胶囊及其释放性的研究[J]. 现代食品科技, 2013, 29(2): 297-300.
[13] 王顺民, 薛正莲, 余建斌. 山核桃油微胶囊技术研究[J]. 食品工业科技, 2012, 33(1): 268-271.
[14] 董志俭, 沈煜, 夏书芹, 等. 复合凝聚球状多核薄荷油微胶囊的耐热性研究[J]. 食品科学, 2009, 30(5): 120-123.
[15] 江定心, 徐汉虹, 杨晓云. 植物源农药印楝素微胶囊化工艺及防虫效果[J]. 农业工程学报, 2008, 24(2): 205-208.
[16] 刘欣, 郭星尧, 韩亚, 等. 海藻酸钠为囊材锐孔法制备铁叶绿酸钠微囊[J]. 现代食品科技, 2009, 25(9): 1043-1045.
[17] 吴彩娥, 徐克勇, 李元瑞, 等. 气流式锐孔法制作弥猴桃油微胶囊的研究[J]. 农业工程学报, 2006, 22(3): 133-136.
[18] 徐丽萍, 姚鹏程. 锐孔法制备玉米胚中还原型谷胱甘肽微胶囊[J].哈尔滨商业大学学报, 2011, 27(1): 47-50.
[19] 丁保淼, 袁武华. 锐孔法制备原花青素微胶囊工艺研究[J]. 食品与机械, 2012, 28(6): 214-217.
[20] 王丽玲, 候旭杰, 高超. 均匀设计优化红枣色素微胶囊化工艺研究[J].食品研究与开发, 2012, 33(5): 108-110.
[21] 贾俊强, 马海乐, 曲文娟, 等. 超声预处理大米蛋白制备抗氧化肽[J].农业工程学报, 2008, 24(8): 288-292.
[22] 庞杰, 张甫生, 肖丽霞, 等. 魔芋生物碱的微胶囊化工艺及生防效果试验[J]. 农业工程学报, 2003, 19(4): 188-192.
[23] 国家药典委员会. 中华人民共和国药典: 二部[S]. 2010年版. 北京:中国医药科技出版社, 2010: 231-232.
[24] 孙月梅, 江连洲, 李佳栋. 乳化-凝胶化法制备大豆功能肽缓释微囊的研究[J]. 食品科技, 2008, 33(9): 117-120.
[25] ROBERT L M, RICHARD F G, JAMES L H. Statistical design and analysis of experiments[M]. New Jersey: John Wiley and Sons, 2003: 585-586.
[26] 刘杨, 任力, 季培红, 等. 海藻酸钠的提纯及海藻酸钙多孔支架的制备[J]. 华南理工大学学报, 2012, 40(7): 142-147.
[27] 李瑞伟, 曾令兵, 张辉, 等. 草鱼出血病细胞疫苗微囊制备与体外释放研究[J]. 上海海洋大学学报, 2013, 22(2): 212-217.
[28] 熊涛, 冯超, 谢明勇. 植物乳杆菌NCU116微胶囊制备工艺的优化设计[J]. 食品科学, 2012, 33(1): 152-156.
[29] 包永华, 陆芝娟, 刘莉, 等. 响应面设计法优化海藻酸钙凝胶珠制备条件[J]. 食品工业, 2012, 33(7): 28-30.
[30] 郭肖青, 朱平, 王新. 海藻纤维的制备及其应用[J]. 纺织导报, 2006(7): 45-50.
[31] 杜双奎, 吕新刚, 于修烛, 等. 锐孔法制作食醋微胶囊[J]. 食品与发酵工业, 2009, 35(5): 85-89.
[32] 单成俊, 陈正行. 类脂物质对大米蛋白可食用膜的影响[J]. 食品与生物技术学报, 2006, 25(4): 89-92.
[33] 郭锦棠, 张瑾, 殷俊威. 抗菌性海藻酸钠膜的制备及性能分析[J]. 天津大学学报: 自然科学与工程技术版, 2013, 46(7): 653-658.
Response Surface Methodology for the Optimization of Preparation Process for Rice Antioxidant Peptide Microcapsules by Piercing Method
CHEN Li1, ZHANG Yu1,*, TAN Yi-cheng1, LIN Qin-lu2
(1. Key Laboratory for Food Science and Biotechnology of Hunan Province, Hunan Agricultural University, Changsha 410128, China; 2. National Engineering Laboratory for Rice and By-product Deep Processing, Center South University of Forestry and Technology, Changsha 410004, China)
Microcapsules of rice antioxidant peptide with enhanced stability were prepared by piercing method using sodium alginate as the wall material. Operating parameters such as mass ratio of core to wall material, sodium alginate concentration, temperature, calcium chloride concentration, and sucrose fatty acid ester concentration were optimized by response surface methodology based on the microencapsulation efficiency of rice antioxidant peptide. The prepared microcapsules were subjected to storage tests and electron microscopic observation. The results showed that the optimal experimental conditions were 0.3:1, 1.4%, 50 ℃, 1.8%, and 0.26% for mass ratio of core to wall material, sodium alginate concentration, temperature, calcium chloride concentration, and sucrose fatty acid ester concentration, respectively. Experiments under these optimal conditions led to a microencapsulation efficiency of 81.24%, showing a relative error of only 0.6% compared to the expected value (81.75%). Storage test revealed that the stability of microencapsulated rice antioxidant peptide was improved obviously. Scanning electron microscopy images showed that the surface morphology and structure of microencapsulated rice antioxidant peptide were intact. Therefore, microencapsulation is a good way to protect the activity of antioxidant peptide. These results could provide references for actual production of rice antioxidant peptide microcapsules.
piercing m ethod; rice antioxidant peptide; microcapsules; microencapsulation efficiency
TS218
A
1002-6630(2014)22-0097-07
10.7506/spkx1002-6630-201422018
2014-03-26
湖南省教育厅优秀青年项目(11B061);稻谷及副产物深加工国家工程实验室开放基金项目(2012KF2002)
陈丽(1987—),女,硕士研究生,研究方向为农产品加工。E-mail:125428107@qq.com
*通信作者:张喻(1972—),女,教授,博士,研究方向为农产品加工。E-mail:skxzhangyu@163.com

