紫薯花青素提取条件优化及淀粉等产物的制备
史光辉,胡志和,*,马科铭,孙振刚,武文起,冯永强
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津海河乳业有限公司,天津 300402)
紫薯花青素提取条件优化及淀粉等产物的制备
史光辉1,胡志和1,*,马科铭1,孙振刚2,武文起2,冯永强2
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津海河乳业有限公司,天津 300402)
以‘紫罗兰’紫薯为原料,研究同步提取紫薯花青素以及制备紫薯淀粉、纤维素和紫薯蛋 白的工艺及参数。紫薯与酸 乙醇(pH 2)混合破碎、过滤、沉淀分离淀粉;将滤渣和分离淀粉后上清液混合,用微波辅助法提取花 青素并优化提取条件;花青素提取 液沉淀分离紫薯蛋白;提取花青素的滤渣制备紫薯纤维素。结果表明:微波辅助提取紫薯中花青素的最佳工艺条件为微波时间4 min、微波温度52 ℃、料液比1∶22. 40(g/mL)、乙醇体积分数62%(pH 2),在此条件下紫薯花青素的提取率(93.64 ±0.69 )%、粗提物 中花青素含量(9.58±0.20) mg/g。制备的紫薯淀粉质量分数(95.77±0.41)%、得率(占总淀粉质量分数)(73.06±1.03)%;滤 渣 粉中纤维素含量(117.11±2.69) mg/g;制备的紫薯蛋白中蛋白质含量(524.78±24.84) mg/g。该制备方法能够提高紫薯的利用率,降低生产成本。
紫薯;微波;花青素;淀粉;蛋白质
紫薯(Ipomoea batat Poir.),原名川山紫,又名紫薯、紫红薯,属旋花科一年生草本植物。紫薯花青素的主要组成成分是矢车菊素和芍药素。由于紫薯花青素含有酰化基团,比一般无酰化基团的花青素对光、热等的敏感度稳定,具有更好的耐热性和耐光性[1]。这些性质对紫薯花青素的提取及生理活性的发挥具有重要意义。紫薯不仅富含天然花青素和丰富的锌、铁、铜、锰、钙、硒等微量元素[2-5],而且含有膳食纤维[6-7]。
国内外研究发现紫薯花青素可以有效地抑制由四氯化碳引发的急性肝损伤及由二甲基亚硝胺引起的肝纤维化[8-12],可以有效改善糖尿病及高血压[13],促进糖代谢和脂代谢的良性循环[14],具有抗肿瘤的功能[15]。
目前国内外主要利用紫薯进行工业化淀粉生产,而剩下的紫薯渣及上清液中丰富的花青素没有得到充分利用。本实验用鲜紫薯为原料,用制备淀粉后的皮渣进一步提取花青素,同时,还可获得紫薯粗蛋白、紫薯纤维素等产品,为紫薯综合利用提供参考。
1 材料与方法
1.1 材料与试剂
紫薯(‘紫罗兰’) 天津韩家墅海吉星农产品市场。
氯化钾、无水乙酸钠、甲醇、丙酮、盐酸、无水乙醇、浓硫酸、苯酚、硫酸铜、亚甲蓝、酒石酸钾钠、氢氧化钠、乙酸锌、冰乙酸、乙酸铅、硫酸钠、亚铁氰化钾、葡萄糖、十六烷基三甲基溴化铵、石油醚等试剂均为分析纯 天津昊斯生物技术有限公司。
1.2 仪器与设备
FA1104N型电子天平 上海精密科学仪器有限公司;MAS-L型微波快速制样系统 上海新仪微波化学科技有限公司;L535-1型低速离心机 湘仪离心机仪器有限公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;FE20型实验室pH计 梅特勒-托利多仪器(上海)有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;SHB-Ⅲ循环水式真空泵 上海比朗仪器有限公司;FD-2型冷冻干燥机 北京博医康实验仪器有限公司;101-2BN可视干燥箱 天津市华北实验仪器有限公司;JJ-2组织捣碎匀浆机 常州国华电器有限公司。
1.3 方法
1.3.1 工艺流程
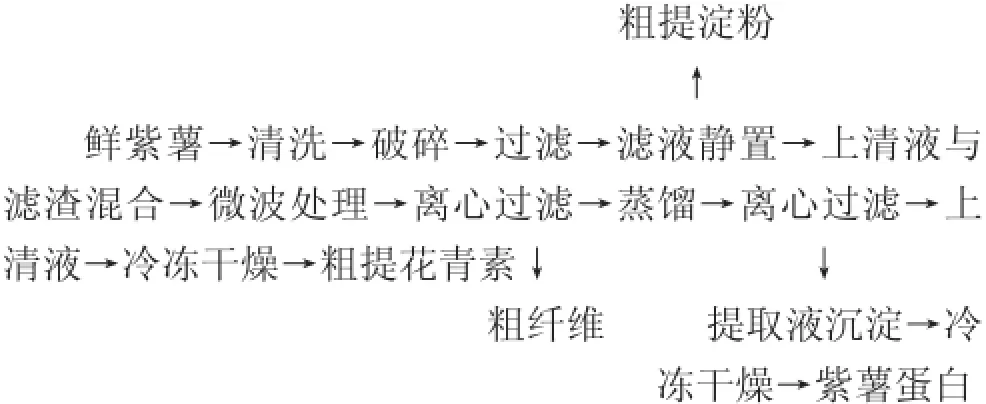
1.3.2 原料处理
选取无损伤无腐烂的新鲜紫薯,清洗干净后,以酸乙醇(pH 2)作为提取剂,纱布过滤,滤液静置,待淀粉自然沉淀,利用虹吸原理使上清液与沉淀分离,然后将滤渣与上清液混合,进行微波提取。
1.3.3 紫薯中各物质含量的检测
淀粉含量:酸性水解法[16];纤维素含量:酸性洗涤法[17-18];蛋白质含量:凯氏定氮法[19];还原糖含量:兰-埃农法[20];多糖含量:苯酚-硫酸法[21-23]。
紫薯花青素含量的检测:称取5 g的鲜紫薯,选取60%酸乙醇(pH 2)作提取剂,料液比1∶20(g/mL),破碎后用纱布过滤,滤液静置沉淀,待淀粉分离后,将上清液与滤渣混合,在微波温度50 ℃条件下提取4 min,提取液在4 000 r/min转速离心20 min,将上清液过滤后稀释10 倍,测定紫薯花青素的最大吸收波长。分别用pH 1.0的氯化钾缓冲液和pH 4.5的无水乙酸钠缓冲液将样品稀释适当倍数,在525 nm和700 nm波长处测定稀释液的吸光度,根据式(1)计算花色苷含量[24]。

式中:A为吸光度,A=(A525nmpH1.0-A700nmpH1.0)-(A525nmpH4.5-A700nmpH4.5);ε为矢车菊素-3-葡萄糖苷的消光系数(26 900);DF为稀释因子;Mw为矢车菊素-3-葡萄糖苷的相对分子质量(449.2)。

1.3.4 紫薯花青素的提取[25-28]
1.3.4.1 提取溶剂的选择
准确称取4份5 g的紫薯,分别以蒸馏水(pH 2)、60%甲醇(pH 2)、60%乙醇(pH 2)、60%丙酮(pH 2)作提取剂,料液比1∶20(g/mL),用JJ-2组织捣碎匀浆机破碎90 s后用纱布过滤,滤液静置沉淀,待淀粉分离后,将上清液与滤渣混合,在微波温度50 ℃条件下提取4 min,每种提取溶剂重复3 次,提取液在4 000 r/min转速离心20 min,取上清液测定花青素提取量,确定最佳提取溶剂。
1.3.4.2 酸乙醇提取紫薯花青素条件的确定
分别称取5 g的紫薯,以不同乙醇体积分数、微波时间、微波温度、料液比作为不同条件进行单因素试验,每种条件重复3次,微波功率400 W,提取结束后将提取液在4 000 r/min转速离心20 min,取上清液测定花青素提取量。
选用体积分数分别为40%、50%、60%、70%和80%乙醇(pH 2)作提取剂,料液比为1∶20(g/mL),用JJ-2组织捣碎匀浆机破碎90 s后过滤,滤液静置沉淀,待淀粉分离后,分离的上清液与滤渣混合,在微波温度50 ℃条件下提取4 min。
选用60%乙醇(pH 2)作提取剂,料液比1∶20(g/mL),用JJ-2组织捣碎匀浆机破碎90 s后过滤,滤液静置沉淀,待淀粉分离后,上清液与滤渣混合,采用不同微波温度30、40、50、60、70、80 ℃,微波处理时间为4 min。
选用60%乙醇(pH 2)作提取剂,料液比1∶20(g/mL),用JJ-2组织捣碎匀浆机破碎90 s后过滤,滤液静置沉淀,待淀粉分离后,上清液与滤渣混合,在微波温度50 ℃条件下,微波时间采用2、3、4、5、6 min,并在相同的温度条件下与搅拌提取比较提取率。
选用60%乙醇(pH 2)作提取剂,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),用JJ-2组织捣碎匀浆机破碎90 s后过滤,滤液静置沉淀,待淀粉分离后,上清液与滤渣混合,在微波温度50 ℃条件下提取4 min。
1.3.4.3 响应面法优化紫薯花青素的提取条件
在单因素试验基础上,用响应面法优化紫薯花青素的提取条件。响应面试验设计见表1。

表1 响应面试验设计因素水平表Table 1 Factors and levels of response surface design
1.3.5 紫薯淀粉及纤维素的制备
按照优化的紫薯花青素提取条件,将紫薯与酸乙醇(pH 2)按照比例混合破碎,纱布过滤,滤液静置,待淀粉自然沉淀,利用虹吸原理使上清液与淀粉沉淀分离,淀粉沉淀在40 ℃烘干,得到粗制淀粉。
分离的上清液与滤渣混合,采用微波辅助法提取花青素。将提取液与滤渣过滤分离,提取花青素后的滤渣95 ℃烘干,粉碎,过筛,得到富含紫薯膳食纤维制品。
1.3.6 紫薯蛋白的制备
取1.3.5节中分离的花青素提取液,置于离心机中4 000 r/min转速离心20 min,过滤所得上清液经50 ℃减压浓缩,分离乙醇,将浓缩液冷却至室温,在4 000 r/min转速离心20 min,得到上清液与沉淀。上清液经真空冷冻干燥后获得紫薯花青素的粗提物,沉淀物为富含 紫薯蛋白 的副产物。
2 结果与分析
2.1 紫薯中成分含量测定

表2 紫薯中各成分质量分数Table 2 Chemical composition of purple sweet potato
由表2可知,紫薯干粉中主要成分为淀粉和纤维素,花青素质量分数为2.79ˆ。
2.2 紫薯花青素的全波长扫描
选用酸性乙醇微波处理提取紫薯花青素,结果见图1。紫薯提取液分别在295、322 nm以及525 nm处出现吸收峰,是典型花色苷特征吸收峰[29-30],表明紫薯提取液中含有花色苷类物质。在322 nm波长处出现吸收峰表明花色苷分子中存在酰基化的特征峰,说明紫薯花青素结构中存在酰基化。

图1 紫薯花青素紫外-可见吸收光谱图Fig.1 UV-visible absorption spectra of purple sweet potato anthocyanins
2.3 提取溶剂的选择
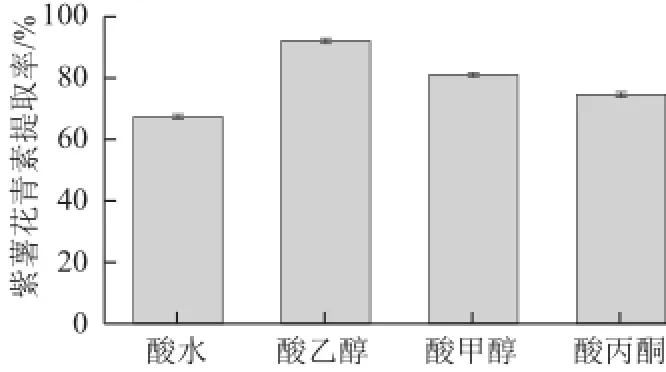
图2 提取溶剂种类对花青素提取率的影响Fig.2 Effect of different extraction solvents on the yield of anthocyanins
花色苷可溶于水、甲醇、乙醇等极性溶剂中。花色苷在弱酸性条件下稳定,因此通常选用酸性溶剂进行提取。由图2可知,酸性乙醇提取效果最 好,花青素提取率为92.04%,酸性甲醇次之,酸性 水溶液对紫薯花青素的提取效果最差,提取率仅为67.45%。因此,选择酸性乙醇作为提取溶剂。
2.4 不同条件对紫薯花青素提取效果
2.4.1 乙醇体积分数对紫薯花青素提取率的影响

图3 乙醇体积分数对花青素提取率的影响Fig.3 Effect of ethanol concentration on the yield of anthocya nins
由图3可知,提取液乙醇体积分数较低时,紫薯花青素的提取率随乙醇体积分数的增大而升高。当体积分数大于60%时,紫薯花青素提取率反而随体积分数升高而降低,这可能是因为乙醇体积分数升高,溶液极性的改变,影响了水溶性花青素的溶出。因此,选择体积分数60%乙醇作为提取溶剂。
2.4.2 微波温度对紫薯花青素提取率的影响

图4 微波温度对花青素提取率的影响Fig.4 Effect of extraction temperature on the yield of anthocyanins
由图4可见,在30~50 ℃温度范围内,随着温度的升高,紫薯花青素的提取率也相应的增高,但在温度高于50 ℃时,花青素提取率迅速降低,这可能是因为温度高于50 ℃后,随着温度的升高,其中残余的淀粉受热糊化,阻止了花青素的溶出,从而使得提取率下降[27]。因此,采用50 ℃进行提取效果较好。
2.4.3 微波时间对紫薯花青素提取率的影响
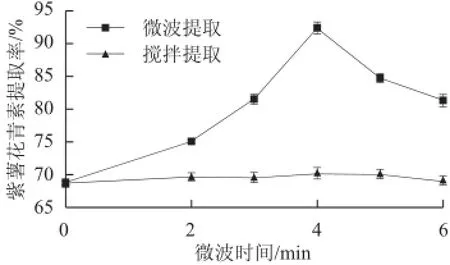
图5 微波时间对花青素提取率的影响Fig.5 Effect of microwave irradiationtime on the yield of anthocyanins
从图5可知,当微波时间为4 min时,花青素提取率最高,达到92.44%,但是在微波时间超过4 min时,提取率随时间延长而降低,这可能是由于微波时间延长,使得花青素的结构发生改变,导致花青素不稳定,从而降低了紫薯花青素的提取率[28]。与50 ℃搅拌提取对比,搅拌提取随时间的延长对紫薯花青素的提取率影响不大,说明微波提取紫薯花青素的提取效果优于相同温度条件下的搅拌提取。因此,选择4 min微波提取紫薯花青素效果较好。
2.4.4 料液比对紫薯花青素提取率的影响
由图6可知,随着提取剂含量的增大,紫薯花青素提取率逐渐增加,当料液比达到1∶20(g/mL)时,随提取剂用量增大,花青素溶出变缓,这可能是紫薯中花青素已基本溶出,所以增 长趋势变缓,提取剂用量的增加会增大提取成本,所以选取1∶20(g/mL)的料液比提取。

图6 料液比对花青素提取率的影响Fig.6 Effect of solid-to-liquid ratio on the yield of anthocyanins
2.4.5 提取条件的优化
在上述单因素试验结果的基础上,选取微波时间(A)、微波温度(B)、料液比(C)、乙醇体积分数(D)为4 个影响因素,以紫薯花青素提取率(Y)为响应值进行Box-Behnken试验设计,对紫薯花青素提取率进行优化。响应面设计方案及结果和回归模型的方差分析见表3和表4。
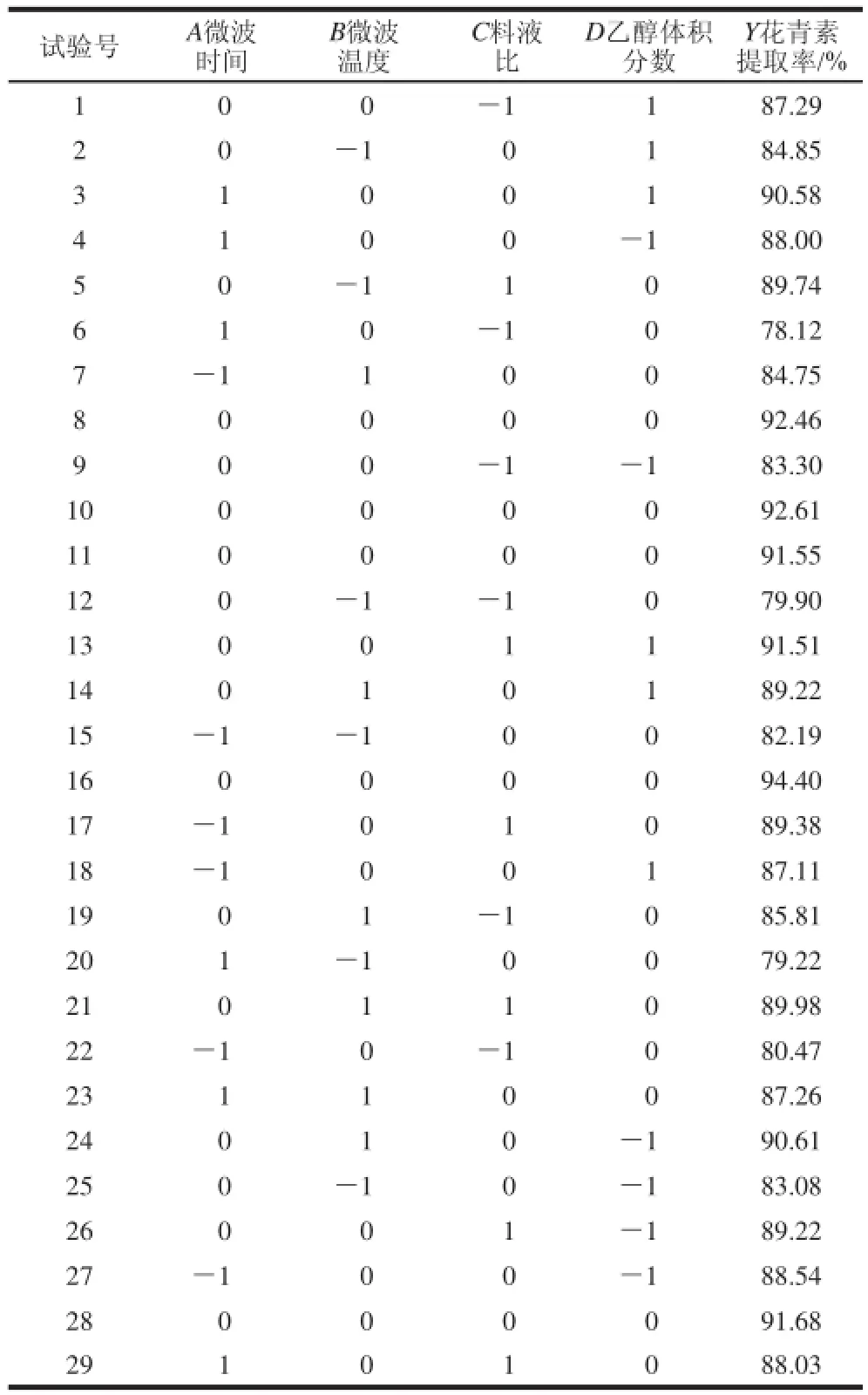
表3 响应面试验设计及结果Table 3 Experimental design and results for response surface analysis

表4 回归模型的方差分析Table 4 Analysis of variance for the regression equation
采用Design-Expert 8.05进行数 据处理,得到二次多元回归模型:Y=92.54-0.10A+2.39B+3.58C+0.65D+ 1.37AB+0.25AC+1.00AD-1.42BC-0.79BD-0.43CD-4.49A2-4.12B2-3.35C2-0.78D2。
模型整体P<0.01,表明该二次方程模型极显著,失拟项P=0.123 5>0.05,不显著,说明本试验中未知因素干扰较小。R2=0.907 1>0.85,表明该方程对试验的拟合情况较好,可以用该方程代替真实的试验点对结果进行预测以及分析。由F值和一次项系数可以得到各因素对紫薯花青素提取影响大小的关系顺序为:料液比>微波温度>乙醇体积分数>微波时间。优化的花青素提取条件为微波时间4.06 min、微波温度51.95 ℃、料液比1∶22.40(g/mL)、乙醇体积分数62%。
由图7a~7c可知,随着微波时间(A)变化,紫薯花青素的提取率呈抛物线的变化,紫薯花青素的提取率在达到最高值后,随微波时间与温度的增大,呈现降低的趋势。这可能是随着微波时间的延长,紫薯花青素结构发生改变,继而使得提取率下降。
由图7a、7d、7e可知,随着微波温度(B)的变化,紫薯花青素的提取率同样呈现先上升后下降的变化趋势,这可能是因为温度升高导致紫薯中残存淀粉的糊化影响了花青素的溶出。
从图7b、7d、7f可以看出,花青素的提取率随料液比(C)中溶剂含量的增大而升高,曲线趋于平缓,这可能是在其余因素达到一定的值时,紫薯花青素大部分已经被提取出来,继续增大溶剂含量,花青素提取率的变化也不明显。
从图7c、7e、7f可以看出,乙醇体积分数(D)与其余三项交互作用中,随着乙醇体积分数的变化,曲线趋近于直线,所以在AD、BD、CD的交互作用中,乙醇体积分数的影响不显著。
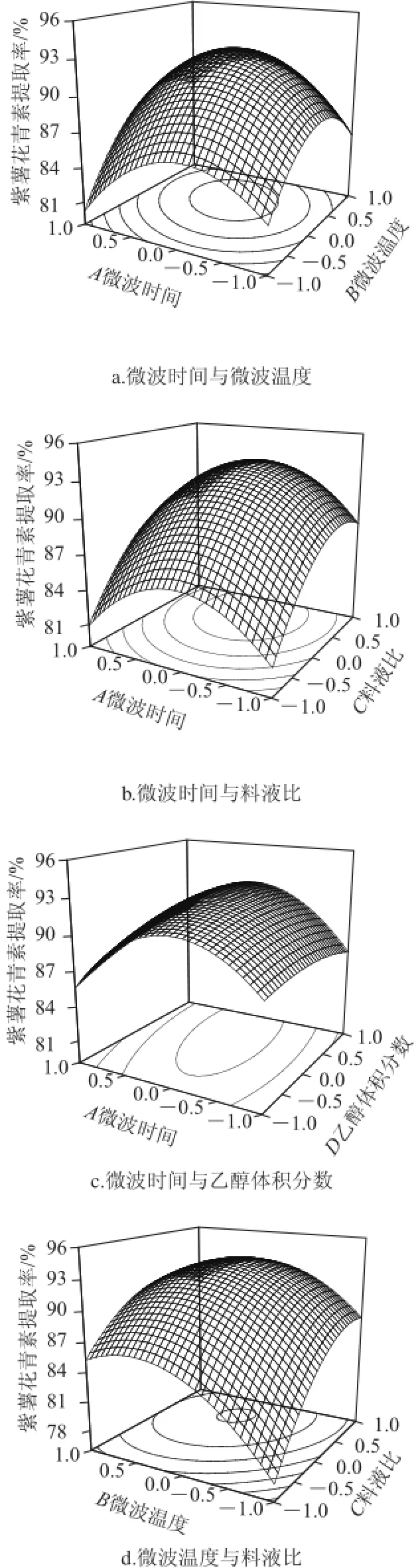

图7 各因素间交互作用对紫薯花青素提取率的影响Fig.7 Effect of extraction parameters on the yield of anthocyanins
2.4.6 紫薯花青素提取的优化与验证
根据所得到的模型,可分析得出在紫薯中的花青素最佳提取工艺条件为微波时间4.06 min、微波温度51.95 ℃、料液比1∶22.40(g/mL)、乙醇体积分数62%(pH 2),此时紫薯花青素提取率为93.70%。为验证预测的结果,考虑到实际情况,对最佳工艺作简单的修正,微波时间4 min、微波温度52 ℃、料液比1∶22.40(g/mL)、乙醇体积分数62%(pH 2),重复实验3 次,紫薯花青素的提取率为(93.64±0.69)%,与预测值基本一致,该方程与实际情况拟合较好。在该条件下,测得上清液干燥物中紫薯花青素含量(9.58±0.20)mg/g。
2.5 紫薯淀粉、纤维素及紫薯蛋白的制备
根据优化的紫薯与酸乙醇(pH 2)比例,将紫薯与酸乙醇进行混合破碎,用纱布过滤,滤液静置沉淀,利用虹吸原理使固液分离,将沉淀物在40 ℃烘箱中干燥,即为淀粉。经检测,淀 粉质量分数为(95.77±0.41)%,得率(占总淀粉质量分数)为(73.06±1.03)%。
将滤渣与分离淀粉后的上清液混合,在优化的提取条件下,采用微波辅助法提取花青素。然后,将滤渣和花青素提取液分离。滤渣在95 ℃烘箱内烘干,冷却后粉碎,测得滤渣粉中纤维素含量(117.11±2.69)mg/g、淀粉含量(761.03±30.25)mg/g、蛋白质含量(50.48±3.26)mg/g、还原糖含量(19.42±0.56)mg/g。
将分离的花青素提取液离心,过滤,所得上清液经减压浓缩,分离乙醇,将浓缩液冷却至室温后离心,得到上清液与沉淀。上清液经真空冷冻干燥后获得紫薯花青素的粗提物,沉淀物为富含紫薯蛋白的副产物。该副产物中,蛋白质含量(524.78±24.84)mg/g、淀粉含量(129.38±5.26)mg/g、还原糖含量(115.36±3.28)mg/g、多糖含量(44.32±0.73)mg/g、花青素含量(6.08±0.02)mg/g。
3 结 论
采用酸乙醇与紫薯混合破碎,先沉淀分离淀粉,再将上清液与滤渣混合提取花青素。微波辅助提取紫薯花青素的最佳工艺条件为微波时间4 min、微波温度52 ℃、料液比1∶22.40(g/mL)、乙醇体积分数62%(pH 2),在此条件下紫薯花青素的提取率为(93.64±0.69)%,该方法不仅可得到紫薯花青素粗提物(花青素含量(9.58±0.20)mg/g),还可获得高纯度紫薯淀粉(质量分数(95.77±0.41)%)、富含膳食纤维的紫薯滤渣(纤维素含量(117.11±2.69)mg/g)及富含紫薯蛋白的副产物(蛋白质含量(524.78±24.84)mg/g)。可使紫薯原料充分利用,降低生产成本。
[1] 洪镭, 刘亚鸥. 紫甘薯研究综述[J]. 吉林农业, 2010, 24(6): 140.
[2] 张明晶. 紫心甘薯的研究进展与综合开发利用[J]. 中国食物与营养, 2006(4): 19-21.
[3] 明兴加, 李坤培, 张明, 等. 紫色甘薯的开发前景[J]. 重庆中草药研究, 2006(1): 55-60.
[4] 温桃勇, 刘小强. 紫色甘薯营养成分和药用价值研究进展[J]. 安徽农业科学, 2009, 37(5): 1954-1956; 2035.
[5] 刘宜贵, 吴松青. 美国超短蔓黑红薯新品种[J]. 北京农业, 2002(12): 38.
[6] 刘保健, 潘巨忠. 富硒紫番薯的研究[J]. 现代农业科技, 2006(5): 7-8. [7] 王建民, 王永久. 日本川山紫的食用价值及栽培技术[J]. 陕西农业科学, 2005(1): 126-127.
[8] SUDA I, FURUTA S, NISHIBA Y, et al. Reduction of liver injury induced by carbon tetrachloride in rats administered purple colored sweetpotato juice[J]. Journal of the Japanese Society for Fo od Science and Technology, 1997, 44(4): 315-318.
[9] OBI F O, USENU I A, OSAYANDE J O. Prevention of carbon tetrachloride-induced hepatotoxicity in the rat by H. rosasinensis anthocyanin extract administered in ethanol[J]. Toxicology, 1998, 131(2): 93-98.
[10] HWANG Y P, CHOI J H, YUN H J, et al. Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf2-mediated antioxidant enzymes and reducing COX-2 and iNOS expression[J]. Food and Chemical Toxicology, 2011, 49(1): 93-99.
[11] CHOI J H, HWANG Y P, CHOI C Y, et al. Anti-fibrotic effects of the anthocyanins isolated from the purple-fleshed sweet potato on hepatic fibrosis induced by dimethylnitrosamine administration in rats[J]. Food and Chemical Toxicology, 2010, 48(11): 3137-3143.
[12] CHOI J H, HWANG Y P, PARK B H, et al. Anthocyanins isolated from the purple-fleshed sweet potato attenuate the proliferation of hepatic stellate cells by blocking the PDGF receptor[J]. Environmental Toxicology and Pharmacology, 2011, 31(1): 212-219.
[13] 胡志和, 张然嬉, 冯永强, 等. 提取紫薯淀粉的副产物对SHR血压的影响[J]. 食品科学, 2010, 31(21): 361-364.
[14] MATSUI T, EBUCHI S, KOBAYASHI M, et al. Anti-hyperglycemic effect of diacylated anthocyanin derived from Ipomoea batatas cultivar Ayamurasaki can be achieved through the α-glucosidase inhibitory action[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7244-7248.
[15] WANG Yongjian, ZHENG Yuanlin, LU Jun, et al. Purple sweet potato color suppresses lipopolysaccharide-induced acute inflammatory response in mouse brain[J]. Neurochemistry International, 2010, 56(3): 424-430.
[16] 卫生部. GB/T 5009.9—2008 食品中淀粉的测定[S]. 北京: 中国标准出版社, 2008.
[17] 侯先志, 陈志伟, 赵志恭, 等. 营养限制持续时间对粗纤维、中性洗涤纤维、酸性洗涤纤维、酸性洗涤木质素消化率的影响[J]. 动物营养学报, 1999, 11(增刊1): 191-194; 215.
[18] 杨斌, 殷引, 张浩博, 等. 洗涤剂法测定烟草及烟草制品中中性洗涤纤维、酸性洗涤纤维、酸性洗涤木质素的研究[J]. 中国烟草学报, 2012, 18(3): 10-15.
[19] 卫生部. GB/T 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[20] 卫生部. GB/T 5009.7—2008 食品中还原糖的测定[S]. 北京: 中国标准出版社, 2008.
[21] 陈立江, 王菁, 刘宇, 等. 南瓜多糖含量测定方法比较[J]. 辽宁大学学报: 自然科学版, 2014, 41(1): 76-81.
[22] 曲有乐, 李明, 李宪刚, 等. 海藻多糖片中多糖含量测定[J]. 浙江海洋学院学报: 自然科学版, 2009, 28(1): 91-94; 98.
[23] 黄生权, 敖宏, 郭爱玲. 真菌保健食品中多糖含量测定方法的比较[J].现代食品科技, 2010, 26(7): 767-771.
[24] 李金星, 胡志和, 马立志, 等. 超声波辅助提取蓝莓果渣中花色苷的条件研究[J]. 食品工业科技, 2013, 34(20): 255-259.
[25] 顾红梅, 张新申, 蒋小萍. 紫薯中花青素的超声波提取工艺[J]. 化学研究与应用, 2004, 16(3): 404-407.
[26] 杨华, 赖青青, 陈林松, 等. 采用微波辅助提取紫甘薯色素的工艺研究[J]. 食品工业科技, 2009, 30(4): 282-285.
[27] 王道武, 文茜, 张龙. 微波辅助提取紫薯花青素的研究[J]. 广东化工, 2010, 37(12): 24-26.
[28] 许正虹, 高彦祥, 石素兰, 等. 微波辅助萃取紫甘薯色素的研究[J].食品科学, 2005, 26(9): 234-239.
[29] 徐渊金, 杜琪珍. 花色苷分离鉴定方法及其生物活性[J]. 食品与发酵工业, 2006, 32(3): 67-72.
[30] 韩永斌. 紫甘薯花色苷提取工艺与组分分析及其稳定性和抗氧化性研究[D]. 南京: 南京农业大学, 2007: 73-74.
Optimization of Extraction Conditions of Anthocyanins from Purple Sweet Potato and Simultaneous Preparation of Starch and Other By-Products
SHI Guang-hui1, HU Zhi-he1,*, MA Ke-ming1, SUN Zhen-gang2, WU Wen-qi2, FENG Yong-qiang2
(1. Tianjin Key Laboratory of Food Biotechnology, School of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China; 2. Tianjin Haihe Dairy Co. Ltd., Tianjin 300402, China)
The objective of this study was to explore the simultaneous preparation of anthocyanins as well as the byproducts starch, cellulose and protein from purple sweet potato. ‘Violet’ purple sweet potato was mixed with acid ethanol (pH 2) and then crushed. After filtration of the mixture, the filtrate was precipitated to obtain starch, and the filtration residue was combined with the supernatant left after starch precipitation and extracted by a microwave-assisted solvent extraction technique to obtain anthocyanins. Purple sweet potato protein was precipitated from the extract and cellulose was obtained from the extraction residue. The optimal conditions for microwave-assisted extraction of anthocyanins were determined as microwave irradiation for 4 min, extraction at 52 ℃, and 62% aqueous ethanol adjusted to pH 2 as the extraction solvent at a solidto-solvent ratio 1:22.40 (g/mL), leading to an extraction yield of (93.64±0.69)% and an anthocyanins content of (9.58±0.20) mg/g in the extract. The purity of the starch product was (95.77±0.41)% and (73.06±1.03)% of the total starch was obtained. The dried filtration residue contained (117.11±2.69) mg/g cellulose. The purity of the protein product was (524.78±24.84) mg/g. With this preparation technique, better utilization of purple sweet potato could be achieved at lower costs.
purple sweet potato; m icrowave; anthocyanins; starch; protein
TS255.1
A
1002-6630(2014)22-0039-07
10.7506/spkx1002-6630-201422008
2014-06-25
天津市科技计划项目(14ZCZDNC00017);天津市高等学校创新团队项目(TD12-5049)
史光辉(1989—),男,硕士研究生,研究方向为食品生物技术。E-mail:shiguanghui2008@163.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

