基质固相分散萃取-气相色谱-串联质谱法同时测定蔬菜中195种农药残留
李 蓉,卢俊文,杨 芳,张朋杰,李拥军,谢建军,储大可
(1.中山出入境检验检疫局,广东 中山 528403;2.中山市农产品质量监督检验所,广东 中山 528400;3.广东出入境检验检疫局,广东 广州 510623;4.广东药学院,广东 中山 528400)
基质固相分散萃取-气相色谱-串联质谱法同时测定蔬菜中195种农药残留
李 蓉1,卢俊文1,杨 芳1,张朋杰1,李拥军2,谢建军3,储大可4
(1.中山出入境检验检疫局,广东 中山 528403;2.中山市农产品质量监督检验所,广东 中山 528400;3.广东出入境检验检疫局,广东 广州 510623;4.广东药学院,广东 中山 528400)
目的:建立一种蔬菜中195 种农药的气相色谱-质谱检测方法。方法:样品用乙酸乙酯匀浆提取后,经基质固相分散萃取法净化,气相色谱-质谱仪的选择反应监测模式-进行测定,内标法定量。结果:在0.01~1.00 mg/L质量浓度范围内,所有农药的线性相关系数均大于0.99,方法的定量限范围为1.9~25.5 μg/kg。分别在菜心、生菜、黄瓜、芹菜、土豆等蔬菜中进行3 个添加水平(10、20、100 μg/kg)实验,平均回收率为37.6%~136.7%,相对标准偏差为0.2%~15.3%。结论:该方法快速、灵敏、准确、高通量,具有良好的回收率和稳定性,较好地解决了样品本底成分复杂带来的基质干扰,适用于蔬菜中195种农药残留量的快速测定。
基质固相分散萃取;气相色谱-质谱;农药残留;蔬菜
在《中国居民膳食指南》中,蔬菜的建议摄入量占据了相当高的比例。农药在蔬菜的生长过程中发挥了重要作用,但因施用人员不注意使用的间隔时间,会造成上市蔬菜农药残留超标。近年来,世界各国对农产品中限制检出农药残留的种类迅速扩大,限量标准的要求更加严格。2013年3月1日,我国开始实施GB 2763—2012《食品中农药最大残留限量》,规定了食品中322种农药2293项最大残留限量,由此对检测技术的要求进一步提高。
目前农药残留检测手段有气相色谱技术[1-3]、液相色谱技术[4]、气相色谱-质谱联用技术[5-7]、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS-MS)技术[8-10]、气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS-MS)技术[11-13]和酶联免疫吸附法[14]。GC和LC由于受检测器限制,一般只能对一类农药进行检测,依靠保留时间定性,易出现干扰现象,准确性相对较差;GC-MS技术在分析较高沸点或低相对分子质量的农药时,易受基质成分和柱流失物等因素影响而导致灵敏度较低或发生干扰现象;LC-MS-MS技术灵敏度高,抗干扰能力强,但仪器昂贵维护成本高,目前难以推广普及;酶联免疫吸附法法对于多种成分的分析存在局限性。
本实验利用分散固相萃取(dispersive solid-phase extraction,DSPE)[15-18]-GC-MS-MS技术,建立了同时测定蔬菜中195 种农药残留的方法,前处理简单,试剂毒性小,消除了GC-MS技术在分析蔬菜尤其是复杂基质样品中农药残留时极易出现的干扰现象,大幅降低了检测成本,利于推广。本法测定的农药涵盖了有机磷类、有机硫代磷酸酯类和有机氯类杀虫剂,酰胺类杀螨剂,三唑类和有机氮保护性杀菌剂,苯胺基嘧啶类、酰胺类除草剂及杀虫剂前体等多种农药,使用选择反应监测模式和内标法定量,提高了分析的灵敏度和准确性,适用于蔬菜中农药多残留的快速筛查和确证检测。
1 材料与方法
1.1 材料与试剂
乙酸乙酯(色谱纯) 美国Merck公司;Cleanert N-丙基乙二胺(primary secondary amine,PSA)天津博纳艾杰尔科技有限公司;C18(分析纯) 德国CNW公司;无水硫酸镁、醋酸钠、无水硫酸钠(均为分析纯) 广州化学试剂厂;195种农药标准品(其中三唑磷的纯度为81.0%,其余标准品的纯度≥95.0%)、磷酸三苯酯(triphenyl phosphate,TPP) 德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
TSQ Quantum XLS系列三重四极杆质谱仪及其工作站 美国Thermo Fisher Scientific公司;2-16K台式离心机 德国Sartorius-Sigma公司;EYELA MMV-1000W振荡器 日本东京理化;涡旋混合器 德国IKA公司;TruboVapII全自动浓缩仪 美国Caliper公司;超纯水系统 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
各种农药单标储备液的配制:分别准确称取各农药标准品10 mg(精确至0.000 1 g),用乙酸乙酯溶解定容至10 mL,配制成1 g/L的标准储备液,储存于-18℃冰箱中备用。
混合标准储备液的配制:各取0.5 mL上述标准储备液,用乙酸乙酯定容至100 mL,即配制成各农药标准质量浓度为5 μg/mL的标准混合储备液。
混合标准工作液的配制:精密量取5.0 mL混合标准储备液,用乙酸乙酯定容至25 mL,配制成各农药标准质量浓度为1 μg/mL的标准混合工作液(为了避免多种农药共存对各自的稳定性产生影响,混合标液均临用现配)。
TPP内标溶液的配制:准确称取12.5 mg,用乙酸乙酯溶解并定容至25 mL;吸取上述溶液1.0 mL,用乙酸乙酯定容至25 mL,配制成20 μg/mL的内标溶液。
1.3.2 GC条件
色谱柱:TR-PESTICIDE(30 m×0.25 mm,0.25 μm);进样方式:程序升温不分流进样,程序升温汽化进样口:起始温度50℃,以8℃/min升至280 ℃;载气:He,99.999%;柱温采用程序升温,初始温度50℃,保持1 min,以30℃/min升至160℃,以5℃/min升至300℃,再以5℃/min升至310℃,保持3 min;柱流量1.3 mL/min;进样量:1 μL。
1.3.3 MS-MS条件
离子源温度:240℃;电离模式:电子电离源;质谱传输线温度280 ℃;溶剂延迟时间4.5 min;碰撞气(Ar)压力:1.5 mTorr;分析模式:定时选择性反应监测模式;定量方法:峰面积内标法定量。
1.3.4 样品提取与净化
称取样品10 g(精确到0.01 g)于50 mL离心管中,加入6 g MgSO4和2 g醋酸钠,准确加入50.0 μL TPP内标溶液,涡旋1 min;加入约5g(视样品含水率增减)经450℃灼烧过的无水硫酸钠,再准确加入20.0 mL乙酸乙酯,匀浆提取1 min,再置入振荡器振摇30 min,以4500 r/min离心5 min;准确吸取10 mL上清液上全自动浓缩仪(水浴温度调节到40℃),氮吹浓缩至约1 mL,定容至1.0 mL;将定容后的溶液加入150 mg MgSO4、50 mg PSA(根据需要再加50 mg C18),涡旋3 min,以转速为10000 r/min离心10 min,取上清液待GC-MS-MS分析。
2 结果与分析
2.1 前处理方法优化
2.1.1 提取溶剂的选择
常用的萃取溶剂有乙腈、乙酸乙酯、丙酮、甲苯、二氯甲烷等。因甲苯和二氯甲烷毒性强,对实验者伤害大,本实验中尽量避免将其作为提取溶剂。分别采用乙腈、乙酸乙酯、丙酮作为提取溶剂,乙腈的回收率为60.7%~125.1%,乙酸乙酯的回收率为53.2%~136.6%,丙酮的回收率为50.6%~150.9%。实验表明,乙腈的提取效果最好,乙酸乙酯次之,丙酮最差,但考虑到乙腈的毒性比乙酸乙酯大,所以选择低毒性的乙酸乙酯作为提取溶剂。
2.1.2 提取液的pH值对测定结果的影响
在提取溶剂中加入少量弱酸及弱酸盐可以形成缓冲体系,降低基质溶液酸碱性的影响,从而有效提高农药的提取率。对比加入不同量的醋酸钠(0、0.5、1、2、3 g)对提取效率的影响,发现加入2 g时绝大部分农药的回收率相对最高。 因此最后确定在提取溶剂中加入2 g醋酸钠。
2.1.3 前处理方法的选择
蔬菜是一类基质复杂的样品,本实验尝试采用如液-液萃取法、匀浆法、加速溶剂提取法、凝胶渗透萃取法、固相萃取法等对样品进行前处理操作,部分复杂基质难以消除,且不同前处理方法会造成不同农药成分的回收率偏低,影响检测结果。采用DSPE法对蔬菜样品进行前处理,方法快速简便、试剂消耗量小,且能有效去除复杂基质,大大减少了测定干扰。以菜心为例,几种前处理方法的比较见图1。
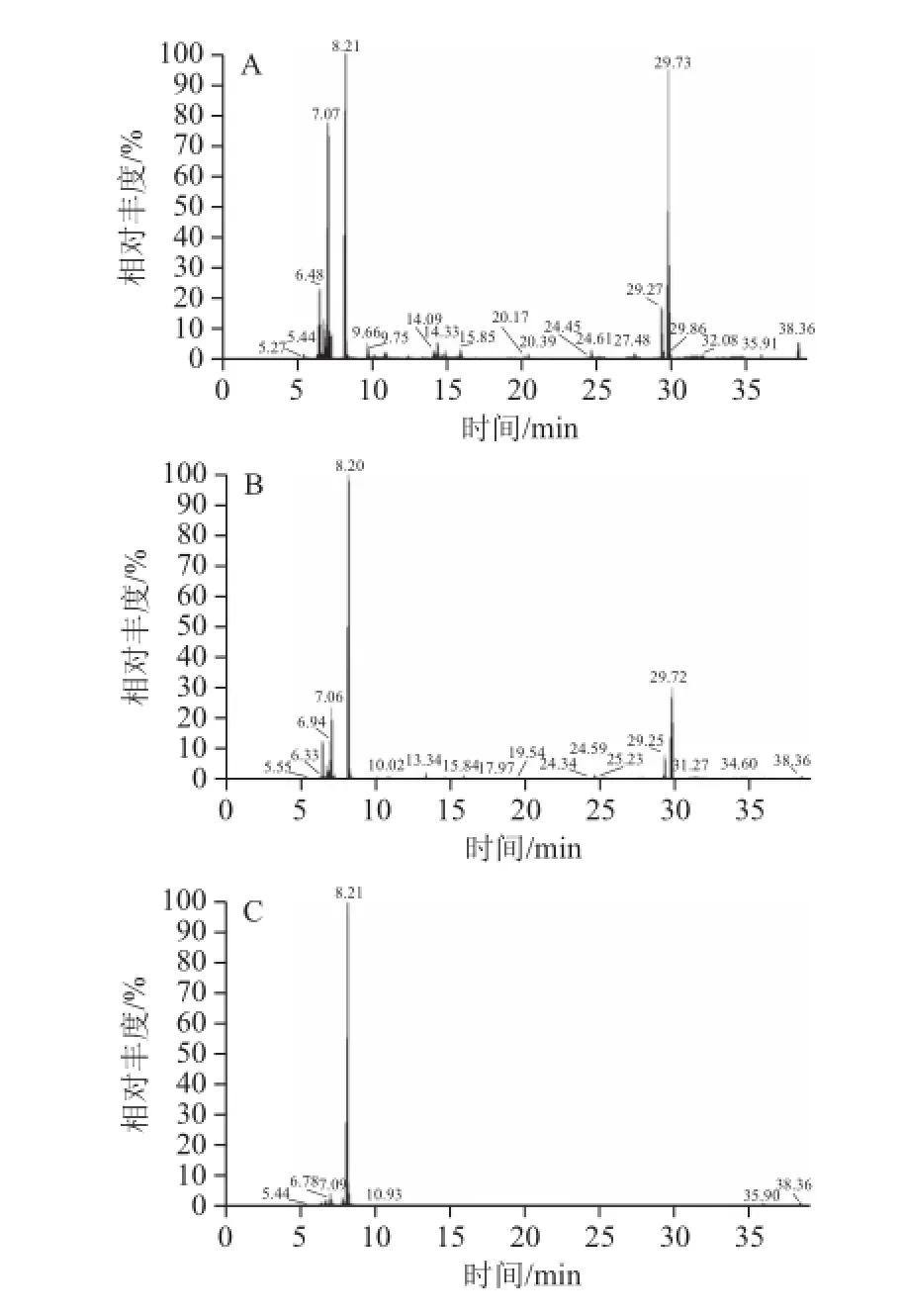
图1 加速溶剂(A)、氨基固相萃取(B)和DSPE(C)法空白基质图Fig.1 Total ion chromatogram of blank matrix by different extraction methods
由图1可见,采用DSPE法净化后的空白基质(图1C)杂峰的干扰大大减少,能除去蔬菜中绝大部分的复杂基质,达到理想的净化效果。
2.2 色谱条件优化
通过对进样口、3种相同规格不同极性色谱柱(DB-1701、DB-5和TR-PESTICIDE)的对比使用,以及对柱流量和升温程序的调整,确定了1.3.2节的GC条件。
2.3 质谱条件优化
本方法选择SRM模式下的2对离子对进行各农药的分析,其中1对离子对用于定量分析。为了获得最佳的质谱条件以保证定性定量的准确性,对各项质谱参数进行了优化。首先采用单一标准品进样,全扫描方式测定其保留时间和选择碎片离子,确定母离子,再采用产物离子扫描方式通过优化碰撞能量获得丰度比较高产物离子,并确定被测物SRM离子对,最后采用SRM模式对待测物进行定性定量分析。经过条件优化得到了理想的质谱条件和分离效果,195 种农残组分优化后SRM模式下的GCMS-MS条件见表1。图2为优化条件下0.05 mg/L基质加标工作液的总离子流色谱图。

图2 基质加标工作液(质量浓度0.05 mg/L)的总离子流图Fig.2 Total ion chromatogram of blank matrix spiked at 0.05 mg/L
2.4 线性范围与定量限
使用空白的蔬菜样品配制系列质量浓度的基质加标工作曲线(0.01~1.00 mg/L),在1.3.2、1.3.3节选定的GC、MS-MS条件下进样测定,以标准工作溶液中各农药的质量浓度(x,mg/L)为横坐标,定量离子提取色谱峰面积(y)为纵坐标绘制标准曲线,获得各农药的线性方程,相关系数均大于0.99。在空白样品中添加低质量浓度的混合标准溶液,按1.3.4节方法进行前处理后上机检测,按10倍信噪比得到各农药的定量限为1.9~25.5 μg/kg(表1)。
2.5 回收率与精密度
本实验对菜心、生菜、黄瓜、芹菜、土豆等几种蔬菜加标进行回收率和精密度测定。称取各空白样品10 g各18 份,在其中分别添加10、20 μg/kg和100 μg/kg添加水平,按1.3.4节进行前处理,在1.3.2、1.3.3节条件对样品进行分析,测定后计算回收率和相对标准偏差。结果显示,方法的加标平均回收率为37.6%~136.7%,相对标准偏差为0.2%~15.3%,菜心的加标回收实验结果见表1。

表1 优化后的多反应监测模式下的气相色谱-串联质谱仪的条件、加标回收率、精密度和定量限TTaabblle 1 Optimized conditions in MRM mode for GC-MS-MS, recoveries, precisions (RSDs) and limits of quantification (LOQs)
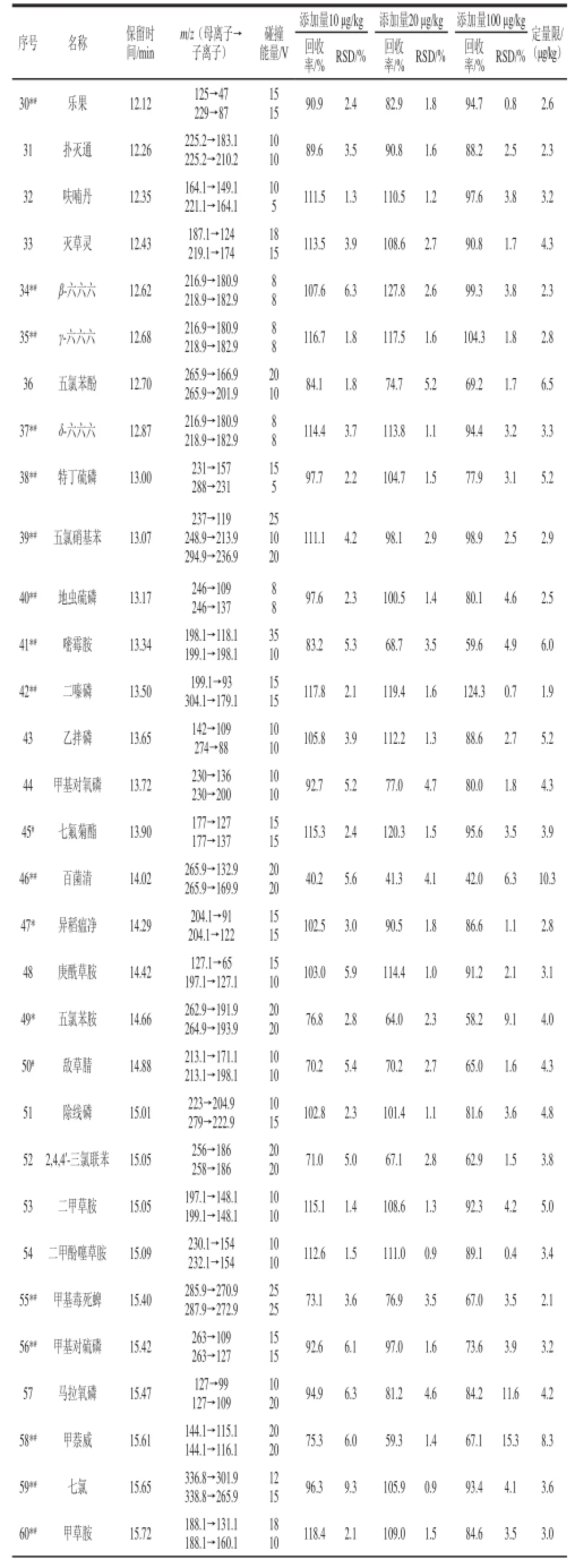
续表1

续表1

续表1

续表1

续表1
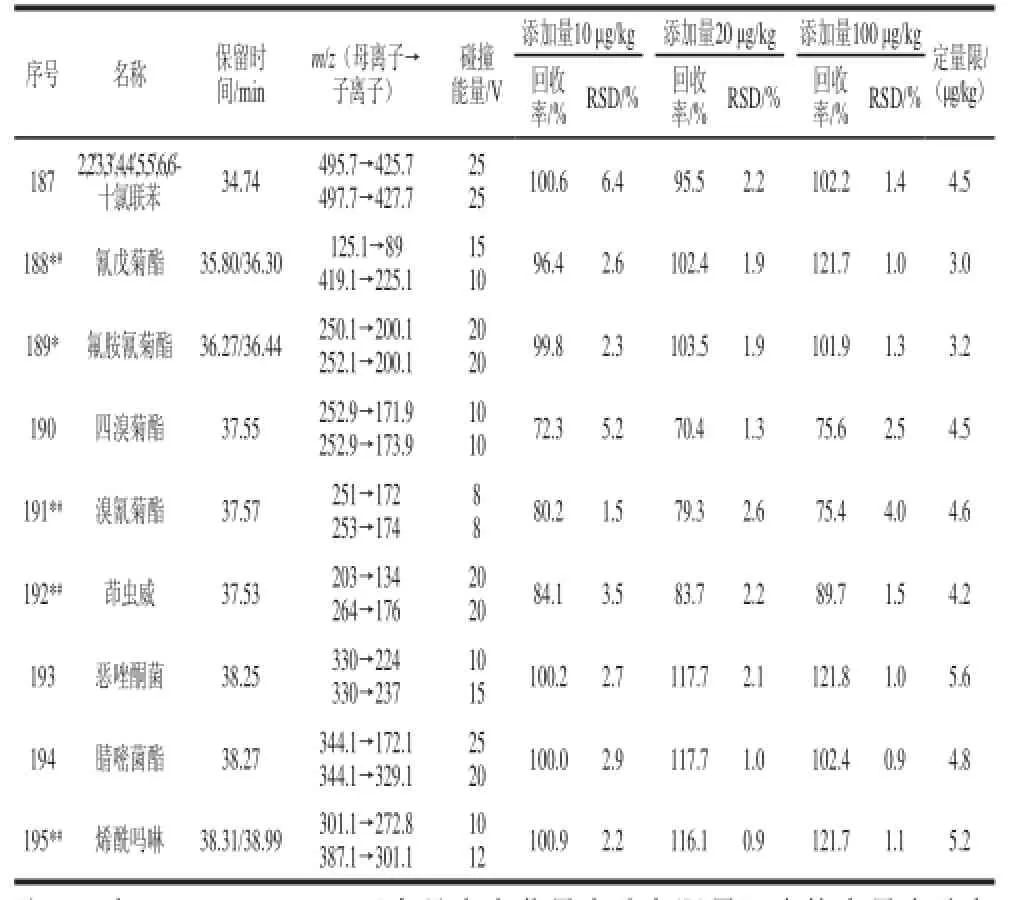
续表1
因PSA对脂肪酸、有机酸以及某些记性色素和糖类具有强亲和性和高容量,应用DSPE法对叶菜类、瓜菜类、茎类、块根类等几类蔬菜样品进行前处理后,能除去绝大多数杂质,可应用于大多数农药残留检测,其中苯达松、氟螨噻、叶菌唑、久效威、百菌清、定菌磷、蝇毒磷、杀草敏、敌菌丹、灭菌磷、亚胺硫磷、吡氟酰草胺、氟吡草胺等农残加标回收率低于50%,经查阅资料和反复实验,敌菌丹在乙腈中,氟螨噻、蝇毒磷在二氯甲烷中,苯达松、叶菌唑、久效威、定菌磷、杀草敏、吡氟酰草胺、氟吡草胺等在丙酮中,百菌清、灭菌磷、亚胺硫磷等在甲苯中溶解度更大,用丙酮、甲苯、二氯甲烷等为提取溶剂再进行加标实验,回收率均明显提高。
2.6 实际样品测定
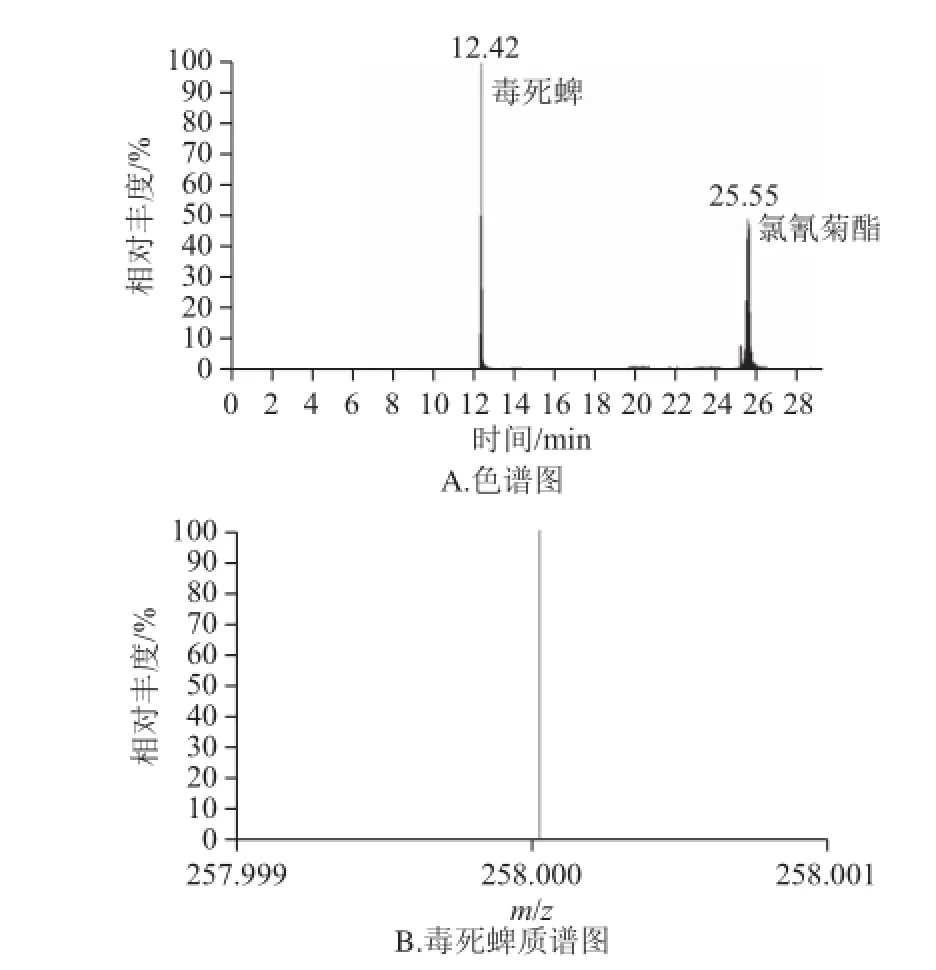
图3 阳性样品的色谱图及质谱图Fig.3 TIC chromatogram and MS-MS spectrum for a positive sample
使用该方法对生菜、菜心、黄瓜、芹菜等50多个尚未上市销售的样品进行了检测,结果在5 个样品中检出了毒死蜱、甲胺磷和氯氰菊酯3 种农药,其含量均在15 μg/kg以下,毒死蜱和氯氰菊酯特征色谱图及质谱图见图3。
3 结 论
本实验建立了蔬菜中195 种农药快速、灵敏、准确、高通量的DSPE-GC-MS-MS检测方法。相对于传统检测方法具有简便、快速、试剂消耗量小、选择性好、灵敏度高、抗基质干扰能力强的优势,满足国内对于蔬菜中农药残留的测定要求,适用于蔬菜样品中195 种农药残留量的快速筛查和定性确证检测。
[1] ADOU K, BONTOYAN W R, SWEENEY P J. Multiresidue method for the analysis of pesticide residues in fruits and vegetables by accelerated solvent extraction and capillary gas chromatography[J]. Journal of Agricultural and Food Chemistry, 2001, 49(9): 4153-4160.
[2] 沈丹玉, 汤富彬, 袁新跃, 等. 基质固相分散-气相色谱检测菊花中有机磷农药残留[J]. 食品科学, 2012, 33(18): 216-219.
[3] 王素方, 张西安, 张东飞, 等. 气相色谱法快速测定杜仲叶中有机氯菊酯类农药残留[J]. 食品科学, 2009, 30(18): 323-326.
[4] 李永新, 孙成均, 赵剑虹, 等. 高效液相色谱法同时测定蔬菜水果中的12种农药残留[J]. 色谱, 2006, 24(3): 251-255.
[5] 宋淑玲, 李重九, 马晓东, 等. 蔬菜中残留农药的石墨化碳黑净化和气相色谱-质谱检测方法[J]. 分析化学, 2008, 36(11): 1526-1530.
[6] 王明泰, 牟峻, 吴剑, 等. GC-MS法测定粮谷及油料中55 种有机磷农药残留量[J]. 分析试验室, 2006, 25(11): 110-117.
[7] 曹殿洁, 黄信龙. 分散固相萃取-气相色谱-质谱联用法快速检测蔬菜中18种农药残留[J]. 食品科学, 2013, 34(10): 219-222.
[8] 李岩, 郑锋, 王明林, 等. 液相色谱-串联质谱法快速筛查测定浓缩果蔬汁中的156种农药残留[J]. 色谱, 2009, 27(2): 127-137.
[9] 王素利, 任丽萍, 刘聪云, 等. 分散固相萃取净化液相色谱-质谱联用快速检测糙米中的多种残留农药[J]. 分析实验室, 2009, 28(4): 38-42.
[10] 柳菡, 徐锦忠, 丁涛, 等. 蔬菜中26 种农药残留的高效液相色谱-串联质谱法测定[J]. 分析测试学报, 2009, 28(2): 181-185.
[11] 李蓉, 卢俊文, 杨汝辉, 等. 气相色谱-串联质谱法测定水果中多种农药残留[J]. 中国卫生检验杂志, 2012(11): 2562-2565.
[12] 沈伟健, 余可垚, 桂茜雯, 等. 分散固相萃取-气相色谱-串联质谱法测定蔬菜中107种农药的残留量[J]. 色谱, 2009, 27(4): 391-400.
[13] 施家威, 李继革, 王玉飞, 等. 分散固相萃取-气相色谱-三重四极杆质谱分析蔬菜中112种农药残留[J]. 色谱, 2012, 30(6): 602-612.
[14] 王磊, 张丽杰, 吕伟, 等. 生物素-亲和素放大酶联免疫吸附法测定二乙基磷酸酯类有机磷农药[J]. 分析化学, 2011, 39(3): 346-350.
[15] 刘浩, 周芳, 李月娥. 分散固相萃取法对果蔬中农药残留前处理的优化[J]. 环境科学与管理, 2008, 33(5): 137-139.
[16] 郑文慧, 叶江雷, 王秀彬, 等. 分散固相萃取法在农药残留检测中应用的进展[J]. 分析仪器, 2011(4): 23-27.
[17] 郝开拓, 孔祥虹, 杜宝中, 等. 分散固相萃取-气相色谱-质谱法分析蕨菜-黑米中53种农药残留量[J]. 分析试验室, 2011, 30(6): 69-74.
[18] 陈健航, 叶瑜霏, 程雪梅, 等. 分散固相萃取-气相色谱-质谱联用法检测葱-韭菜和姜中多种农药残留[J]. 质谱学报, 2011, 32(6): 341-349.
Simultaneous Determination of 195 Pesticide Residues in Vegetables Using Solid Phase Dispersive Extraction-Gas Chromatography-Tandem Mass Spectrometry
LI Rong1, LU Jun-wen1, YANG Fang1, ZHANG Peng-jie1, LI Yong-jun2, XIE Jian-jun3, CHU Da-ke4
(1. Zhongshan Entry-Exit Inspection and Quarantine Bureau, Zhongshan 528403, China; 2. Zhongshan Quality Supervision and Inspection Institute of Agricultural Products, Zhongshan 528400, China; 3. Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China; 4. Guangdong Pharmaceutical University, Zhongshan 528400, China)
Objective: To develop a method for the determination of 195 pesticide residues in vegetables using gas chromatography with tandem mass spectrometry (GC-MS-MS) under a selected reaction monitoring (SRM) mode. Methods: The target compounds were extracted from samples with ethyl acetate and the extract was cleaned up by off-line solid phase dispersive extraction technique. The analytes were quantified by an internal standard method. Results: In the linear range (0.01–1.00 mg/L), the correlation coefficient for each pesticide was higher than 0.99. The average recoveries at three spiked levels (10, 20 and 100 μg/kg) varied from 37.6% to 136.7% with relative standard deviations (RSDs) between 0.2% and 15.3%. The limits of quantification (LOQ) (signal/noise ratio = 10) were 1.9–25.5 μg/kg. Conclusion: The method is rapid, sensitive, accurate and high throughput, without matrix interference and suitable for the analysis of 195 pesticide residues in vegetables.
solid phase dispersive extraction; gas chromatography-tandem mass spectrometry (GC-MS-MS); pesticide residues; vegetable
TS207.5
A
1002-6630(2014)24-0301-07
10.7506/spkx1002-6630-201424058
2014-04-01
中山市科技计划—农业科技攻关计划项目(20103A190);中山市科技发展专项(2013A3FC0251)
李蓉(1969—),女,高级工程师,本科,研究方向为食品安全检测技术。E-mail:lir@zs.gdciq.gov.cn

