毛细管电泳法测定糖果及调制酒中10 种人工合成色素
王丽芳,丁晓静,*,解 娜,赵 珊,王 志
(1.北京市疾病预防控制中心 食物中毒诊断溯源技术北京市重点实验室,北京 100013;2.首都医科大学公共卫生学院,北京 100069;3.河北农业大学理学院,河北 保定 071001)
毛细管电泳法测定糖果及调制酒中10 种人工合成色素
王丽芳1,2,丁晓静1,2,*,解 娜3,赵 珊1,王 志3
(1.北京市疾病预防控制中心 食物中毒诊断溯源技术北京市重点实验室,北京 100013;2.首都医科大学公共卫生学院,北京 100069;3.河北农业大学理学院,河北 保定 071001)
建立了糖果及调制酒中10 种常用人工合成色素的毛细管电泳-二极管阵列检测新方法。以75 μm×70 cm(有效长度60 cm)未涂敷石英毛细管为分离柱,25 min内实现了10 种人工合成色素的同时分离与测定。分离电压18 kV,检测波长为214 nm。研究了影响10 种人工合成色素分离的因素,如分离缓冲溶液的浓度、pH值及添加剂的浓度等。调制酒样品过膜后直接进样,粉碎后的糖果样品经提取液提取,离心后取上清液直接进样。10 种人工合成色素的质量浓度分别在1.0~40.0、1.5~60.0、2.0~80.0、3.0~120.0 mg/L范围内与其对应的校正峰面积呈良好线性关系(r≥0.999 6)。检出限(RSN=3)在0.3~1.0 mg/L之间,定量限(RSN=10)在1.0~3.0 mg/L之间。方法回收率在92.1%~106.5%之间,相对标准偏差(n=5)在0.5%~4.4%之间。本方法简便、准确,适用于常规实验室中糖果及调制酒中常用10 种人工合成色素的检测。
人工合成色素;糖果;调制酒;毛细管电泳
含偶氮基及芳香环结构的人工合成色素具有成本低廉、色泽鲜艳、色调多样、着色力强、易溶解、易调色等优点,在食品加工业中广泛使用[1-2],添加到食品中可恢复食品加工过程中损失的天然色素,使得食品更具有吸引力[3-4]和更美味,然而一些人工合成色素因过量食用而可能危害人的健康[5-6]。最近的研究表明柠檬黄可引起哮喘疾病及儿童多动症[7]。故各国都严格控制人工合成色素的使用范围和用量,欧盟于2010年禁止食品中添加人工合成色素[6],日本规定所有色素均应在标签上标识[8],我国规定食品中人工合成色素的最大使用量在0.3~0.6 mg/g[10]。为确保人工合成色素在我国规定的限量范围内使用及食品加工的质量控制,建立简便易行的食品中人工合成色素的准确检测方法尤为重要。
目前,基于分离技术的人工合成色素的主要分析方法有高效液相色谱(high performance liquid chromatography,HPLC)法[8-9,11-18]、超高效液相色谱(ultra-high performance liquid chromatography,UPLC)法[19-20]、UPLC/四极杆-飞行时间质谱(quadrupole-time of flight mass spectrometry,Q-TOF)法[21]及毛细管电泳(capillary electrophoresis,CE)法[22-31]。HPLC法需耗用大量有机溶剂,这些有机溶剂往往气味难闻且有致癌性,危害人体与环境;UPLC法尽管减少了有机溶剂的消耗量,但因色谱柱价格昂贵,填料致密,对前处理要求较高;UPLC-Q-TOFS法尽管定性能力强,但仪器的使用及维护成本高。CE因分离效率高、使用价廉的石英毛细管、试剂和样品量消耗少及分离模式多,特别适用于基体复杂的食品样品中色素的分析,用毛细管电泳对人工色素的检测已有文献报道,但同时分析的色素种类一般不超过8 种。故本研究建立了同时分离测定10 种人工合成色素的CE新方法,测定了糖豆及调制酒样品,获满意结果。
1 材料与方法
1.1 材料与试剂
调制酒及糖果 市购。
酸性红2G(纯度≥98%)、诱惑红(纯度≥98%)和胭脂红(纯度≥99%) 美国Sigma-Aldrich公司;新红(纯度≥98%) 德国Dr.Ehrenstorfer公司;偶氮宝石红 梯希爱化成工业发展有限公司;质量浓度1.0 mg/mL赤藓红及质量浓度0.5 mg/mL苋菜红、亮蓝、柠檬黄和日落黄标准溶液(纯度均≥99%) 中国计量科学研究院;硼砂(分析纯) 中国医药公司北京采购供应站;氢氧化铯(分析纯) 美国Acros Organics公司;氢氧化锂(分析纯) 北京新华化学试剂厂;聚乙二醇35 000(PEG 35 000,货号:81310) 美国Fluka公司;羟丙基-β-环糊精(HP-β-CD,摩尔质量1 459.8 g/mol) 比利时Acros Organics公司;氢氧化钠(优级纯)、氢氧化钾(分析纯) 北京化工厂;氢氧化钠(优级纯) 上海山海工学团实验二厂;实验用水为超纯水。
5 种色素标准储备液:分别称取酸性红2G、诱惑红、胭脂红、新红和偶氮宝石红各10 mg于同一1.5 mL 塑料离心管中,加入1 mL水溶解,配成10.0 mg/mL混合储备溶液,于4 ℃冰箱保存。
标准工作溶液:取上述5 种色素混合标准储备液及标准溶液,用样品提取液稀释成所需质量浓度的标准工作溶液,由于赤藓红见光易分解,故工作液需每天配制。
1.2 仪器与设备
Beckman P/ACE MDQ 型毛细管电泳仪(配二极管阵列检测器) 美国Beckman公司;F-50A型酸度计 北京屹源电子仪器科技公司;涡旋振荡器 英国Bibby Sterilin有限公司;Universal 32型高速离心机 德国Hettich公司;Milli-Elix/RiOs超纯水器 美国Millipore公司;A11B S25型均质仪 德国IKA公司。
1.3 方法
1.3.1 电泳条件
熔融石英毛细管(75 μm×70 cm,有效长度60 cm);分离缓冲溶液:30 mmol/L Na2B4O7+50 mmol/L CsOH+20 g/L PEG 35 000+40 mmol/L HP-β-CD(pH 10.00);样品提取液:将分离缓冲溶液直接用超纯水稀释10 倍;分离电压18 kV;进样时间15 s;检测波长214 nm;正极端进样,进样压力3.448 kPa;工作电流85 μA;操作温度25 ℃。由于标准溶液与实际样品基体不同,导致两者迁移时间可能会有一定程度的差异,因校正峰面积不随电渗流的改变而改变,可通过校正峰面积定量(峰面积除以迁移时间)来消除,以此保证定量结果的重复性[32]。
1.3.2 毛细管的预处理
新石英毛细管在使用前分别用1 mol/L氢氧化钠溶液洗20 min、水洗5 min及分离缓冲溶液洗5 min。每次进样前,用1 mol/L氢氧化钠溶液、水及分离缓冲溶液分别冲洗2 min,以保证迁移时间和校正峰面积的重复性。
1.3.3 样品前处理
糖豆类:将糖豆样品用均质仪粉碎。准确称取已粉碎的0.04 g糖豆于1.5 mL塑料离心管中,加入0.4 mL样品提取液,涡旋混匀使样品充分分散在样品提取液中,超声10 min,9 000 r/min离心10 min,取上清液直接进行测定。
调制酒类:过膜后直接进样。
2 结果与分析
2.1 检测波长的选择
通过二极管阵列检测器在线扫描获知10 种人工合成色素,除了在400~600 nm有特征吸收波长外,在低紫外波长210 nm附近都有共同的较强吸收峰。为尽可能避免基体干扰,本研究最终选择214 nm为检测波长,以实现10 种色素的同时测定。
2.2 分离缓冲体系的选择
10 种人工合成色素水溶性好,除赤藓红为见光易分解的含4 个苯环的羧酸钠盐外,其余9 种均为偶氮类磺酸盐,均能在碱性条件下以阴离子形式稳定存在。故本实验选用紫外吸收低的硼酸盐作为分离缓冲体系。
2.3 分离缓冲溶液浓度的选择
分离缓冲溶液的浓度对溶液的黏度、分析物的扩散系数和ζ电位均有影响,可降低电渗流而导致迁移时间和分离度的增加。保持50 mmol/L CsOH、40 mmol/L HP-β-CD和20 g/L PEG 35 000不变,考察了10、20、30 mmol/L及40 mmol/L Na2B4O7对10 种色素分离的影响(图1),随着Na2B4O7浓度的增加,各峰分离时间逐渐延长,分离度逐渐增大,当浓度增至30 mmol/L时,各峰间的分离度已足够大,继续增加盐浓度导致过多焦耳热,反而导致峰展宽。综合考虑峰形与分离度,30 mmol/L硼砂为最佳。

图1 硼砂浓度对10 种人工合成色素标准分离的影响Fig.1 Effect of Na2B4O7concentration on the separation of ten standards of synthetic colorants
2.4 分离缓冲溶液pH值的选择
分离缓冲溶液pH值影响电渗流及待分析物所带电荷,从而影响分析物的迁移时间和分离效率。硼酸pKa=9.24,故硼酸盐缓冲范围为8.24~10.24。保持分离缓冲液中其余组分的种类及浓度不变,考察了硼酸盐缓冲范围内,pH值分别为9.76、9.83、10.00及10.09(相应CsOH浓度分别为30、40、50、60 mmol/L)时对色素分离的影响。随着pH值增加,各色素峰的迁移时间延长,分离度也相应增加。但pH值增加使电渗流增加,分离缓冲液离子强度也增加,焦耳热增多,反而导致峰展宽、灵敏度下降,最终确定最佳pH值为10.00,相应CsOH溶液浓度为5 0 mmol/L,此时10 种色素峰形好,如图2所示。
分别用1 mol/L LiOH、NaOH、KOH及CsOH调节分离缓冲溶液的pH值至10.00,考察对各色素分离及峰形的影响。用LiOH溶液调pH值时,各色素峰间分离远未达基线,随着Li+、Na+、K+及Cs+电导增加,相应离子强度也增加,各色素峰间的分离度越来越大,灵敏度越来越高,与文献[33]结果相吻合,故本实验继续采用1 mol/L CsOH溶液调节分离缓冲液pH值。
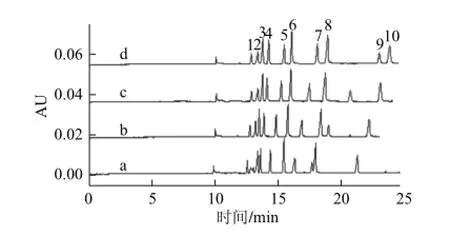
图2 氢氧化铯浓度对10 种人工合成色素标准分离的影响Fig.2 Effect of CsOH concentration on the separation of ten standards of synthetic colorants
2.5 分离缓冲溶液中HP-β-CD浓度的选择
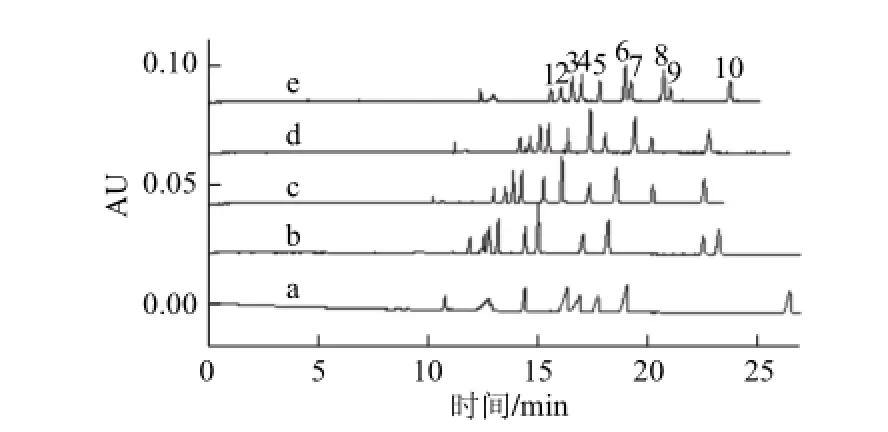
图3 HP-β-CD浓度对10 种色素标准分离的影响Fig.3 Effect of HP-β-CD concentration on the separation of ten standards of synthetic colorants
色素着色能力强,故首要解决的问题是在管壁吸附,因为吸附能导致色素峰形差,表现为前伸或拖尾峰、灵敏度低,严重时不出峰,更谈不上定量的重复性。首先选用HP-β-CD来抑制色素吸附。保持30 mmol/L Na2B4O7、50 mmol/L CsOH(pH 10.00)和20 g/L PEG 35 000不变,分别考察了0、20、40、60、80 mmol/L HP-β-CD对10 种色素分离的影响,未添加HP-β-CD时,各色素间未完全分离,峰形差,为前伸峰,新红被毛细管壁完全吸附,未见其峰出现如图3a所示,显示了其较强着色能力,单一添加剂PEG 35 000不足以抑制其在管壁的吸附。当加入20 mmol/L HP-β-CD时,新红的峰出现。随着HP-β-CD浓度的增加,亮蓝和诱惑红的吸附程度降低最为明显,峰形越来越好,大部分峰的分离得到改善,但迁移时间越来越长,亮蓝与日落黄间的分离越来越差,考虑到分离度及分离时间,最终确定HP-β-CD的最佳浓度为40 mmol/L。
2.6 分离缓冲溶液中PEG 35 000质量浓度的选择
保持分离缓冲液中30 mmol/L Na2B4O7、50 mmol/L CsOH(pH 10.00)和40 mmol/L HP-β-CD的浓度不变,考察了PEG 35 000质量浓度分别为0、20 g/L及40 g/L时对色素分离及峰形的影响。当分离缓冲液中不含PEG 35 000时,亮蓝与诱惑红;柠檬黄与胭脂红的峰并在了一起,随着PEG 35 000质量浓度的增加,亮蓝、诱惑红、柠檬黄及胭脂红的峰形逐渐变锐,峰形变好,但当质量浓度达到40 g/L时,亮蓝与新红的峰展宽,灵敏度明显降低,如图4所示。PEG 35 000最佳质量浓度为20 g/L。

图4 PEG 35 000质量浓度对10 种色素标准分离的影响Fig.4 Effect of PEG 35 000 concentration on the separation of ten standards of synthetic colorants
2.7 管径及管长的选择
选用50 μm内径毛细管进行分离,尽管分离效果好,但因灵敏度低而检测不到大部分样品中的色素,只好换用内径75 μm毛细管,灵敏度显著增加。
为避免因内径增加而导致分离柱效下降,将内径50 μm时所用毛细管有效长度50 cm增至60 cm,这样做的好处是在尽量不降低柱效的同时,还可以增加进样量,从而进一步增加检测灵敏度。
2.8 工作曲线、线性范围、检出限、定量限及精密度
在上述最佳电泳条件下,将10 种色素的标准储备液用样品提取液逐级稀释(苋菜红及胭脂红的工作液质量浓度分别为1、2、5、10、20 mg/L及40 mg/L;偶氮宝石红及新红的工作液质量浓度分别为1.5、3、6、15、30 mg/L及60 mg/L;赤藓红、诱惑红、日落黄及酸性红2G的工作液质量浓度分别为2、4、10、20、40 mg/L及80 mg/L;亮蓝及柠檬黄的工作液质量浓度分别为3、6、15、30、60 mg/L及120 mg/L,依次注入电泳仪。校正峰面积(A)与相应色素质量浓度呈良好线性关系。线性回归方程、相关系数、线性范围、检出限及定量限见表1。为简便起见,在线性范围内以校正峰面积单点定量。

表1 线性回归方程、线性范围、相关系数、检出限及定量限Table 1 Linear regression equations, linear ranges, correlation coefficients, limits of detection and limits of quantitation
2.9 仪器精密度
在最佳电泳条件下,将低、中及高3 个质量浓度的10 种人工合成色素的混合标准溶液,分别连续进样7次,得到仪器精密度。低、中及高3 个质量浓度迁移时间的相对标准偏差(relative standard deviation,RSD)(n=7)分别在0.50%~1.15%、0.14%~1.10%、0.24%~0.91%之间。低、中及高3 个质量浓度校正峰面积的RSD(n=7)分别在1.59%~3.61%、1.45%~2.66%、0.44%~2.70%之间。
2.10 回收率实验
以不含色素的白色糖豆为空白样品,分别在低、中及高3 个质量浓度进行加标回收实验。结果列于表2。标准、样品及样品加标电泳图如图5所示。

图5 10 种人工合成色素标准、糖豆样品及样品加标电泳图Fig.5 Electrophoregrams of t en standards of synthetic colorants

表2 加标回收率测定结果(n=5)Table 2 Average recoveries of ten synthetic food colorants in candies spiked at various levels (n=5)
2.11 样品分析
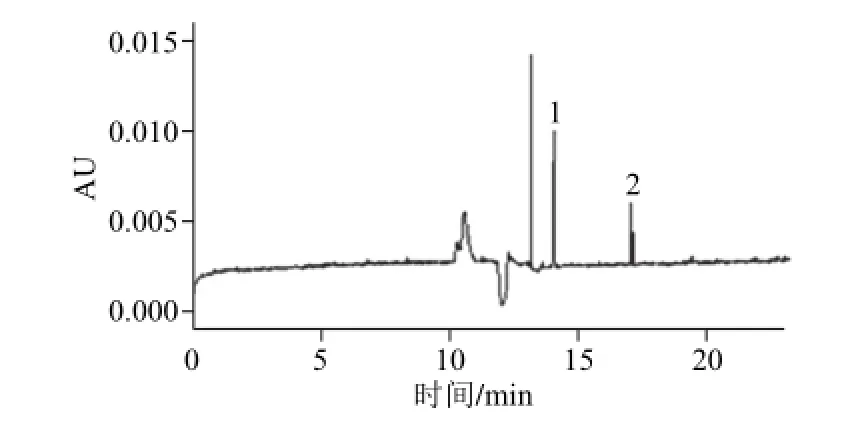
图6 糖豆样品2#电泳图Fig.6 Electrophoregram of candy sample
按1.3.3节实验方法对糖豆及调制酒样品进行了测定,糖豆样品测定结果及电泳图分别见表3及图6。所测调制酒样品中色素含量在0.42~31.36 mg/kg,相应RSD在0.1%~4.7%之间。为进一步验证该方法的准确度,还测定了英国弗帕斯实验室食品分析水平评估计划(food analysis performance assessment scheme,FAPAS)能力验证样品,日落黄和偶氮宝石红获得满意结果,并与上报结果的HPLC法进行了方法比对,见表4。

表3 糖豆样品测定结果(n=3)Table 3 Contents of synthetic food colorants in real candy samples (n=3)

表4 CE与HPLC测定FAPAS能力验证样品结果Table 4 Comparison of analytical results between CE and HPLC for the FAPAS proficiency test sample
3 结 论
人工合成色素因其较强的着色能力,易吸附在石英毛细管壁,导致色素峰形不好。然而HP-β-CD与PEG 35 000的协同作用,可成功地抑制色素吸附,对改善峰形、色素间分离及提高加标回收率起着不可或缺的作用。利用CsOH溶液调节分离缓冲液pH值可进一步改善色素峰形。食品中人工合成色素较少的使用量即可达到理想的着色效果,采用内径75 μm×70 cm(有效长度:60 cm)未涂敷石英毛细管可满足检测灵敏度的需求。
[1] 刘艳琴, 王浩, 杨红梅, 等. 固相萃取-HPLC法同时测定糕点中8 种人工合成色素[J]. 食品研究与开发, 2010, 31(2): 139-142.
[2] 刘艳琴, 王浩, 杨红梅, 等. 固相萃取-高效液相色谱法同时测定食品中9 种人工合成色素[J]. 粮油加工, 2010(12): 168-171.
[3] MEDEIROS R A, LOURENCAO B C, ROCHA-FILHO R C, et al. Flow injection simultaneous determination of synthetic colorants in food using multiple pulse amperometric detection with a boron-doped diamond electrode[J]. Talanta, 2012, 99: 883-889.
[4] MEDEIROS R A, LOURENCAO B C, ROCHA-FILHO R C, et al. Simultaneous voltammetric determination of synthetic colorants in food using a cathodically pretreated boron-doped diamond electrode[J]. Talanta, 2012, 97: 291-297.
[5] POURREZA N, RASTEGARZADEH S, LARKI A. Determination of Allura red in food samples after cloud point extraction using mixed micelles[J]. Food Chemistry, 2011, 126(3): 1465-1469.
[6] SIVAKUMAR V, VIJAEESWARRI J, ANNA J L. Effective natural dye extraction from different plant materials using ultrasound[J]. Industrial Crops and Products, 2011, 33(1): 116-122.
[7] GHOREISHI S M, BEHPOUR M, GOLESTANEH M. Simultaneous determination of Sunset yellow and Tartrazine in soft drinks using gold nanoparticles carbon paste electrode[J]. Food Chemistry, 2012, 132(1): 637-641.
[8] ZOU T, HE P, yASEN A, et al. Determination of seven synthetic dyes in animal feeds and meat by high performance liquid chromatography with diode array and tandem mass detectors[J]. Food Chemistry, 2013, 138(2/3): 1742-1748.
[9] YANG Yi, YIN Jie, SHAO Bing. Simultaneous determination of five aluminum lake dyes in chewing gum by HPLC with photodiode array detection[J]. Food Additives and Contaminants, 2011, 28(9): 1159-1167.
[10] 卫生部. GB 2760—2011 食品添加剂使用标准[S]. 北京: 中国标准出版社, 2011.
[11] de ANDRADEF I, GUEDES M I F, VIEIRA Í G P, et al. Determination of synthetic food dyes in commercial soft drinks by TLC and ion-pair HPLC[J]. Food Chemistry, 2014, 157: 193-198.
[12] KUCHARSKA M, GRABKA J. A review of chromatographic methods for determination of synthetic food dyes[J]. Talanta, 2010, 80(3): 1045-1051.
[13] 沈坚, 潘旭, 王全林, 等. 鱼子酱中的合成色素反相高效液相色谱法同时测定[J]. 分析测试学报, 2010, 29(6): 584-588.
[14] CULZONI M J, SCHENONE A V, LLAMAS N E, et al. Fast chromatographic method for the determination of dyes in beverages by using high performance liquid chromatography-diode array detection data and second order algorithms[J]. Journal of Chromatography A, 2009, 1216(42): 7063-7070.
[15] ALVES S P, BRUM D M, BRANCO de ANDRADE É C, et al. Determination of synthetic dyes in selected foodstuffs by high performance liquid chromatography with UV-DAD detection[J]. Food Chemistry, 2008, 107(1): 489-496.
[16] yOSHIOKA N, ICHIHASHI K. Determination of 40 synthetic food colors in drinks and candies by high-performance liquid chromatography using a short column with photodiode array detection[J]. Talanta, 2008, 74(5): 1408-1413.
[17] MINIOTI K S, SAKELLARIOU C F, THOMAIDIS N S. Determination of 13 synthetic food colorants in water-soluble foods by reversed-phase high-performance liquid chromatography coupled with diode-array detector[J]. Analytica Chimica Acta, 2007, 583(1): 103-110.
[18] 赵飞, 高广慧, 那海秋, 等. 固相萃取-高效液相色谱-可变波长检测法同时测定调味品中甜味剂和人工合成色素[J]. 色谱, 2013, 31(5): 490-493.
[19] 鄢兵, 胡俊, 张云伟, 等. 超高效液相色谱法快速测定膨化食品中7种人工合成色素[J]. 中国卫生检验杂志, 2014, 24(2): 194-197.
[20] 陈欣欣, 谢娅黎, 肖汉, 等. 超高效液相色谱快速检测葡萄酒中5 种合成着色剂[J]. 现代食品科技, 2009, 25(9): 1099-1100.
[21] 吕东明, 丁云连, 詹晟, 等. 超高效液相色谱/四极杆-飞行时间质谱法检测22 种禁用和限用合成色素[J]. 现代仪器与医疗, 2013, 19(2): 52-56.
[22] SEBASTIANO R, CONTIELLO N, SENATORE S, et al. Analysis of commercial acid black 194 and related dyes by micellar electrokinetic chromatography[J]. Dyes and Pigments, 2012, 94(2): 258-265.
[23] 闫正, 李盈辰, 张玉. 改良聚酰胺吸附-高效毛细管电泳内标法测定饮料中的亮蓝和苋菜红[J]. 色谱, 2010, 28(12): 1185-1188.
[24] 赵新颖, 贾丽, 周晓晶, 等. 毛细管电泳法同时测定糖果中5 种人工合成色素的含量[J]. 现代仪器, 2008, 14(4): 58-60.
[25] CESLA P, FISCHER J, TESAROVA E, et al. Effects of capillary coating and beta-cyclodextrin additive to the background electrolyte on separation of sulphonated azodyes by capillary zone electrophoresis[J]. Journal of Chromatography A, 2007, 1149(2): 358-367.
[26] RYVOLOVA M, TABORSKY P, VRABEL P, et al. Sensitive determination of erythrosine and other red food colorants using capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Chromatography A, 2007, 1141(2): 206-211.
[27] DOSSI N, TONIOLO R, PIZZARIELLO A, et al. A capillary electrophoresis microsystem for the rapid in-channel amperometric detection of synthetic dyes in food[J]. Journal of Electroanalytical Chemistry, 2007, 601(1/2): 1-7.
[28] MARCELO A, PRADO A L F V B. Validation of methodology for simultaneous determination of synthetic dyes in alcoholic beverages by capillary electrophoresis[J]. Journal of Chromatography A, 2006, 1136(2): 231-236.
[29] HUANG H Y, CHIU C W, SUE S L, et al. Analysis of food colorants by capillary electrophoresis with large-volume sample stacking[J]. Journal of Chromatography A, 2003, 995(1/2): 29-36.
[30] del GIOVINE L, PICCIOLIBOCCA A. Determination of synthetic dyes in ice-cream by capillary electrophoresis[J]. Food Control, 2003, 14(3): 131-135.
[31] HUANG H Y, SHIH Y C, CHEN Y C. Determining eight colorants in milk beverages by capillary electrophoresis[J]. Journal of Chromatography A, 2002, 959(1/2): 317-325.
[32] DING X J, LI Y, SONG B H, et al. Determination of 5’-mononucleotides in infant formulaby capillary electrophoresis with ultraviolet detection[J]. Dairy Science & Technology, 2011, 91: 759-770.
[33] 王茜, 丁晓静, 王心宇, 等. 毛细管电泳法快速测定保健食品中免疫球蛋白G[J]. 分析化学, 2006, 34(8): 1161-1164.
Simultaneous Determination of Ten Synthetic Food Colorants in Alcoholic Beverages and Candies by Capillary Electrophoresis
WANG Li-fang1,2, DING Xiao-jing1,2,*, XIE Na3, ZHAO Shan1, WANG Zhi3
(1. Beijing Key Laboratory of Diagnostic and Traceability Technologies for Food Poisoning, Beijing Center for Disease Control and Prevention, Beijing 100013, China; 2. College of Public Health, Capital Medical University, Beijing 100069, China; 3. College of Science, Agricultural University of Hebei, Baoding 071001, China)
A new method for the simultaneous determination of ten synthetic food colorants in alcoholic beverages and candies by capillary electrophoresis (CE) with photodiode array (PDA) detection was established. The separation was carried out using an uncoated capillary with 75 μm (i.d.) and total length of 70 cm (60 cm to the detector) within 25 min. The separation voltage was 18 kV. The detection wavelength was set at 214 nm. The key factors that affect the separation such as the concentration and pH of the running buffer, the concentration of additives we re investigated in detail. The alcoholic beverage was directly injected after filtration. The candy sample was first ground and then extracted with sample buffer. The extract was centrifuged and the supernatant could be directly injected. Good linear relationships between the corrected peak areas and mass concentrations of the ten synthetic food colorants were obtained in the range of 1.0-40.0, 1.5-60.0, 2.0-80.0, 3.0-120.0 mg/L, respectively, with correlation coefficients all above 0.999 6. The limits of detection (RSN=3) were 0.3-1.0 mg/L, and the limits of quantitation (RSN=10) were 1.0-3.0 mg/L, respectively. The average recoveries were between 92.1%-106.5% with relative standard derivations of 0.5%-4.4%. This method is simple and accurate. It can be applied to the routine analysis of 10 synthetic colorants in alcoholic beverages and candies.
synthetic colorants; candy; alcoholic beverages; capillary electrophoresis
O657
A
1002-6630(2014)14-0145-06
10.7506/spkx1002-6630-201414028
2014-03-26
北京市科技计划项目(Z111100056811006);北京市卫生系统高层次卫生技术人才培养项目
王丽芳(1986—),女,硕士研究生,研究方向为营养与食品卫生学。E-mail:yunquan0919@163.com
*通信作者:丁晓静(1968—),女,主任技师,博士,研究方向为食品卫生理化检验。E-mail:dxj_wry@yahoo.com

