单硝酸异山梨酯缓释片的制备及稳定性研究
颜携国,陶安进
(1.山东大学药学院,山东济南250012;2.深圳翰宇药业股份有限公司,广东深圳518057)
单硝酸异山梨酯缓释片的制备及稳定性研究
颜携国1,2,陶安进2
(1.山东大学药学院,山东济南250012;2.深圳翰宇药业股份有限公司,广东深圳518057)
目的制备单硝酸异山梨酯缓释片,并对其进行稳定性研究。方法以羟丙甲纤维素为骨架材料,与参比制剂(Imdur,阿斯利康)进行体外释放度比较,采用均匀设计法优化单硝酸异山梨酯缓释片处方,并考察缓释片在(40±2)℃、相对湿度75%±5%条件下的稳定性。结果经f2(相似因子)判断单硝酸异山梨酯缓释片释放曲线,与参比制剂相似。在(40±2)℃、相对湿度75%±5%条件下6个月的稳定性良好。结论单硝酸异山梨酯缓释片制备工艺简单易行,质量可控,符合大规模生产要求。
单硝酸异山梨酯;缓释片;稳定性
单硝酸异山梨酯(5-isosorbidemononitrate,5-ISMN)是新一代硝酸酯类抗心绞痛药物,也是硝酸异山梨酯的体内主要活性代谢产物[1]。口服单硝酸异山梨酯可使容量血管扩张,回心血流量减少,从而使心脏前负荷减少,达到保护心肌的目的,临床广泛用于防止心绞痛、充血性心力衰竭、缺血性心脏病等疾病的治疗[2,3]。设计合理的制剂处方是保证产品质量的前提,通过实验找出合理的处方有着重要的意义。因此,课题组采用均匀设计法,以羟丙甲纤维素(HPMC)为骨架材料制备单硝酸异山梨酯缓释片,与原研厂制剂阿斯利康制药公司的依姆多(Imdur)进行体外释放曲线对比,并考察自研制剂的稳定性。
1 材料与仪器
1.1 药品与试剂 单硝酸异山梨酯原料(山东科源制药有限公司);单硝酸异山梨酯对照品(中国食品药品检定研究院,批号:100694-200401);羟丙甲纤维素(HPMC K4M,美国陶氏化学公司);硬脂酸(湖州展望药业有限公司);乳糖(德国美剂乐集团);微粉硅胶(赢创工业集团);硬脂酸镁(湖州展望药业有限公司);乙醇(安徽安特食品有限公司);欧巴代(上海卡乐康包衣技术有限公司)。
1.2 实验仪器 高效液相色谱仪(美国Waters公司);全自动智能药物溶出仪(瑞士Sotax公司);C&C800旋转式压片机(北京创博佳维科技有限公司);LabcoatingⅠ高效包衣锅(深圳信宜特科技有限公司)。
2 方法和结果
2.1 分析方法的建立和考察
2.1.1 色谱条件 甲醇-水(25∶75)为流动相,十八烷基键合硅胶柱为色谱柱;检测波长为210 nm。色谱柱的理论塔板数以单硝酸异山梨酯峰计算应不低于3 000。单硝酸异山梨酯峰与2-单硝酸异山梨酯峰的分离度应符合要求,与硝酸异山梨酯峰的分离度应不小于6.0。
2.1.2 标准曲线的绘制 精密称取单硝酸异山梨酯对照品25 mg,用水溶解并定容至25.0 mL,分别量取此溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL置25 mL量瓶中,加水稀释至刻度,摇匀,照“2.1.1”项下色谱条件,分别取20μL注入液相色谱仪,记录色谱图。以峰面积A对浓度C(μg·mL-1)作曲线,按最小二乘法计算回归方程及相关系数,得回归方程A=15 810C+1 380,r=0.999 9。线性试验结果表明单硝酸异山梨酯浓度在20.53~143.70μg·mL-1范围内与其峰面积呈良好线性关系。
2.1.3 回收率 分别精密称取单硝酸异山梨酯对照品20、25、30 mg,置250 mL量瓶中,按比例加入处方量的辅料,加水适量并超声15 min使单硝酸异山梨酯溶解并稀释至刻度,摇匀,滤过,作为供试品溶液。另精密称取单硝酸异山梨酯对照品25 mg,不加辅料,同法操作,制备对照品溶液。分别精密量取上述两种溶液各20μL,按上述色谱条件测定峰面积,计算结果显示,上述3个浓度供试品溶液平均回收率分别为99.1%、100.5%、99.9%,RSD分别为0.31%、0.70%、0.51%,回收率结果符合规定。
2.1.4 精密度 取一份浓度为0.1 mg·mL-1的供试品溶液,分别进样6次,测得峰面积RSD为0.067%。试验结果表明,精密度符合要求。
2.1.5 专属性 按本品处方制备缺单硝酸异山梨酯的空白辅料,取适量,以水制成溶液,滤过,作为空白辅料溶液,照含量测定项下色谱条件,取20μL注入液相色谱仪,记录色谱图。试验证明,辅料不干扰测定,见图1。
2.1.6 含量测定 取本品20片,精密称定,研细,精密称取适量(约相当于单硝酸异山梨酯25 mg),置250 mL量瓶中,加流动相适量,超声15 min使单硝酸异山梨酯溶解,用水稀释至刻度,摇匀,滤过,作为供试品溶液;另取单硝酸异山梨酯对照品,同法测定。按外标法以峰面积计算,即得。
图1 空白辅料溶液
2.2 体外释放度测定 根据已有国家标准,采用释放度测定法《中国药典》2010年版(二部)附录ⅩD第一法[4],以水500 mL为溶剂,转速为50 rpm,依法操作,经1、4、8 h,取溶液5 mL,滤过,并即时在操作容器中补充水5 mL,照“2.1.1”项下色谱条件,分别取续滤液20μL注入液相色谱仪,记录色谱图;另精密称取经减压干燥至恒重的单硝酸异山梨酯对照品适量,加水溶解并定量稀释制成每1mL中约含单硝酸异山梨酯120μg的溶液,作为对照品溶液,同法测定。按外标法以峰面积计算出每片在不同时间点的释放量。
2.3 处方优化 称取过80目的单硝酸异山梨酯、HPMC-K4M、乳糖和硬脂酸,充分混匀;加入适量的75%乙醇制成软材,过20目筛制得湿颗粒;将湿颗粒在45℃的恒温箱里烘至水分≤2%;干颗粒以20目筛整粒,加入微粉硅胶和硬脂酸镁,混合均匀;取样检测,确定片重范围,压片,包衣。
单硝酸异山梨酯易溶于水,单纯使用HPMCK4M作为骨架很难有效控制药物释放,因此加入阻滞剂硬脂酸,以减少HPMC-K4M的用量,同时加入适量乳糖作为稀释剂,使物料更易于制粒和压片。以HPMC-K4M为骨架材料,硬脂酸为阻滞剂,乳糖为稀释剂,按照下列均匀设计方案进行实验[5~7],考察HPMC-K4M、硬脂酸和乳糖的合适用量。
设计每片含主药60 mg,微粉硅胶约1%,硬脂酸镁约1%,其他3种辅料考察范围如表1。

表1 骨架材料用量考察范围
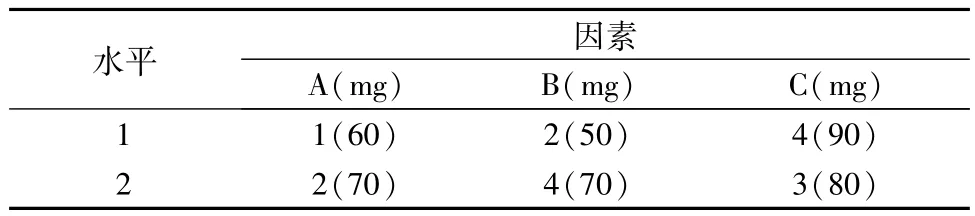
表2 骨架材料用量选择均匀设计因素水平表U5(54)
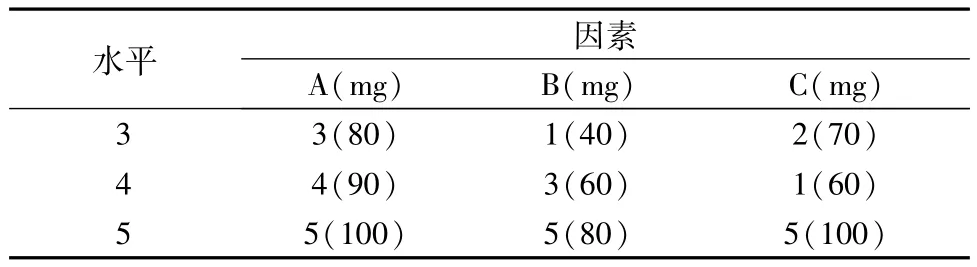
续表2:
将考察因素的范围分为5水平,选择U5(54)表,根据其使用表的规定,选取其中的1,2,4列组成U5(52)表。把A,B,C 3因素分别放在U5(52)表的3列上面,将对应的各因素的各水平填入表内,得到实验方案如表2。
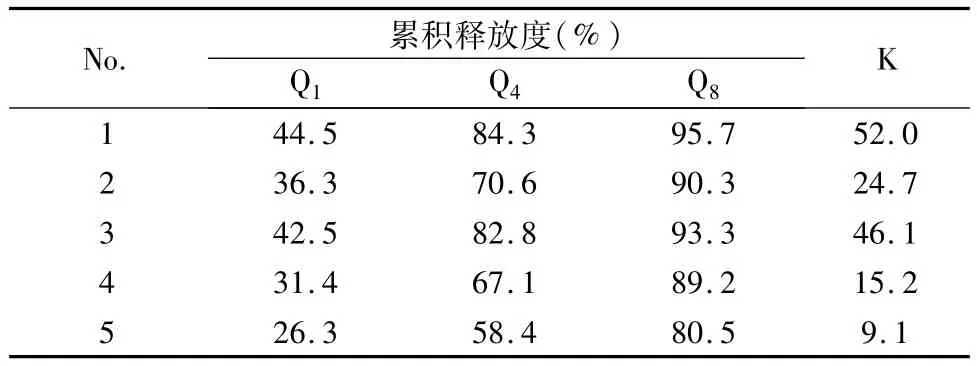
表3 均匀设计实验各方案药物累积溶出释放度
用SPSS统计分析软件进行处理[8,9],得到回归方程:K=56.880 8+0.001 1×(A)2-0.0133×A× B+0.004 8×A×C;
s=0.978 8,r=0.999 8,F=495.6,n=5。结果,通过F检验(0.05),得到优化处方为:A=100 mg,B=80 mg,C=60 mg。
2.4 优化处方验证 照优化的处方制备单硝酸异山梨酯缓释片,测定体外释放度,并与参比制剂比较,结果见表3。按照相似因子法f2(f2=50×lg[1+1/n∑(Rt-Tt)2]-1/2×100,Rt和Tt分别为参比制剂和自制样品在t时间内的累积释放度)判断自制缓释片与参比制剂体外释放行为的相似程度,见表4。
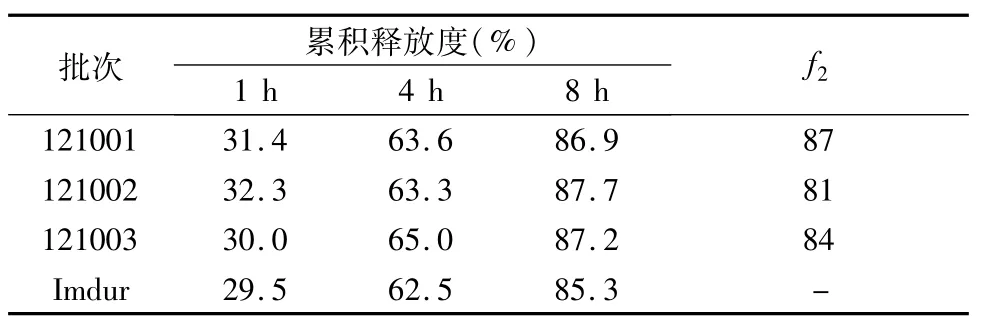
表4 单硝酸异山梨酯缓释片释放度测定结果
2.5 稳定性考察结果 按照《中国药典》2010年版(二部)附录ⅪⅩC中的原料药与药物制剂稳定性指导原则[2],对优化后处方进行稳定性考察:将自制单硝酸异山梨酯缓释片置温度(40±2)℃、相对湿度75%±5%条件下放置,分别于第1、2、3和第6月末取样,考察片剂的外观性状、含量、有关物质及释放度,见表5。
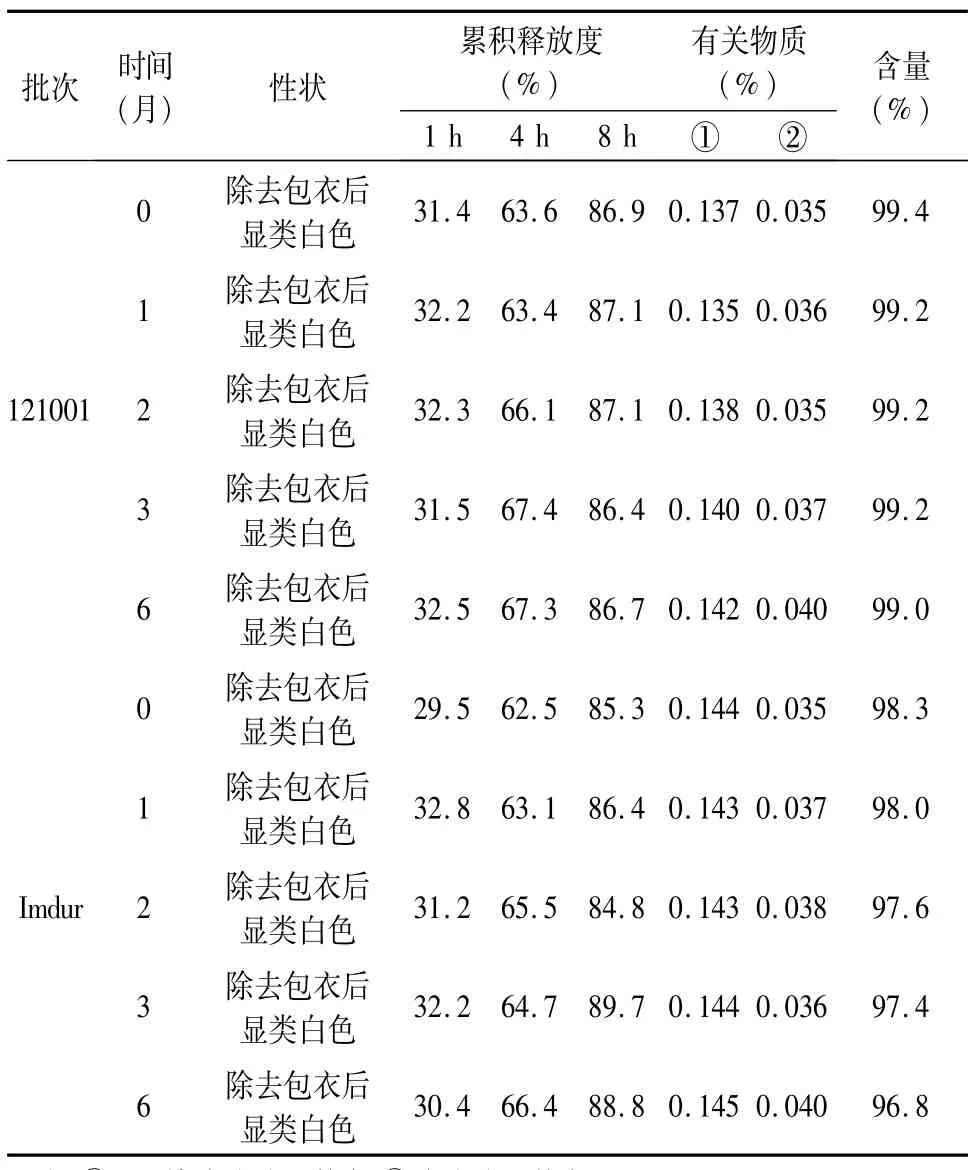
表5 单硝酸异山梨酯缓释片稳定性(加速试验)结果
3 结论
3.1 均匀设计法是我国自行开发的一套科学的试验方法,在各科学领域发挥了重要作用。经过工艺优化最终确定了单硝酸异山梨酯缓释片的最佳制备工艺:以HPMC为骨架材料,硬脂酸为阻滞剂,乳糖为稀释剂,采用湿法制粒工艺。该制备工艺简单易行,易于过程控制,符合大规模生产要求。
3.2 单硝酸异山梨酯容易吸潮,而且味苦,进行薄膜包衣,这样既可以掩盖药物不良气味,提高患者服药依从性,同时对于缓释片的稳定性起到提高作用[10]。
3.3 通过加速稳定性6个月考察,以外观、体外释放度、有关物质和含量作为指标,评价本课题组制备的单硝酸异山梨酯缓释片,结果显示自研制剂与原研厂制剂(阿斯利康制药公司的Imdur,60 mg规格)质量相当甚至更优。
[1]朱于村.5-单硝酸异山梨酯控释片剂用于临床的重要性[J].中国药学杂志,1995,30(12):709-711.
[2]孙学惠,郭涛,宋洪涛,等.单硝酸异山梨酯定时脉冲控释片的研究[J].解放军药学学报,2005,21(4):258-261.
[3]Prakash A,Markham A.Long-acting isosorbidemononitrate[J].Drugs,1999,57(1):93-99.
[4]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010.
[5]方开泰.均匀设计与均匀设计表[M].北京:科学出版社,1994.
[6]曾昭钧.均匀设计及其应用[M].北京:中国医药科技出版社,2005.
[7]孙方,杜坡.格列齐特凝胶骨架缓释片的研制[J].广东药学院学报,2007,23(6):618-621.
[8]徐向宏,何明珠.试验设计与Design-Expert、SPSS应用[M].北京:科学出版社,2010.
[9]华南,刘卫,郭瑞臣.均匀设计优选芎归巴布剂基质配比[J].中国医院药学杂志,2009,29(18):1537-1539.
[10]郭毅,张为军,张秋菊.单硝酸异山梨酯口崩片的制备及质量评价[J].齐鲁药事,2011,30(5):260-261.
Study on the preparation and stability of Isosorbide M ononitrate Sustained-release Tablets
YAN Xie-guo1,2,TAO An-jin2
(1.School of Pharmaceutical Sciences,Shandong University,Jinan 250012,China;2.Hybio Pharmaceutical Co.,Ltd.,Shenzhen 518057,China)
ObjectiveTo prepare Isosorbide Mononitrate Sustained-release Tablets,and to investigate the stability of the tablets.M ethodsThe formulation of sustained-release tablets of isosorbidemononitrate was optimized by uniform design,and hydroxypropylmethycellulose(HPMC)as matrix material.The release profile was compared with that of Imdur.The stability of tabletswas studied under conditions of(40±2)℃and relative humidity 75%±5%exposure.ResultsThe samples had the similar sustained-release property with that of Imdur.The tablets were stable to the temperature and relative humidity conditions of(40±2)℃and 75%±5%for 6 months.ConclusionPreparation process of Isosorbide Mononitrate Sustained-release Tablets was simple and the quality can be controlled,which met the requirement for large scale production.
Isosorbidemononitrate;Sustained-release tablets;Stability
R944.9
A
2095-5375(2014)11-0651-004
颜携国,男,研究方向:药物新剂型,E-mail:yanxieguo34@126.com

