猪瘟活疫苗与口蹄疫灭活疫苗同期与分期免疫效果对比试验
王克才,何利昆,谷志大,段亚良,杨国丽,郑洪玲,肖爱波
(1.辽宁省动物疫病预防控制中心,辽宁 沈阳 110164;2.辽宁省畜产品安全监察所,辽宁 沈阳 110003)
猪瘟活疫苗与口蹄疫灭活疫苗同期与分期免疫效果对比试验
王克才1,何利昆1,谷志大1,段亚良1,杨国丽1,郑洪玲1,肖爱波2
(1.辽宁省动物疫病预防控制中心,辽宁 沈阳 110164;2.辽宁省畜产品安全监察所,辽宁 沈阳 110003)
本试验采用单因子试验设计方法,将2窝同期出生的18头仔猪,随机分为试验组和对照组。试验组8头仔猪分别于35、65日龄进行2轮次猪瘟活疫苗和口蹄疫灭活疫苗同期免疫;对照组10头仔猪分别于25、35、55、65日龄进行相同疫苗的分期免疫。通过所有供试猪免疫后进行临床跟踪观察,并于免疫前的23日龄、免疫后的55、95日龄分别检测免疫抗体水平(应用国家规定的ELISA检测方法)。试验结果表明,两种免疫方法免疫后7 d内均未观察明显的应激反应,试验组与对照组两种疫苗的免疫抗体合格率差异均不显著。
猪瘟;口蹄疫;疫苗;同期免疫;分期免疫;效果
为探究猪瘟活疫苗与口蹄疫灭活疫苗同期免疫方法的安全性和有效性,本研究开展了两种疫苗同期与分期免疫效果对比试验。
1 材料与方法
1.1 试验材料
1.1.1 试验猪 在辽阳市某养猪合作社随机选择临床健康且处于同期、正常分娩的两窝18头仔猪作为供试猪,18日龄去势,25日龄断奶,饲养管理与场内正常管理措施保持一致。所有试验猪皆为临床健康猪。
1.1.2 试验用疫苗 口蹄疫O型灭活疫苗,中牧实业股份有限公司生物药品厂生产,批号:1212005;猪瘟活疫苗(传代细胞苗),广东永顺生物药品厂生产,批号:2012095。
1.1.3 检测试剂 猪瘟抗体检测试剂盒,美国IDEXX公司生产,批号:99-43220-A291A441;口蹄疫O型抗体检测试剂盒,购自中国农业科学院兰州兽医研究所,批号:2013050901。
1.2 试验方法
1.2.1 试验猪分组 将2窝18头仔猪不分公母随机分为试验组(同期免疫组,包括第1窝5头猪、第2窝3头猪)和对照组(分期免疫组,包括第1窝5头猪、第2窝5头猪),并通过逐头标记试验号和耳标号。具体分组见表1。

表1 试验猪分组明细表Table1 Subgroup specification o f test pig
1.2.2 试验猪采样检测及免疫方法 第1次采血:试验组和对照组同在23日龄(首免前2 d)时采血,检测母源抗体;第1轮同期免疫:试验组8头仔猪于35日龄时在左右侧颈部同时分别注射口蹄疫和猪瘟疫苗;第1轮分期免疫:对照组10头仔猪于25日龄时,在颈部肌肉注射猪瘟疫苗,于35日龄时在颈部肌肉注射口蹄疫疫苗。
第2次采血:2组猪于完成首轮免疫后30 d(65日龄)同步进行;第2轮同期免疫:试验组8头仔猪于65日龄时在左右侧颈部同时分别注射口蹄疫和猪瘟疫苗;第2轮分期免疫:对照组10头仔猪于55日龄时,在颈部肌肉注射猪瘟疫苗,于65日龄时在颈部肌肉注射口蹄疫疫苗。
第3次采血:2组猪于加强免疫后30 d(约95日龄)同步进行;将上述所采全血分离血清,送实验室进行口蹄疫和猪瘟免疫抗体检测。
所用疫苗的免疫剂量按照说明书的规定,即猪瘟疫苗首免和二免均为1头份/头,口蹄疫疫苗首免为1 mL/头、二免为2 mL/头。有关免疫及采血程序详见表2。
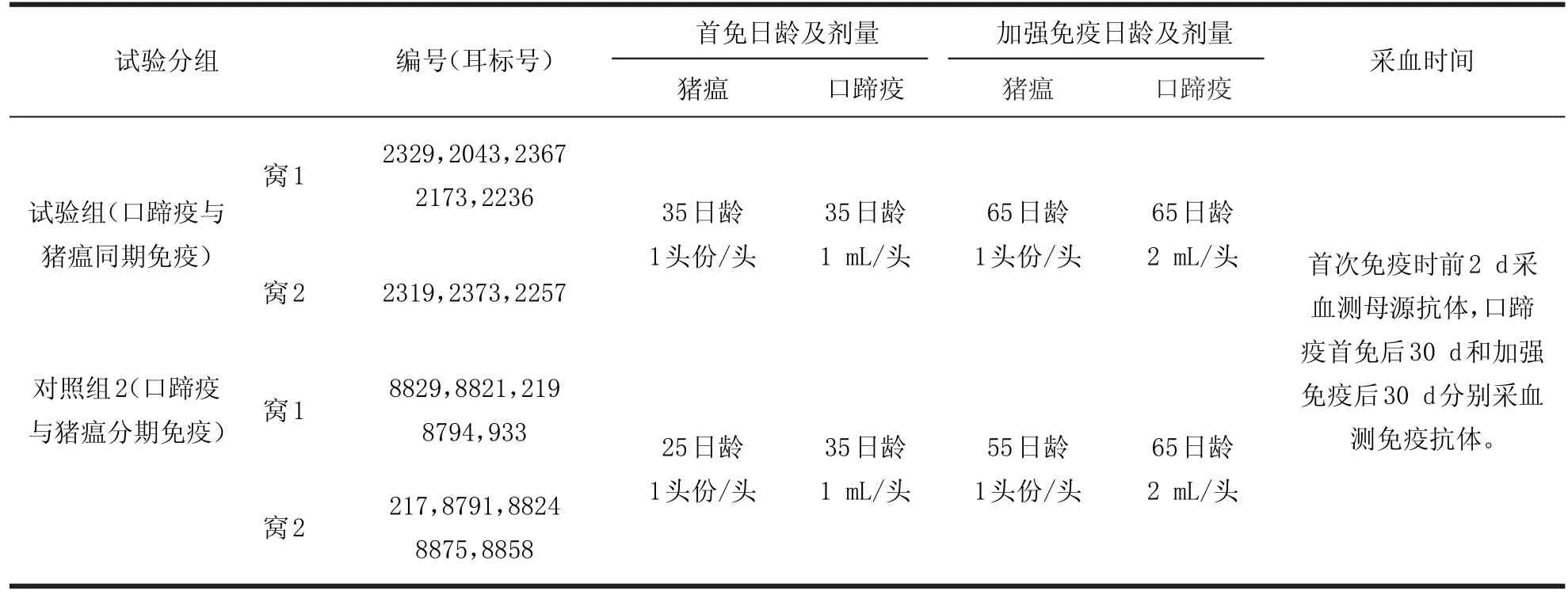
表2 试验猪免疫程序表Table2 Imm une p rogramm e for child ren of test pig
1.2.3 试验现场饲养管理及临床观察要求 试验场地位于辽阳市文圣区桃花岛村,场区相对独立,附近无其他养猪场户。圈舍饲养条件均一致,2个试验组猪混群饲养,饲喂相同饲料。整个试验场地封闭管理,固定饲养人员,严格消毒,杜绝无关人员出入。
免疫前后对试验猪进行临床观察精神状态、采食状况及生长发育是否发生明显变化,尤其注意观察免疫后是否发生疫苗过敏反应。
1.2.4 数据处理与分析 对2个试验组定期临床观察、免疫及采样,记录相关情况。将检测结果进行收集汇总和对比分析。
2 试验结果及分析
2.1 试验安全性观察结果①试验期间该场存栏数100头,其中种猪40头,临床观察猪群未发生疫情,所有试验猪精神状态良好,采食正常,试验开始时(25日龄)2组仔猪平均体重为6.5±0.5 kg,试验结束时(95日龄)2组仔猪平均体重为40±1.5 kg,2组试验猪生长发育正常,无明显差异。②每次免疫注射后观察3 d,均未发生速发型过敏反应及死亡情况。
2.2 试验猪免疫前母源抗体检测结果同期免疫组8头仔猪猪瘟抗体合格率为3/8,分期免疫组10头仔猪猪瘟抗体合格率为5/10;同期免疫组口蹄疫抗体合格率为3/8,分期免疫组口蹄疫抗体合格率为2/ 10。详见表3~5。
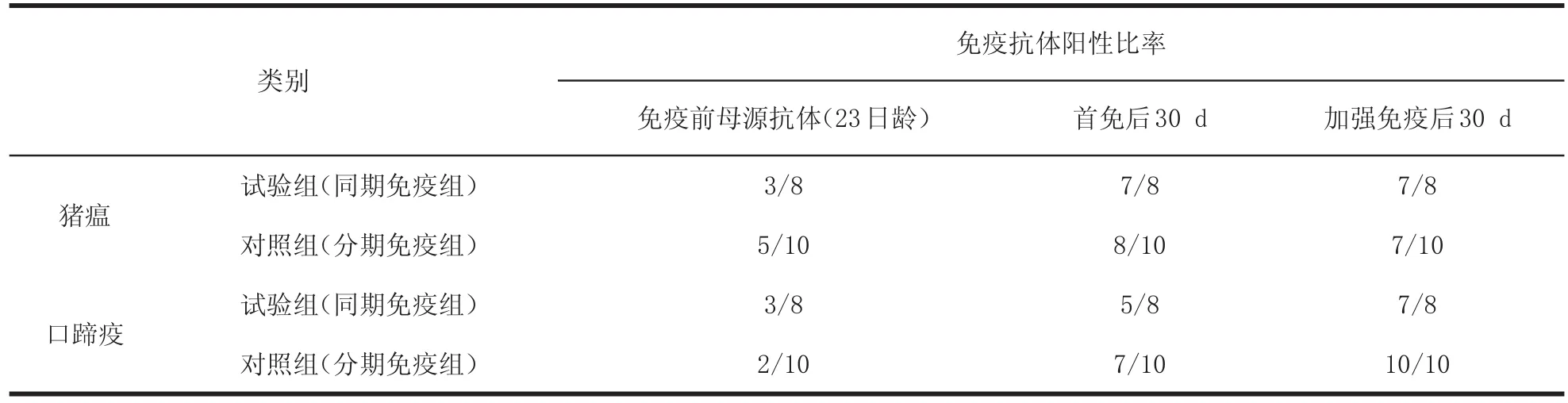
表3 不同时期检测猪瘟、口蹄疫抗体合格率统计表Tab le3 Qualification rate statistica l tab le at diverse period of sw ine pest and foot-and-m outh disease
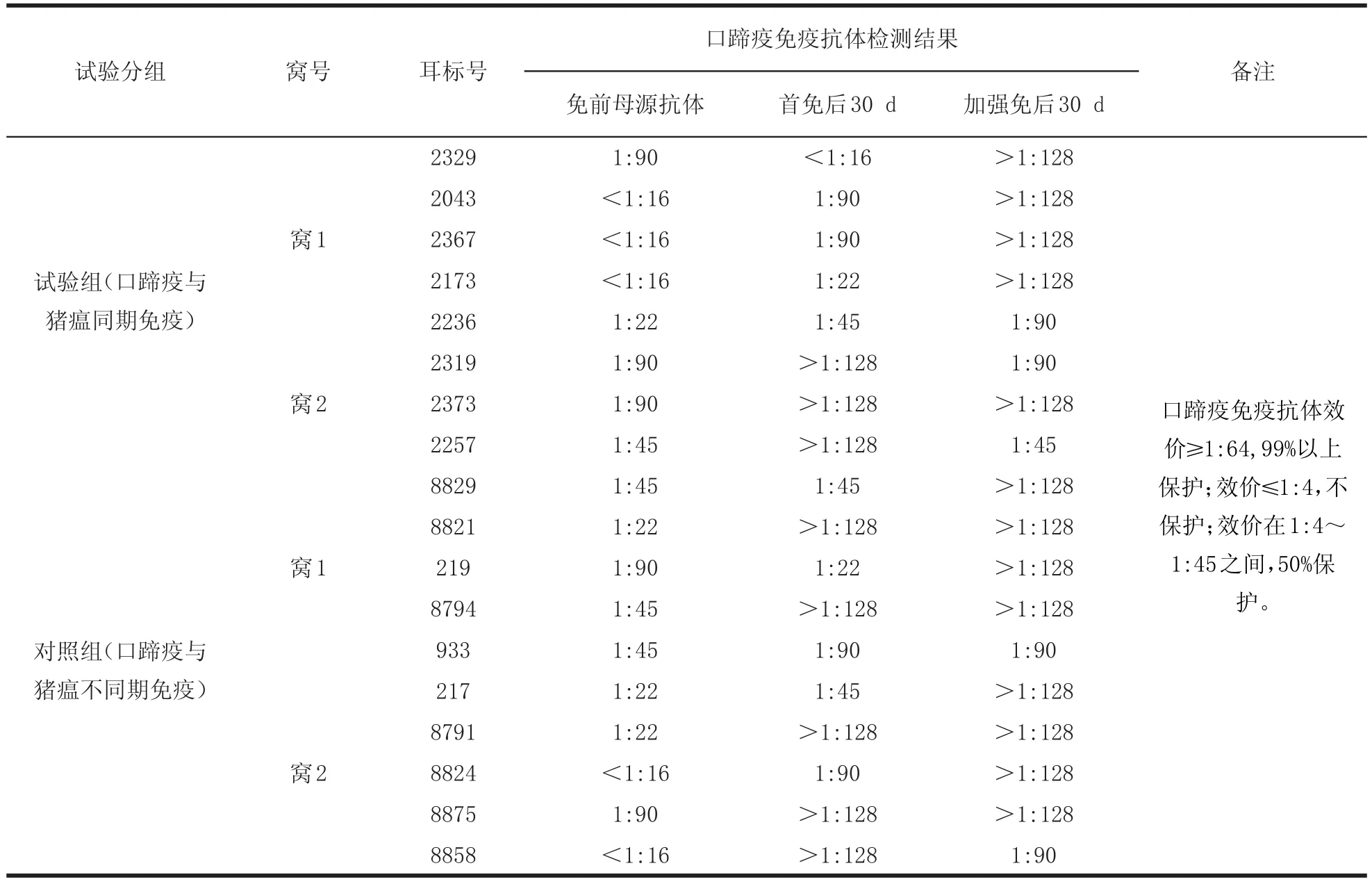
表4 试验猪口蹄疫检测结果明细表Tab le4 Foot-and-mouth disease detection consequence specification o f test pig
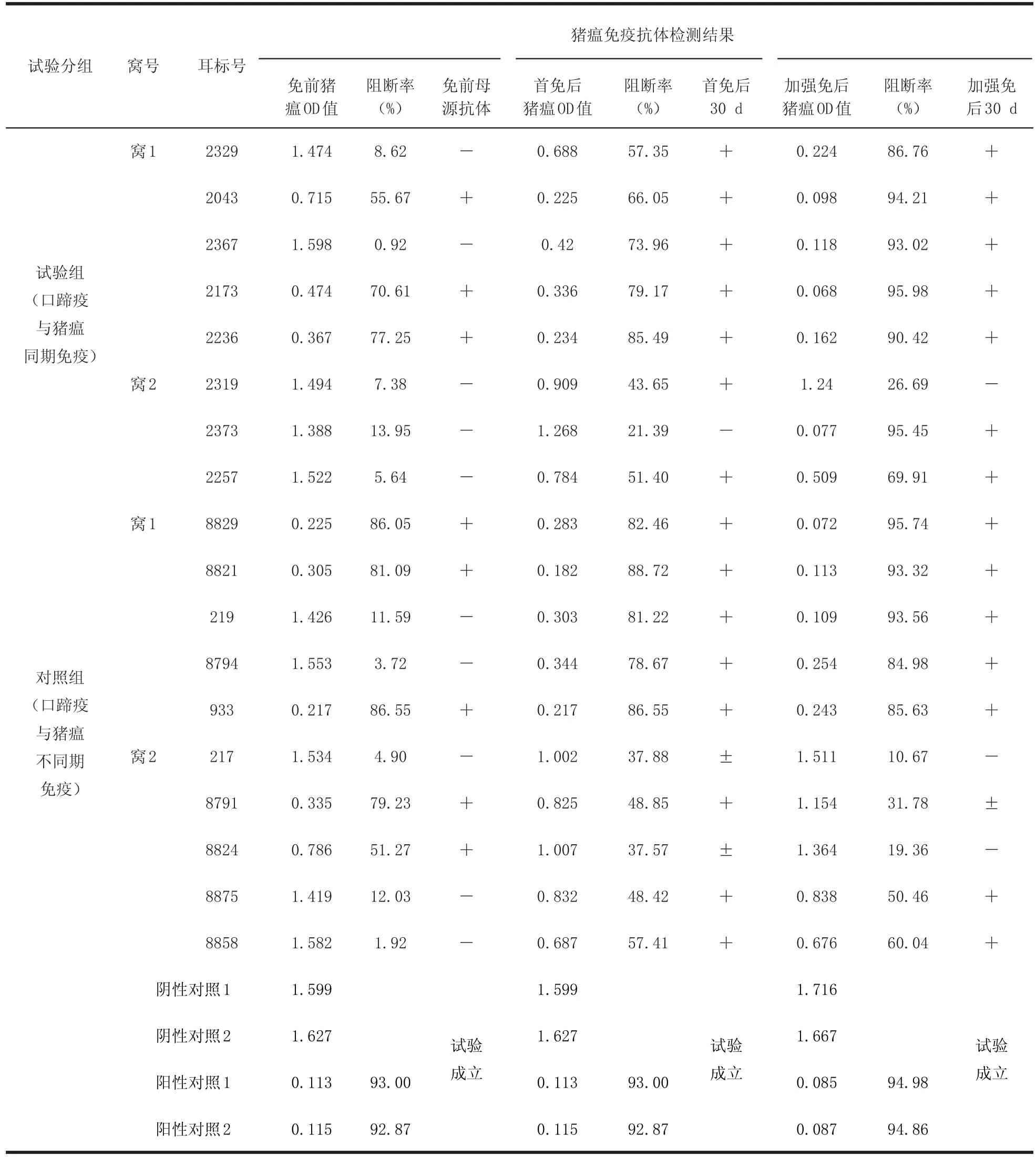
表5 试验猪猪瘟检测结果明细表Tab le5 Sw ine pest detection consequence specification of test pig
2.3 首免后3030 d d免疫抗体检测结果同期免疫组8头仔猪猪瘟抗体合格比率为7/8,分期免疫组10头仔猪猪瘟抗体合格比率为8/10;同期免疫组8头仔猪口蹄疫抗体合格比率为5/8,分期免疫组10头仔猪口蹄疫抗体合格比率为7/10。
2.4 加强免疫后3030 d d免疫抗体检测结果同期免疫组8头仔猪猪瘟抗体合格比率为7/8,口蹄疫抗体合格比率为7/8;分期免疫组10头仔猪猪瘟抗体合格比率为7/10,口蹄疫抗体合格比率为10/10。
2.5 组内、组间猪瘟抗体水平差异性比较
2.5.1 依据表3数据,同期免疫组8头仔猪中,免疫前有3头抗体合格,首免后30 d检测3头均合格;免疫前有5头抗体不合格,首免后30 d检测有4头合格,1头不合格。说明同期首免后8头猪中猪瘟免疫抗体水平向主动免疫方向转化比率至少为7/8,且免疫抗体合格率为7/8。加强免疫后的抗体水平基本维持了上一次的免疫效果。
2.5.2 依据表3数据,分期免疫组10头仔猪中,免疫前有5头抗体合格,首免后30天检测4头合格,1头接近合格;免疫前有5头抗体不合格,首免后30 d检测有4头合格,1头接近合格。说明分期首免后10头猪中猪瘟免疫抗体水平向主动免疫方向转化比率为10/10,且免疫抗体合格率为8/10。加强免疫后的抗体水平也维持了上一次的免疫效果。
22..66 组内、组间口蹄疫抗体差异性比较
2.6.1 依据表4数据,同期免疫组8头仔猪中,免疫前有3头抗体合格,首免后30 d检测2头合格,1头不合格;免疫前有5头仔猪抗体不合格,首免后30 d检测有3头合格,2头不合格(2头不合格仔猪的抗体水平呈上升趋势)。说明同期首免8头仔猪后,口蹄疫免疫抗体水平向主动免疫方向转化的比率7/8,免疫抗体合格率为5/8。加强免疫后的抗体水平普遍有所上升。
2.6.2 依据表4数据,分期免疫组10头仔猪中,免疫前有2头仔猪抗体合格,首免后30 d检测1头合格,1头不合格;免疫前8头仔猪抗体不合格,首免后30 d检测有6头合格,2头不合格(1头抗体水平呈上升趋势、1头保持原来抗体水平)。说明分期首免10头仔猪后,口蹄疫免疫抗体水平向主动免疫方向转化率8/10,免疫合格率为7/10。加强免疫后的抗体水平普遍有所上升。
3 讨论与小结
3.1本试验应用猪瘟活疫苗与猪口蹄疫灭活疫苗,对仔猪实施同期免疫和分期免疫,免疫后经临床观察,两种免疫方法均未发现明显的免疫不良反应。
3.2采取2种免疫方法,首免和加强免疫后检测猪瘟免疫抗体合格率,同期免疫组略高于分期免疫组(同期分别为7/8和7/8,分期分别为8/10和7/10),经卡方检验,差异不显著(P>0.05)。检测发现,分期免疫组中存在个别猪免疫水平存在差异的原因,可能与分期免疫组猪瘟首免日龄早于同期免疫组10 d,受到母源抗体干扰作用较大有关,不能证实与同期免疫口蹄疫疫苗有关。
3.3采取两种免疫方法,首次和加强免疫后口蹄疫免疫抗体合格率略存在差异(同期免疫2次分别为5/8和7/8,分期免疫分别为7/10和10/10),经统计学卡方检验,差异不显著(P>0.05)。2组中个体检测结果存在差异的主要表现是:同期和分期2个试验组中都有1头来自窝1的仔猪检测到免疫反应不正常,与同期注射猪瘟活疫苗不存在必然联系。
3.4现阶段,免疫仍然是有效防控猪瘟(CSF)和口蹄疫(FMD)的关健技术措施。目前,在具体实施CSF和FMD疫苗强制免疫方面,实行两种疫苗首免时间隔7~10 d注射,且在间隔1个月后各加强1次免疫的方法,存在免疫周期长、注射轮次多、抓猪应激频繁,执行起来存在一定阻力等问题。本试验结果与国内有关研究结论[1-2]和2012年省疫控中心内对锦州市黑山、北镇、凌海等3个县(市)进行的猪瘟与口蹄疫疫苗田间同期免疫效果抽检的结果[3]基本一致。
3.5本试验证明,猪瘟与口蹄疫疫苗同期分部位免疫方法与分期错时免疫方法相比,无论是安全性,还是免疫效果,均无显著差异。建议对35日龄仔猪及其以上的适龄猪,可推行猪瘟活疫苗与口蹄疫灭活疫苗实行同期分部位免疫措施,在具体实施中,要根据不同疫苗厂家、批次及养殖户免疫接受能力等实际,先行试免,确认安全后,再扩大推广面。
[1]张作仁,胡成林,熊金洲,等.优化猪瘟、口蹄疫免疫效果试验与研究[J].养殖与饲料,2005,9:30-34.
[2]杨慧,封林,黎强,等.猪口蹄疫和猪瘟疫苗同时注射免疫试验技术报告[J].中国动物检疫,2009,1:38-41.
[3]杨本勇,王克才,李井春,等.不同厂家猪O型口蹄疫疫苗免疫效果比较[J].现代畜牧兽医,2013,11:37-39.
(编辑:张婷婷)
Study on the synchronization and stating immune effect check experimentof sw ine p lague live vaccine and foot-and-mouth disease inactivated vaccine
Wang Kecai1,He Likun1,Gu zhida1,Duan Yal iang1Yang Guol i1,Zheng Hongl ing1,Xiao Aibo2
(1.Liaoning Province Animal Disease Prevention and Control Center,Liaoning Shenyang 110164;2.Liaoning Province Bureau of Livestock Product Safety Supervision,Liaoning Shenyang 110003)
The test was car ried using simple factor experiment method.18 piglets f rom 2 broods born in the same period were divided into experiment group and control group.The experiment group,which has 8 piglets,was injected swine plague l ive vaccine and foot-and-mouth disease inactivation vaccine in the cor responding time period on 35 days and 65 days respectively.The control group which has 10 piglets was injected swine plague live vaccine and foot-and-mouth disease inactivation vaccine by stages 25,55 and 65 days respectively.The test were cl inical accompaniment and observation al l test pigs af ter immunizing,simul taneously,immune antibody level at pre-immune 23 days and af ter immune 55,95 days was detected,the experiment method was using count ry formulary ELISA detection method.The test resul t indicated that these 2 methods have not shown conspicuous alarm reaction in 7 days af ter immunizing.The qual if ication rate di f ference of immune antibody between the experiment group and the cont rol group was quiet.
Swine plague;Foot-and-mouth disease;Synchronization immune;Stating immune;Ef fect
S858.28
:B
:1672-9692(2014)04-0043-05
2014-03-03
王克才(1965-),男,大专,高级兽医师,主要从事动物疫病防控工作。

