白头翁水溶性多糖提取工艺的研究
王宏军,王术德,马 魏,李建国,刘 锦,徐子恒,王 丹,韩晓娜,岳茹凤
(辽宁医学院,辽宁 锦州 121001)
白头翁水溶性多糖提取工艺的研究
王宏军,王术德,马 魏,李建国,刘 锦,徐子恒,王 丹,韩晓娜,岳茹凤
(辽宁医学院,辽宁 锦州 121001)
为了探究白头翁水溶性多糖的提取工艺,本研究采用单因素试验和L9(34)正交试验,考察料液比、提取时间、提取次数和提取温度对水溶性多糖提取率的影响,优选白头翁水溶性多糖的最佳提取工艺条件。结果表明,白头翁水溶性多糖最佳提取工艺条件为:料液比为1:17,100℃提取6 h,提取6次,白头翁水溶性多糖含量为5.07%。为白头翁水溶性多糖的进一步研究奠定了基础。
白头翁;多糖;提取工艺
白头翁(Radix Pulsati l la)为毛莨科植物,分布在吉林、辽宁、河北、山东、河南、山西、陕西、黑龙江等省的山岗、荒坡及田野间,具有清热解毒、凉血止痢的功效,可用于治疗热毒血痢、阴痒带下、阿米巴痢疾等疾病[1-2]。研究表明,白头翁根部中主要为:皂苷类成分如白头翁皂苷A、B、C、D,皂苷1、皂苷2、白桦脂酸-3-0-α-L-阿拉伯吡喃糖苷、胡萝卜苷等[3],有机酸类如白桦酯酸、3-氧代白桦脂酸、齐墩果酸等[4],黄酮类如原白头翁素、白头翁素等[5],还有多糖[6-7]、糖蛋白[8]等成分,但对白头翁多糖提取工艺研究的报道较少。故本研究以单因素试验结合正交试验设计研究白头翁多糖最优提取工艺条件,为其药理活性、结构解析等进一步的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 中药 白头翁(产地:辽宁)购自河北省安国市顺全隆中药材有限公司。
1.1.2 试剂 无水乙醇(天津市风船化学试剂科技有限公司);氯仿(锦州古城化学试剂厂);葡萄糖(天津市津北精细化工有限公司);蒽酮(天津市科密欧化学试剂有限公司,20100110);硫酸(锦州古城化学试剂厂)。
1.1.3 主要仪器 FA2004N型电子天平(上海精密科学仪器有限公司天平仪器厂);KQ-300B型超声波清洗器(昆山市超声仪器有限公司);RE-5203型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-IIIB型循环水真空泵(浙江临海市精工真空设备厂);DZKW-4型电热恒温水浴锅(天津市泰斯特仪器有限公司);QE-200克药材粉碎机(武义县屹立工具有限公司);UV757CRT型紫外可见分光光度计(上海精密科学仪器有限公司);KDM型可调控温电热套(山东鄄城华鲁电热仪器有限公司);TDL-40B型离心机(上海安亭科学仪器厂)。
1.2 试验方法
1.2.1 葡萄糖标准溶液 称取150 mg葡萄糖,105℃干燥至恒重,配制成1 mg/mL溶液,取2.5 mL定容至50 mL即为葡萄糖标准溶液。
1.2.2 蒽酮-硫酸溶液 精确称取蒽酮0.330 0 g至棕色瓶中,用100 mL的浓硫酸使其完全溶解。
1.2.3 标准曲线 量取葡萄糖标准溶液0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL置于具塞试管中,分别加蒸馏水至1.0 mL,再分别加入蒽酮-硫酸溶液2.0 mL,摇匀后,于100℃水浴中煮沸10 min,取出,流水冷却至室温;另取1 mL蒸馏水同上操作,为空白对照。在625 nm波长下测定各管的吸光度值(A),用软件拟合C-A线性回归方程。
1.2.4 多糖含量的测定 将试验所得的提取物用5 mL蒸馏水溶解后,离心,取上清200μL定容至10 mL,取适量液体,按照1.2.3方法显色,在适宜波长下检测吸光度值,代入标准曲线即得样品中多糖含量。
1.2.5 单因素试验 用药材粉碎机将中药白头翁粉碎,过40目筛,以水为溶媒,考察料液比(A)、提取时间(B)、提取次数(C)和提取温度(D)4个因素对多糖含量的影响,考察任意一因素不同水平对多糖含量的影响时,固定其他3个因素水平。即考察料液比的5个水平(1:10、1:15、1:20、1:25、1:30)对多糖含量影响时,提取时间为5 h,提取次数为3次,提取温度为80℃;考察提取时间的5个水平(1、3、5、7、9 h)对多糖含量影响时,料液比为1: 20,提取次数为3次,提取温度为80℃;考察提取次数的5个水平(2、3、4、5、7次)对多糖含量影响时,料液比为1:20,提取时间5 h,提取温度80℃;考察提取温度的5个水平(60、70、80、90、100℃)对多糖含量影响时,料液比为1:20,提取时间为5 h,提取次数为3次。每个试验重复3次。
1.2.6 正交设计试验 根据单因素试验结果,选择对多糖含量影响较大的3个因素,以另一因素的最优水平为辅助条件,用正交表L9(34)设计和安排提取试验,测定多糖含量,经方差分析获得白头翁多糖最优提取工艺条件。
1.2.7 验证性试验 以最优提取工艺条件进行白头翁多糖提取,重复5次,分别计算多糖含量,考察其平均多糖含量及变异系数,以确定优化结果的真实性和准确性。
1.2.8 数据统计学分析 用SPSS 17.0版软件对数据进行方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 标准曲线见图1。对不同浓度葡萄糖标准溶液与对应的吸光度值拟合线性方程为A= 18.383 9C-0.03,r2=0.999 6。
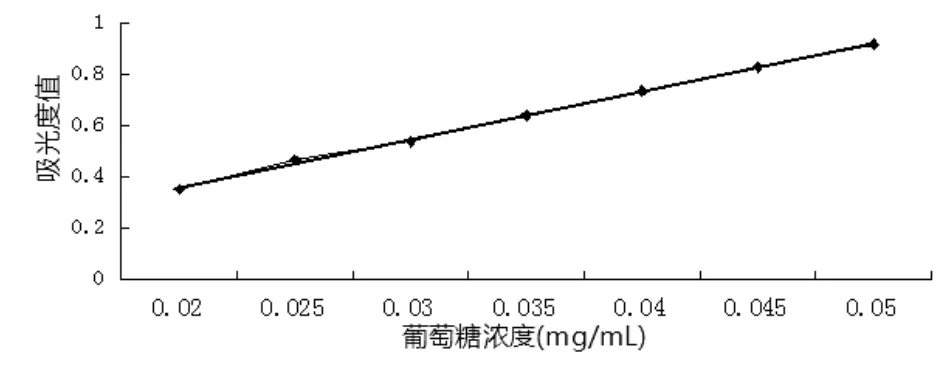
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
由图1可知,葡萄糖浓度在0.02~0.05 mg/mL内,呈良好的线性关系。
2.2 单因素试验结果分析
2.2.1 料液比对多糖含量的影响 见图2。
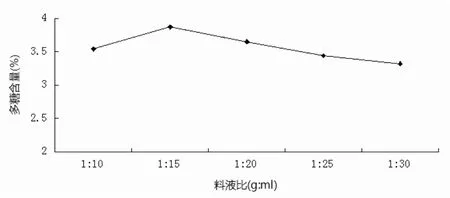
图2 料液比对多糖含量的影响Fig.2 The effect of solid-liquid ratio on polysaccharide content
如图2所示,可知随料液比的增加,白头翁提取物中多糖含量也增加,当料液比达到1:15时,多糖含量达到最大值。
2.2.2 提取时间对多糖含量的影响 见图3。
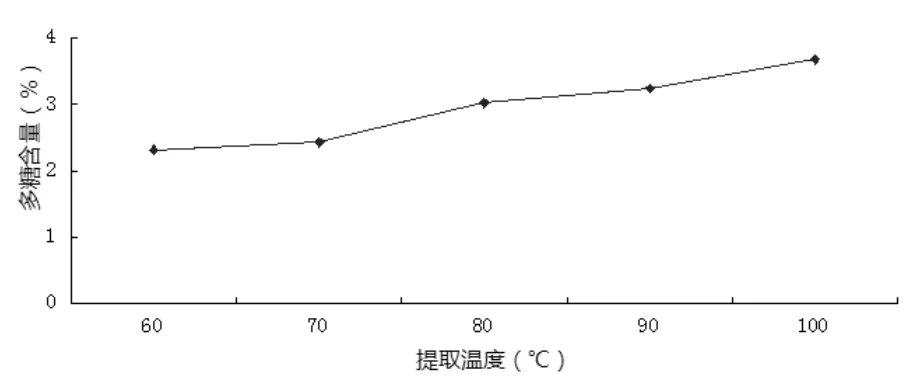
图3 提取时间对多糖含量的影响Fig.3 The effect of extraction time on polysaccharide content
如图3所示,可知随着提取时间的增加,白头翁提取物中多糖含量的浸膏率呈上升趋势,即多糖含量随着提取时间的延长,呈现先升高后降低的趋势,且提取时间达到5 h时,多糖含量达到一个峰值为5.01%。
2.2.3 提取次数对多糖含量的影响 见图4。

图4 提取次数对多糖含量的影响Fig.4 The effectof extraction times on polysaccharide content
如图4所示,可知随着提取次数的增加,白头翁提取物中多糖含量明显升高,当提取次数超过5次,多糖含量呈下降趋势。
2.2.4 提取温度对多糖含量的影响 见图5。

图5 提取温度对多糖含量的影响Fig.5 The effect of extraction tem perature on polysaccharide content
如图5所示,可知60~70℃时,白头翁多糖含量无明显变化;之后随着提取温度的升高,白头翁提取物中多糖含量显著增多。

表1 因素与水平表Table 1 Factors and levels
2.3.2 正交试验 见表2~3。
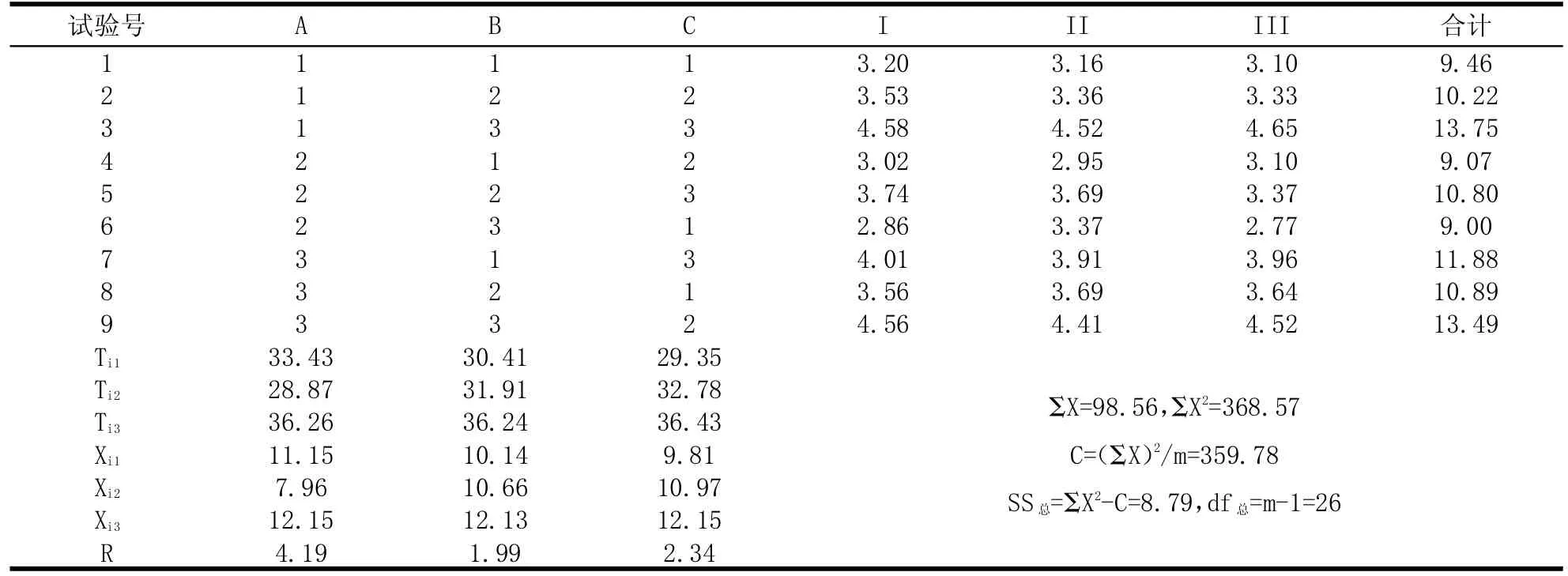
表2 正交试验设计及多糖含量Table 2 Orthogonal experiment design and polysaccharide content%

表3 方差分析结果Table 3 The results of variance analysis
由表2~3可知,料液比(A)、提取时间(B)和提取次数(C)对白头翁提取物中多糖含量影响的次序为:B>C>A。由表3可知,经方差分析,提取时间、提取次数、料液比对白头翁提取物中多糖含量均有极显著的影响(P<0.01),表明因素水平选择合理。由此获得白头翁提取物中多糖含量为考察指标的最佳提取工艺为:A3B3C3,即料液比为1:17,提取时间为6 h,提取次数为6次。
2.4 验证性试验结果在料液比为1:17、提取6 h、提取6次时,白头翁提取物多糖含量为5.07± 0.08%,RSD为1.53%(n=5),明显高于平均水平,故该条件即为白头翁多糖的最佳提取工艺。
3讨论
3.1 多糖含量的测定大多采用苯酚-硫酸比色法,而本项研究采用蒽酮-硫酸比色法,原理是多糖经浓硫酸在沸水浴中水解产生单糖,单糖进一步失水生成糠醛衍生物,糠醛衍生物与蒽酮缩合成有色物质,该有色物质在波长625 nm附近有吸收,因此可用比色法测定其含量,且糖含量与吸光度值之间呈线性关系。通过回收率试验和稳定性试验,用蒽酮-硫酸比色法检测多糖的含量,具有简单可靠、显色稳定等优点,可作为白头翁多糖含量的测定方法。
3.2 影响植物多糖提取的因素主要有料液比、提取温度、提取时间、提取次数、炮制方法等,依据大叶南五味子多糖、刺五加多糖提取工艺研究[9-11],重点考察料液比、提取温度、提取时间和提取次数对白头翁多糖提取率的影响,并利用正交试验设计法获得白头翁多糖的提取工艺条件,该工艺条件下获得的多糖含量达到5.07%优于方艳夕等的报道[6],为白头翁多糖的进一步研究提供依据。
[1]江苏新医学院.中药大辞典(上册)[M].上海:上海科学技术出版社,1986:704-706.
[2]国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2010:68.
[3]叶文才,赵守训,张振华,等.中药白头翁化学成分的研究(Ⅲ)[J].中国药科大学学报,1991,(6):337.
[4]丁秀娟,陈重,李夏,等.白头翁化学成分研究[J].中草药,2012,(12):1952-1954.
[5]时维静,李立顺,董卫星.白头翁化学成分、药理作用及临床应用研究进展[J].中兽医医药杂志,2009(4):22-25.
[6]方艳夕,晏明炉,秦梅颂,等.不同炮制方法对白头翁多糖含量的影响[J].中兽医医药杂志,2010,(3):14-16.
[7]徐秀廷,赵玉英,顾德昌.气相色谱法分析蒙药白头翁多糖的单糖组分[J].武工程大学学报,2001,33(7):31-33.
[8]陈彦,李一琨,包森林,等.白头翁糖蛋白的分离纯化及其性质[J].中国生化药物杂志,1997,18(4):180-183.
[9]蒋红,刘锦,王宏军,等.白头翁水溶性物质的提取工艺研究[J].现代畜牧兽医,2014,(1):10-13.
[10]Wang H.J.,Jiang H.,Wang S.D.,et al.Ext raction,puri f ication and prel iminary characterization of polysaccharides f rom Kadsura marmorata f ruits[J]. Carbohydrate Polymers, 2013,92(2):1901-1907.
[11]程海涛,刘娟,刘德江,等.正交试验法优化刺五加多糖的提取工艺[J].佳木斯大学学报(自然科学版),2011,29(2):311-313.
(编辑:张婷婷)
Extraction ofWater-Soluble Polysaccharides from Radix Pulsatilla
Wang Hongjun,Wang Shude,Ma Wei,Li Jianguo,Liu Jin, Xu Ziheng,Wang Dan,Han Xiaona,Yue Rufeng
(Liaoning Medical University, Liaoning Jinzhou 121001)
To optimize the ext raction procedure of water-soluble polysaccharides f rom Radix Pulsati l la,single factor test and or thogonal test were designed to investigate the ef fects of sol idliquid ratio,extraction time and number of ext raction.The resul ts showed that the optimal extracting conditions were the solid-l iquid ratio of 1:17,ext raction time of 6 hrs and ext racting 6 times at 100℃ in water.Under these conditions,the extraction percentage was up to 5.07%.This study provided the basis for fur ther research of water-soluble polysaccharides in Radix Pulsati l la.
Radix Pulsatil la;Polysaccharides;Ext raction technology
S859.4
:A
:1672-9692(2014)02-0001-04
2013-11-10
王宏军(1977-),男,博士研究生,副教授,硕士研究生导师,研究方向为天然药物提取及其药理学与毒理学研究。
国家自然科学基金项目(31201951);辽宁省高等学校优秀人才支持计划项目(LJQ2013087);辽宁省中小企业创新基金(辽科发﹝2012﹞33号);辽宁省大学生创新创业训练计划项目(201310160035)

