二维斑点追踪成像评价心脏淀粉样变性与肥厚型心肌病左心室内膜下及外膜下心肌应变比较
张 晶ZHANG Jing
詹 莹1ZHAN Ying
任卫东1REN Weidong
郑 松2ZHENG Song
刘 爽3LIU Shuang
潘福治1PAN Fuzhi
二维斑点追踪成像评价心脏淀粉样变性与肥厚型心肌病左心室内膜下及外膜下心肌应变比较
张 晶1ZHANG Jing
詹 莹1ZHAN Ying
任卫东1REN Weidong
郑 松2ZHENG Song
刘 爽3LIU Shuang
潘福治1PAN Fuzhi
中国医学影像学杂志
2014年 第22卷 第1期:36-40,44
Chinese Journal of Medical Imaging
2014 Volume 22(1): 36-40, 44
目的探讨斑点追踪成像评价心脏淀粉样变性(CA)与肥厚型心肌病(HCM)患者左心室内膜下和外膜下心肌收缩功能的价值。资料与方法 25例CA患者、20例HCM患者及27例健康志愿者分别行超声心动图检查,应用Qlab 8.1软件测量左心室各节段内膜下、外膜下及平面整体心肌收缩期纵向应变峰值(LS),计算左心室整体内膜下、外膜下及平面整体心肌LS; HCM组心肌节段分为HCM非肥厚节段组和HCM肥厚节段组,比较CA组与HCM肥厚节段组心肌各应变指标的差异,并比较相应指标的诊断效能。结果①与对照组比较,CA组及HCM组各水平及左心室整体内膜下、外膜下、平面整体心肌LS减低(P<0.001);与HCM组比较,CA组基底段及整体内膜下、外膜下、平面整体心肌LS、中间段外膜下心肌LS减低(P<0.05)。②与HCM肥厚节段组比较,HCM非肥厚节段组心肌应变值稍高(P<0.01);CA组病变心肌应变值差异均无统计学意义(P>0.05),左心室平均内膜下心肌LS/整体心肌LS比例明显增高(P<0.001)。③以左心室平均内膜下心肌LS/整体心肌LS>1.050作为判断CA和HCM病变心肌的临界值,其敏感度为96%,特异度为72%。结论CA和HCM患者左心室纵向内膜下、外膜下及平面整体心肌收缩期功能均受损,CA以内膜下心肌为著,HCM以肥厚节段为著,CA左心室平均内膜下心肌LS/整体心肌LS高于HCM,可以为临床提供一定的参考价值。
淀粉样变性;心肌病,肥厚性;超声心动描记术;斑点追踪成像;心室功能,左;心肌应变;诊断,鉴别
心脏淀粉样变性(cardiac amyloidosis, CA)和肥厚型心肌病(hypertrophic cardiomyopathy, HCM)在超声上均表现为心肌肥厚,但两者发病机制截然不同,CA是由于不可溶性的淀粉样蛋白对心肌间质的浸润,HCM是心肌纤维排列方向紊乱造成的。心肌应变在诸多心血管疾病早期收缩功能受损时即可出现改变[1],对判断左心室早期收缩功能受损敏感性较高,且以纵向运动最为敏感[2]。本文拟应用二维斑点追踪成像(2D-STI)观察CA及 HCM患者左心室内膜下、外膜下及整体心肌纵向应变的特点,分析CA和HCM病变心肌的应变值差异,探讨两者局部心肌收缩功能的变化特点。
1 资料与方法
1.1 研究对象 2009-01~2013-06于中国医科大学附属盛京医院确诊的25例CA患者,其中男15例,女10例;年龄42~70岁,平均(57.40±8.52)岁。纳入标准:①有心力衰竭、心绞痛、晕厥及各种类型的心律失常等心脏受累的临床症状;②典型的CA超声心动图表现:左心室心肌明显增厚(>13 mm),伴或不伴右心室心肌增厚(>8 mm),心肌内可见闪烁颗粒样回声;③经心外活检证实为淀粉样变性,活检部位:皮肤12例,舌体组织5例,肾5例,牙龈2例,膀胱1例。排除肥厚型心肌病、高血压、糖尿病及肾脏疾病引起的继发性心肌肥厚、冠心病、严重心律失常、中重度瓣膜疾病及其他疾病所致心脏器质性病变。
同期经临床表现、心电图及超声心动图确诊的20例HCM患者,均符合ACCF/AHA的诊断标准[3],二维测值显示原因不明的肥厚室壁厚度≥15 mm,排除长期高血压、缺血性心肌病及其他可能引起心肌肥厚的心血管疾病和全身疾病。其中男12例,女8例;年龄41~69岁,平均(54.87±7.43)岁。由于HCM患者心肌为非均匀性病变,依据心肌节段厚度是否≥15 mm[3,4]将HCM患者所有心肌节段分为HCM非肥厚节段组和HCM肥厚节段组。
选择同期27例健康志愿者作为对照组,其中男16例,女11例;年龄42~72岁,平均(54.56±6.73)岁,均经体格检查、实验室检查、心电图及超声心动图检查排除器质性心血管疾病。
1.2 仪器与方法 采用Philips iE33彩色多普勒超声诊断仪,S5-1探头,频率1~5 MHz,帧频(65±5)帧/s。患者取左侧卧位,同步记录心电图。于胸骨旁左心室长轴切面测量左心房收缩末期内径(LAESd)、左心室舒张末期内径(LVEDd)、舒张末期室间隔厚度(IVSd)、左心室舒张末期后壁厚度(LVPWDd),于心尖四腔以Simpson双平面法测量左心室射血分数(LVEF);采用脉冲多普勒测量二尖瓣口舒张早期峰值(E峰)、舒张晚期峰值(A峰)、E波速度下降时间(DT),计算E/A;组织多普勒记录二尖瓣环室间隔侧收缩期s峰值速度、舒张早期e峰值速度、舒张晚期a峰值速度,计算E/e。然后采集心率一致的3个心动周期心尖四腔心、三腔心、两腔心二维动态图像并储存。
1.3 图像分析 采用Qlab 8.1的TMQ Advanced斑点追踪软件程序,系统自动将左心室心肌等分为内膜下及外膜下感兴趣区域,显示各节段内膜下、外膜下及整体心肌的应变曲线及应变值,获得左心室壁16节段(6个基底段、6个中间段、4个心尖段,不包括心尖帽)纵向应变峰值(LS),根据不同水平将16节段纵向分为基底段(6节段均值)、中间段(6节段均值)及心尖段(4节段均值)3个层面,将HCM组所有心肌节段根据心肌厚度是否≥15 mm[3,4]分为HCM非肥厚节段:共804个节段,包括内膜下268个节段、外膜下268个节段、平面整体268个节段;HCM肥厚节段:共156个节段,包括内膜下52个节段、外膜下52个节段、平面整体52个节段。计算各组左心室平均内膜下心肌LS/外膜下心肌LS及左心室平均内膜下心肌LS/整体心肌LS比值。
1.4 统计学方法 采用SPSS 17.0软件,计量资料组间比较采用单因素方差分析,两两比较采用LSD法,采用ROC曲线评价诊断效能,P<0.05表示差异有统计学意义。
2 结果
2.1 各组常规超声参数比较 3组患者年龄、性别比、LVEDd、舒张末期容积(EDV)、收缩末期容积(ESV)、E、A、E/A比较,差异均无统计学意义(P>0.05)。与对照组比较,CA组IVSd、LVPWDd、LAESd及E/e明显增高,SV、LVEF、DT、s、e、a明显减低,差异有统计学意义(P<0.001);HCM组IVSd、LVPWDd、LAESd及E/e增高,s、e、a减低,差异有统计学意义(P<0.01),SV、LVEF、DT差异无统计学意义(P>0.05)。与HCM组比较,CA组LVPWDd、SV及E/e增高,IVSd、LVEF、DT、s、a减低,差异有统计学意义(P<0.05);LAESd、e差异均无统计学意义(P>0.05)。见表1、2。

表1 3组患者常规超声心动图指标比较

表2 3组患者脉冲及组织多普勒超声参数比较
2.2 各水平及整体收缩期内膜下、外膜下、平面整体心肌LS比较 3组患者LS曲线相似,峰值为负(图1), CA组及对照组LS由基底到心尖呈增高趋势,而HCM组中间段LS最低,且无可遵循的趋势变化。与对照组比较,CA组及HCM组各水平及整体内膜下、外膜下、平面整体心肌LS明显减低,差异有统计学意义(P<0.001);与HCM组比较,CA组基底段及整体内膜下、外膜下、平面整体心肌LS、中间段外膜下心肌LS减低,差异有统计学意义(P<0.05),其余心肌节段LS差异均无统计学意义(P>0.05)。见表3。
2.3 各组所含心肌节段LS参数比较 与HCM肥厚节段组比较,HCM非肥厚节段组所对应的节段内膜下、外膜下、平面整体心肌LS、平均内膜下心肌LS/外膜下心肌LS、平均内膜下心肌LS/整体心肌LS增高,差异有统计学意义(P<0.01);CA组平均内膜下心肌LS/整体心肌LS明显增高,差异有统计学意义(P<0.001);其余应变指标差异均无统计学意义(P>0.05),见表4。
2.4 ROC曲线分析 左心室平均内膜下心肌LS/整体心肌LS在CA和HCM病变心肌差异有统计学意义(P<0.001)。ROC曲线分析显示,曲线下面积为0.82,以左心室平均内膜下心肌LS/整体心肌LS>1.050作为鉴别CA和HCM病变心肌的临界值,其敏感度为96%,特异度为72%,见图2。
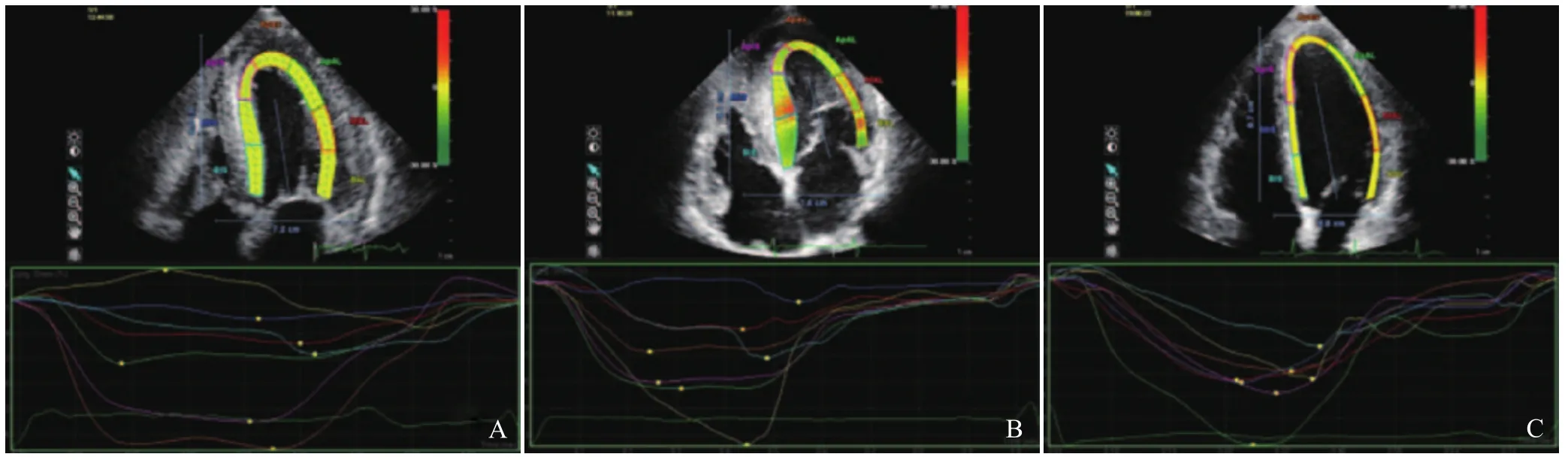
图1 A~C分别为CA组、HCM组、对照组心尖四腔心所对心肌节段内膜下心肌纵向应变曲线。3组均于收缩末期达峰值,峰值为负,但CA组及HCM组曲线波幅较大,峰值明显低于对照组;CA组峰值低于HCM组
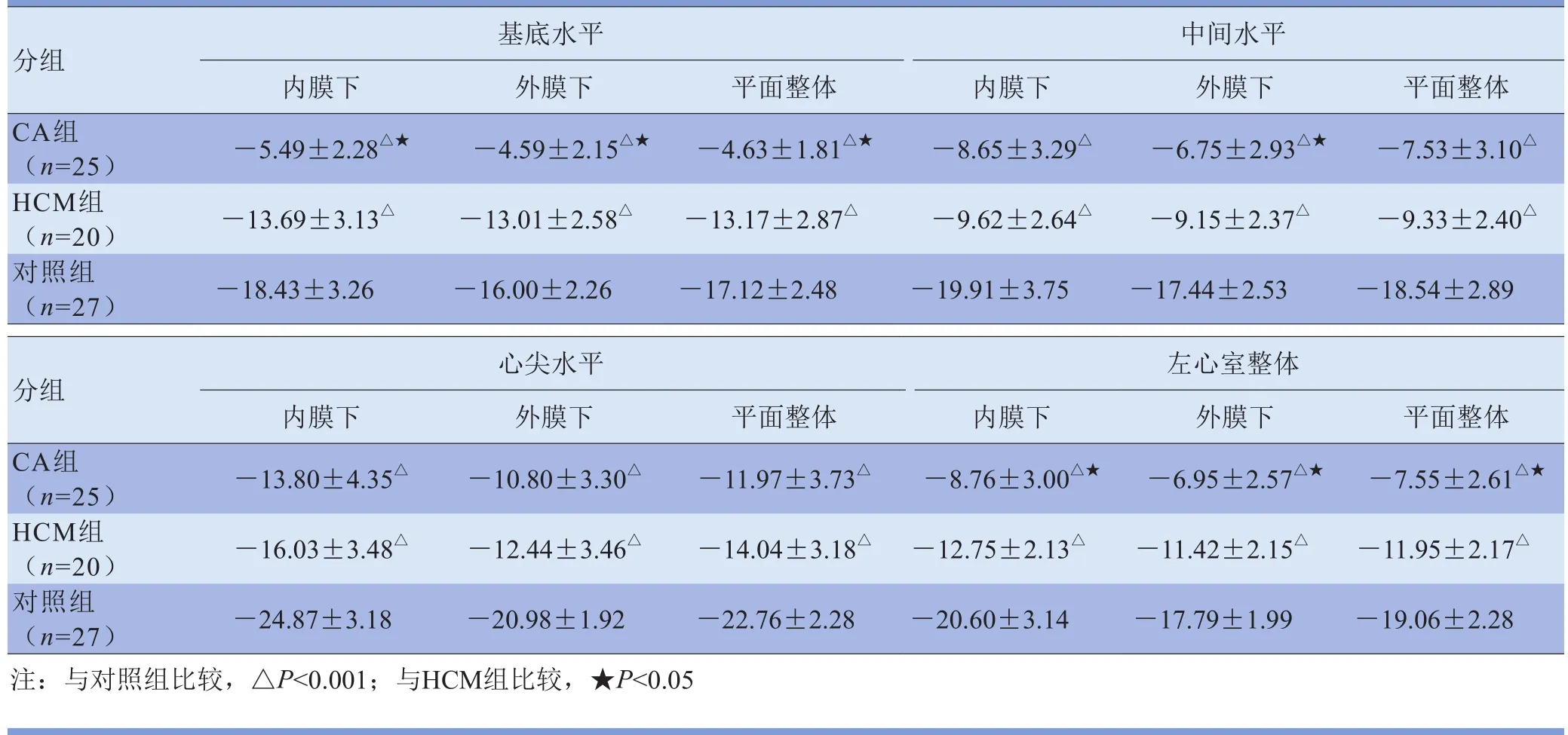
表3 3组患者左心室各水平及整体收缩期内膜下、外膜下及平面整体心肌LS比较(%)

表4 4组患者所含心肌节段内膜下、外膜下及平面整体心肌LS比较

图2 内膜下心肌LS/整体心肌LS鉴别CA及HCM肥厚节段病变心肌的ROC曲线
3 讨论
CA为罕见病,主要病因为不可溶性的淀粉样蛋白对心肌间质和其余心脏结构的弥漫浸润过程[5],于左心室心肌表现为心肌弥漫性增厚。HCM属于原发于心肌的常染色体显性遗传病,是由肌小节基因突变所致[6],基因突变导致肌小节收缩和(或)调节功能异常,受累区域心肌细胞奇异肥大,心肌纤维排列方向紊乱,肌束结构破坏,并存在间质纤维组织增生,于左心室心肌则表现为明显的非对称性或对称性增厚。因此,CA与HCM的病理过程有本质的差别;然而两者心肌肥厚的部位和程度有交叉,且早期均表现为舒张功能减低[7]。本研究结果显示,CA和HCM均表现为室壁增厚、左心房大、舒张功能障碍,CA舒张功能障碍更为严重,呈限制性舒张功能障碍表现,与既往研究结果[4,8]一致。
然而在评价心脏收缩功能方面,通过LVEF仅能评价左心室整体收缩功能的变化,并且对于此类向心性左心室肥厚型心脏病患者,由于室壁肥厚的代偿,常常造成EDV减小,这样造成测量的LVEF往往不低,对收缩功能的评价存在高估。STI评价左心室心肌局部收缩功能方面的优势已经得到证实,鉴于淀粉样蛋白在内、外膜下心肌浸润的时相及多少存在差异[9,10],内、外膜下心肌收缩功能受损程度可不相同[8],对CA心肌进行分层形变能力的定量研究国内外报道较少,结合HCM病变心肌的对照更少有报道,本研究即应用STI评价CA和HCM患者左心室壁内膜下、外膜下心肌纵向变形能力,比较两者病变心肌局部收缩功能的变化。
心肌由70%的纵行肌和30%的环行肌构成,纵行肌主要存在于心内膜下,它受缺血和间质纤维化的影响最大,心脏疾病的早期即可以出现改变,是反映心肌受损最敏感的指标[2]。在量化左心室纵向功能时,与常规测量射血分数相比,测定左心室心肌收缩力的改变能够更好地鉴别心肌病[11]。本研究结果表明,与对照组相比,CA组和HCM组无论各水平还是整体内、外膜下及平面整体心肌LS均明显减低,表明CA和HCM患者左心室内膜下、外膜下及整体心肌纵向收缩功能均受损,CA患者纵向收缩功能受损更为严重,以内膜下心肌为著,其可能原因为:①淀粉样蛋白可以弥漫性地浸润整个心脏组织结构[12],于室壁心肌主要沉积在心肌间质中,淀粉样蛋白形成过程中的一系列中间产物均可能对心肌造成损伤,如前体蛋白对心肌的直接毒性损伤作用[13]、分子量较小的中间产物可能干扰细胞的凋亡机制,加速心肌细胞死亡[14];②成熟的淀粉样蛋白形成后,通过浸润与扩大可以造成心肌细胞代谢、钙离子转运、受体调节等障碍,最终导致细胞水肿[15],造成对心肌细胞的损伤;③淀粉样蛋白能涉及整个循环系统[10],冠状动脉储备减少,心肌缺血,均直接导致心肌收缩功能障碍;④成熟的淀粉样蛋白还具有调节基质结构和组织重构的作用,造成基质的活动异常[16],对心肌细胞、心肌细胞间力的耦合和心肌功能均会造成损伤;⑤淀粉样蛋白主要以内膜下心肌浸润为主,造成内膜下心肌LS减低更为明显[8]。
此外,CA及对照组LS呈基底到心尖增高梯度,而HCM无可遵循的梯度变化特征,其原因可能为:①HCM心肌细胞排列杂乱无章,细胞间质纤维化仅局灶性分布于肥厚的部分[6],以局部心肌收缩功能减低为主;②肥厚节段的形变能力明显下降,而其他正常节段有一定的形变储备能力[17],疾病初期,正常节段收缩功能正常或增强,随着疾病的发展,正常节段储备能力下降,收缩功能亦减低,可以解释本研究结果。
鉴于CA及HCM病变心肌的部位不同,CA以内膜下及弥漫性心肌浸润为主,累及整个心肌;而HCM主要以局灶的心肌病变为主,不累及整个心肌[18],本研究进一步对CA及HCM病变心肌进行比较,结果表明,CA与HCM病变心肌的应变值差异无统计学意义,表明两者病变心肌纵向收缩功能受损程度相似,但CA病变心肌平均内膜下心肌LS/整体心肌LS明显高于HCM患者,ROC曲线分析显示,以平均内膜下心肌LS/整体心肌LS>1.050作为鉴别CA和HCM病变心肌的临界值,其敏感度及特异度均较高,分别为96%和72%,提示平均内膜下心肌LS/整体心肌LS鉴别CA及HCM病变心肌有一定的准确性。
总之,STI技术可以用来评价CA和HCM区域心肌运动能力,CA和HCM患者左心室纵向内膜下、外膜下及平面整体心肌收缩期功能均受损,CA以内膜下心肌受损为著,HCM以肥厚节段受损为著。CA和HCM病变心肌的纵向收缩功能受损程度相似,但左心室平均内膜下心肌LS/整体心肌LS存在差异,可以为临床提供一定的参考价值。
[1] Di Bella G, Gaeta M, Pingitore A, et al. Myocardial deformation in acute myocarditis with normal left ventricular wall motion--a cardiac magnetic resonance and 2-dimensional strain echocardiographic study. Circ J, 2010, 74(6): 1205-1213.
[2] Sengupta PP, Krishnamoorthy VK, Korinek J, et al. Left ventricular form and function revisited: applied translational science to cardiovascular ultrasound imaging. J Am Soc Echocardiogr, 2007, 20(5): 539-551.
[3] Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation, 2011, 142(6): 1303-1338.
[4] Di Bella G, Minutoli F, Pingitore A, et al. Endocardial and epicardial deformations in cardiac amyloidosis and hypertrophic cardiomyopathy. Circ J, 2011, 75(5): 1200-1208.
[5] Quarta CC, Kruger JL, Falk RH. Cardiac amyloidosis. Circulation, 2012, 126(12): 178-182.
[6] Afonso L, Kondur A, Simegn M, et al. Two-dimensional strain profles in patients with physiological and pathological hypertrophy and preserved left ventricular systolic function:acomparative analyses. BMJ Open, 2012, 2(4): e001390.
[7] Namdar M, Steffel J, Jetzer S, et al. Value of electrocardiogram in the differentiation of hypertensive heart disease, hypertrophic cardiomyopathy, aortic stenosis, amyloidosis, and Fabry disease. Am J Cardiol, 2012, 109(4): 587-593.
[8] 张晶, 肖杨杰, 任卫东, 等. 斑点追踪成像评价心脏淀粉样变性患者左心室心肌分层应变. 中国医学影像学杂志, 2013, 21(4): 268-269.
[9] Vogelsberg H, Mahrholdt H, Deluigi CC, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol, 2008, 51(10): 1022-1030.
[10] Ruberg FL, Appelbaum E, Davidoff R, et al. Diagnostic and prognostic utility of cardiovascular magnetic resonance imaging in light-chain cardiac amyloidosis. Am J Cardiol, 2009, 103(4): 544-549.
[11] Buss SJ, Emami M, Mereles D, et al. Longitudinal left ventricular function for prediction of survival in systemic light-chain amyloidosis: incremental value compared with clinical and biochemical markers. J Am Coll Cardiol, 2012, 60(12): 1067-1076.
[12] Perfetto F, Cappelli F, Bergesio F, et al. Cardiac amyloidosis: the heart of the matter. Intern Emerg Med, 2013, 8(3): 191-203.
[13] Palladini G, Lavatelli F, Russo P, et al. Circulating amyloidogenic free light chains and serum N-terminal natriuretic peptide type B decrease simultaneously in association with improvement of survival in AL. Blood, 2006, 107(10): 3854-3858.
[14] Reixach N, Deechongkit S, Jiang X, et al. Tissue damage in the amyloidoses: transthyretin monomers and nonnative oligomers are the major cytotoxic species in tissue culture. Proc Natl Acad Sci U S A, 2004, 101(9): 2817-2822.
[15] Sipe JD, Benson MD, Buxbaum JN, et al. Amyloid fibril protein nomenclature: 2010 recommendations from the nomenclature committee of the International Society of Amyloidosis. Amyloid, 2010, 17(3-4): 101-104.
[16] Seldin DC, Berk JL, Sam F, et al. Amyloidotic cardiomyopathy: multidisciplinary approach to diagnosis and treatment. Heart Fail Clin, 2011, 7(3): 385-393.
[17] Ganame J, Mertens L, Eidem BW, et al. Regional myocardial deformation in children with hypertrophic cardiomyopathy: morphological and clinical correlations. Eur Heart J, 2007, 28(23): 2886-2894.
[18] Baccouche H, Maunz M, Beck T, et al. Differentiating cardiac amyloidosis and hypertrophic cardiomyopathy by use of three-dimensional speckle tracking echocardiography. Echocardiography, 2012, 29(6): 668-677.
(责任编辑 张春辉)
Speckle Tracking Imaging in Assessing Left Ventricular Endocardial and Epicardial Myocardial Strain of Cardiac Amyloidosis and Hypertrophic Cardiomyopathy
PurposeTo discuss the value of speckle tracking imaging (STI) in assessing left ventricular epicardial and endocardial strain of cardiac amyloidosis (CA) and hypertrophic cardiomyopathy (HCM).Materials and MethodsSeventy-two people (25 patients with CA, 20 patients with HCM and 27 healthy volunteers) underwent echocardiography. The peak systolic longitudinal strain (LS) was measured in 16 segments of endocardial myocardium, epicardial myocardium and transmural myocardium and calculated with software Qlab 8.1. Furthermore, all HCM segments were divided into two subgroups: HCM non-hypertrophic segments and HCM hypertrophic segments. Each strain indicator in HCM hypertrophic segments group and CA group was compared and diagnostic effcacy was further compared.Results①Compared with control group, the LS of endocardial, epicardial and transmural myocardium at three long-axis levels (basal, middle and apical) in both CA and HCM groups decreased signifcantly (P<0.001); compared with that in HCM group, the basal and global LS of endocardial, epicardial and transmural myocardium, the middle of thresholdepicardial myocardium decreased in CA group (P<0.05). ②Compared with that of hypertrophic segments in HCM hypertrophic segments group, myocardial strain was slightly higher in HCM non-hypertrophic segments group (P<0.01); in CA group, the mean-endo LS/transmural LS were significantly increased (P<0.001); and no signifcant difference was found in the other LS parameters (P>0.05).③The mean-endo LS/transmural LS had high accuracy in differentiating segments in CA group from hypertrophic segments in HCM hypertrophic segments group. A cut-off value of mean-endo LS/transmural LS more than 1.050 had both high sensitivity and specifcity of 96% and 72%, respectively.ConclusionLongitudinal LV deformations are impaired in patients with CA and HCM; in particular, CA is more likely to have impairment in endocardial myocardium and HCM is more likely to have impairment in hypertrophic segments. Mean-endo LS/transmural LS can accurately differentiate segments of CA from hypertrophic segments of HCM.
Amyloidosis; Cardiomyopathy, hypertrophic; Echocardiography; Speckle tracking imaging; Ventricular function, left; Myocardial strain; Diagnosis, differential
1. 中国医科大学附属盛京医院超声科 辽宁沈阳 110004
任卫东
2013-08-19
10.3969/j.issn.1005-5185.2014.01.011
2013-12-17
2. 中国医科大学附属第一医院皮肤科 辽宁沈阳 110001
3. 中国医科大学附属第一医院心功能科辽宁沈阳 110001
Department of Ultrasound, Shengjing Hospital of China Medical University, Shenyang 110004, China
Address Correspondence to: REN Weidong
E-mail: renwd01@163.com
辽宁省科学技术计划项目(2011225015)。
R542.2;R445.1

