肾嗜酸细胞腺瘤的CT与MRI表现
孙祎繁SUN Yifan
陈自谦2CHEN Ziqian
吴应行1WU Yinghang
王述文2WANG Shuwen
肾嗜酸细胞腺瘤的CT与MRI表现
孙祎繁1SUN Yifan
陈自谦2CHEN Ziqian
吴应行1WU Yinghang
王述文2WANG Shuwen
目的探讨肾嗜酸细胞腺瘤的CT和MRI表现,并与病理结果进行对照,以提高其诊断准确性。资料与方法回顾性分析13例经手术病理证实的肾嗜酸细胞腺瘤的影像及病理资料,其中8例行CT检查,5例行MRI检查,观察肿瘤的部位、大小、形态、边界,以及有无钙化、坏死与囊变、星状瘢痕、平扫及增强扫描各期强化情况、肾周组织侵犯及淋巴结转移。结果13例病灶均为单发,7例位于左肾,6例位于右肾;病灶最大径(4.4±1.7)cm。CT平扫3例病灶呈等密度;皮髓质期8例病灶明显强化,其中6例强化低于肾皮质,2例强化稍高于肾皮质;实质期4例强化下降并低于肾髓质,4例持续强化但在排泄期密度开始下降。5例MRI平扫T1WI病灶呈等、低信号,T2WI病灶呈混杂稍高信号,DWI呈混杂高信号;三维容积式内插值法屏气检查序列动态增强扫描特点与CT相似。8例见星芒状瘢痕,8例见完整包膜,1例见钙化。13例低分子量角蛋白(+),10例CD10(+),5例钙黏附蛋白-E(+),3例上皮膜抗原(+),5例细胞角蛋白-7(+)。结论肾嗜酸细胞腺瘤的影像表现有一定的特征性,位于肾皮质区,边界清楚,大部分肿瘤为富血供,CT平扫病灶呈等密度,MRI平扫病灶呈等信号,强化具有一定的特征,囊变或坏死少见,中央出现星状瘢痕,对诊断具有较大帮助。
肾肿瘤;腺瘤,嗜酸性;体层摄影术,螺旋计算机;磁共振成像;病理学,外科
肾嗜酸细胞腺瘤(renal oncocytoma, RO)是一种少见的肾脏良性实质性肿瘤,占肾脏肿瘤的3%~7%[1],预后良好,治疗方法为局部肿瘤切除。由于临床医师对其影像特征认识不足,术前极易误诊为肾癌而行根治性肾切除。本研究回顾性分析经手术及病理证实的13例RO的影像学特征,并结合病理结果进行对照分析,为提高该病的术前诊断准确性和选择手术方案提供依据。
1 资料与方法
1.1 研究对象 收集南京军区福州总医院2009-01~2013-07经手术病理证实的13例RO患者,年龄41~71岁,平均(54.5±9.2)岁。肿瘤边缘清晰,病灶最大径2.5~8.4 cm,平均(4.4±1.7)cm,其中2例病灶最大径<3.0 cm;肿块位于肾皮质区,均向肾轮廓外突出。13例中7例术前误诊为肾癌而行肾根治性切除术,2例确诊为嗜酸细胞腺瘤,4例考虑为肿瘤。8例术前行腹部CT平扫及三期增强扫描,5例术前行腹部MRI扫描。13例患者的一般资料见表1。
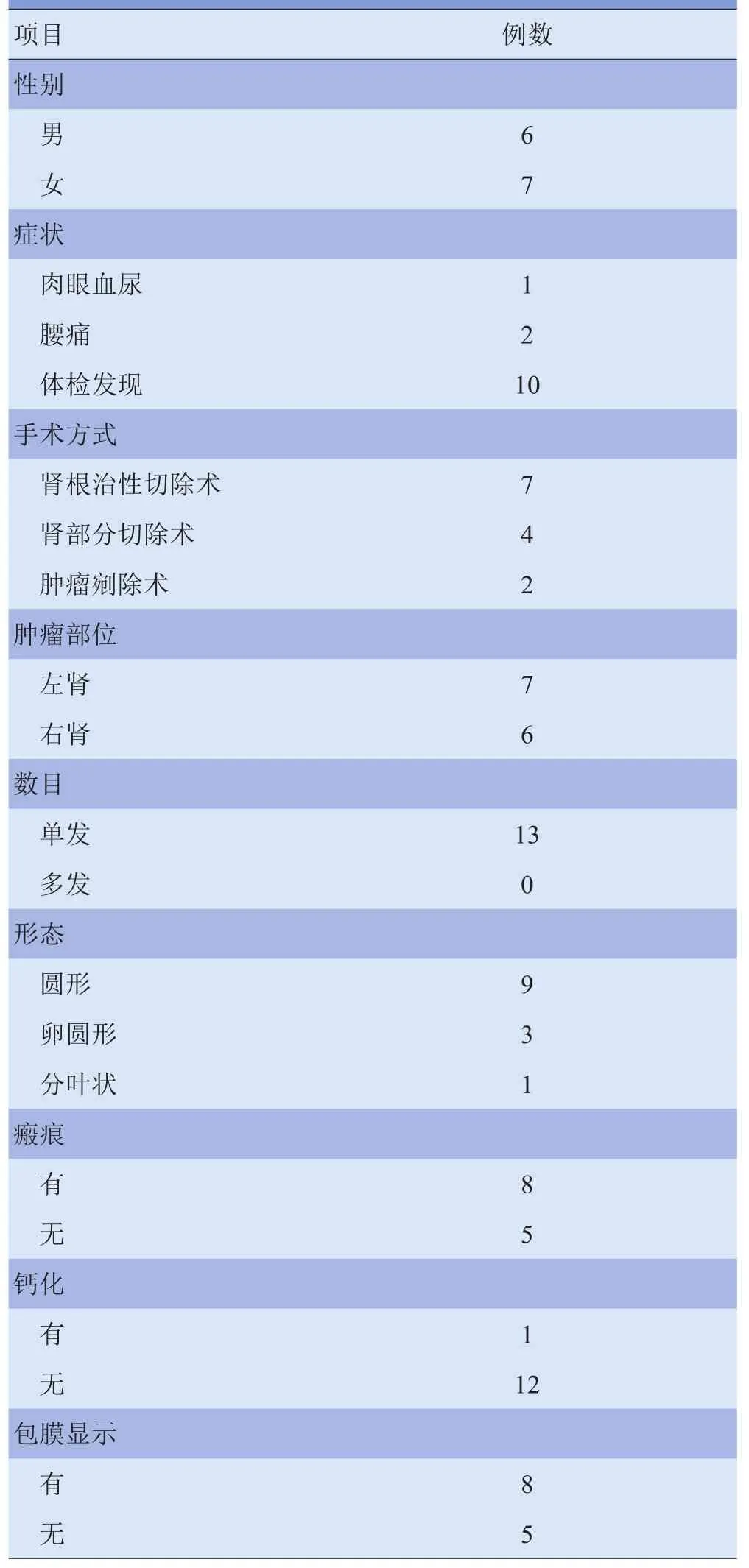
表1 13例RO患者的一般资料
1.2 仪器与方法 采用Philips Brilliance 64层螺旋CT及Philips Brilliance 256层iCT螺旋CT扫描仪,扫描参数:管电压120 kV,管电流100 mA,层厚、层间距均为5 mm,重建层厚1 mm;先行腹部平扫,然后采用双筒高压注射器自肘静脉注入非离子型碘对比剂碘海醇(350 mgI/ml)1.0~1.5 ml/kg,流速3~4 ml/s,分别于注射对比剂后25 s、60 s、5 min行皮髓质期、实质期及排泄期扫描。
采用Siemens Magnetom Trio Tim 3.0T超导型MR仪,体部相控阵线圈,检查前患者行屏气呼吸训练,扫描序列包括T1WI(TR 3.42 ms,TE 1.25 ms)、T2WI脂肪抑制(TR 3000 ms,TE 81 ms)、扩散加权成像(DWI,TR 1700 ms,TE 73 ms,b值取800 s/mm2)轴面成像;动态增强扫描采用三维容积式内插值法屏气检查序列(three-dimensional volumetric interpolated breath-hold examination, 3D-VIBE),层厚2.5 mm,层间距0.625 mm,TR 3.42 ms,TE 1.25 ms,屏气17 s;采用高压注射器注射对比剂钆喷替酸葡甲胺0.2 mmol/kg,流速2.5~3.2 ml/s,然后注入15~20 ml生理盐水,注射后25 s、60 s、5 min开始三期增强扫描。
1.3 图像分析 由2名经验丰富的主治医师采用双盲法对CT和MRI图像共同阅片,观察肿瘤的部位、大小、形态、边界,以及有无钙化、坏死与囊变、星状瘢痕、平扫及增强扫描各期强化情况、有无肾周组织侵犯及淋巴结转移,意见不同时协商达成一致。
1.4 病理检查 对切除的肿瘤组织进行大体、镜下病理检查和免疫组化检查,免疫组化检查指标包括低分子量角蛋白、CD10、钙黏附蛋白-E、上皮膜抗原、肾细胞癌、CD117、细胞角蛋白-7、波形蛋白、CK-19、CK-20、S-100、广谱细胞角蛋白、Ki-67。
2 结果
2.1 CT表现 8例患者行CT检查,其中3例平扫表现为均匀等密度灶;5例密度不均匀,其中4例病灶中央见星状低密度区(图1),1例于病灶中央见点状钙化(图2)。增强扫描后,皮髓质期病灶实质部分明显均匀强化,6例实质部分强化程度低于肾皮质,2例实质部分强化程度稍高于肾皮质。4例病灶在实质期进一步强化,但在排泄期密度开始下降,明显低于周围肾皮质(图1、2);4例病灶在实质期强化程度开始下降并最终低于肾髓质。4例病灶在皮髓质期中央出现星芒状低密度区并呈轻度延迟强化,低密度范围缩小(图1D)。5例有包膜显示。
2.2 MRI表现 5例病灶平扫T1WI呈等、低信号,4例中央可见星芒状更低信号;压脂T2WI呈以稍高信号为主的混杂信号,中央瘢痕呈星芒状高信号,DWI表现为混杂高信号(图3)。5例动态增强扫描呈明显不均匀强化,但病灶实质部分强化均匀,3例中央星状瘢痕表现为延迟强化(图3F),1例无强化。3例显示相对完整的包膜(图3D)。
2.3 病理检查结果 13例RO大体标本肉眼观呈类圆形或结节状,大小3.0 cm×3.0 cm×1.5 cm~8.0 cm×8.0 cm ×7.5 cm,切面呈灰黄色、灰红色或灰褐色,质地中等,肿瘤均位于皮质区,向肾轮廓外突出,与周围组织界限清楚,有相对完整的包膜。8例见中心或偏心的灰白色放射状瘢痕样区域(图1E),1例肿瘤体积较大、压迫肾盂,13例肿瘤均未侵犯肾盂及肾被膜,均未触及淋巴结,肾静脉无瘤栓形成。HE染色镜下见肿瘤细胞呈大小一致的圆形或卵圆形,排列成致密巢团状、片状和腺泡状,胞核小、圆形、居中,无明显异型性,未见核分裂象(图1F)。肿瘤细胞胞质丰富,呈明显嗜酸性。间质细胞稀少,呈疏松水肿样,可见黏液样变。免疫组化染色结果:13例低分子量角蛋白(+),10例CD10(+),5例钙黏附蛋白-E(+),3例上皮膜抗原(+),1例肾细胞癌(+),1例CD117(+),5例细胞角蛋白-7为小灶阳性,波形蛋白、CK-19、CK-20、S-100、广谱细胞角蛋白(-),Ki-67均<5%。
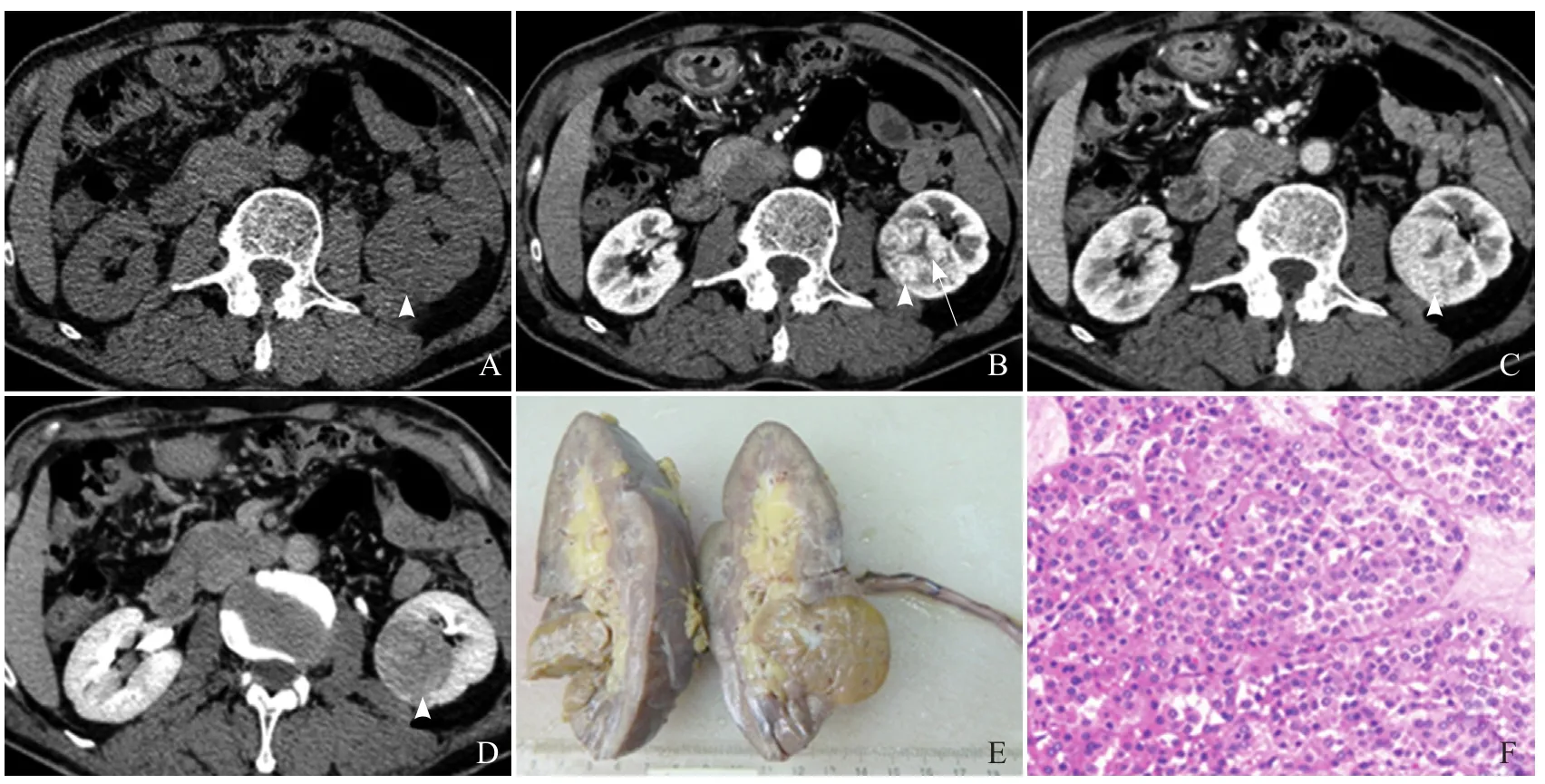
图1 男,71岁,左肾RO。CT平扫示左肾下极类圆形软组织密度肿块(箭头),密度较均匀(A);增强扫描皮髓质期示病灶(箭头)强化程度接近肾皮质,中央见星状无强化区(箭,B);实质期病灶(箭头)较前强化更加明显(C);排泄期病灶(箭头)密度下降,中央瘢痕区延迟强化,低密度范围变小(D);肾脏切除标本,肾下极可见一灰黄色肿物,大小3.8 cm×3.2 cm×3.0 cm,中央可见一灰白色放射状瘢痕样区域,大小1.2 cm×1.0 cm,质地中等(E);光镜下见细胞呈巢状分布,有纤细的纤维分隔,细胞胞质丰富,呈嗜酸性,细胞核呈空泡状,细胞温和,异型性不明显,未见病理核分裂象(HE, ×200, F)

图2 男,50岁,左肾RO。CT平扫示左肾上极类圆形软组织密度肿块(箭头),中央密度稍低并有点状钙化(箭,A);增强扫描示病灶(箭头)实质部分较均匀强化,囊变区无强化(B、C)
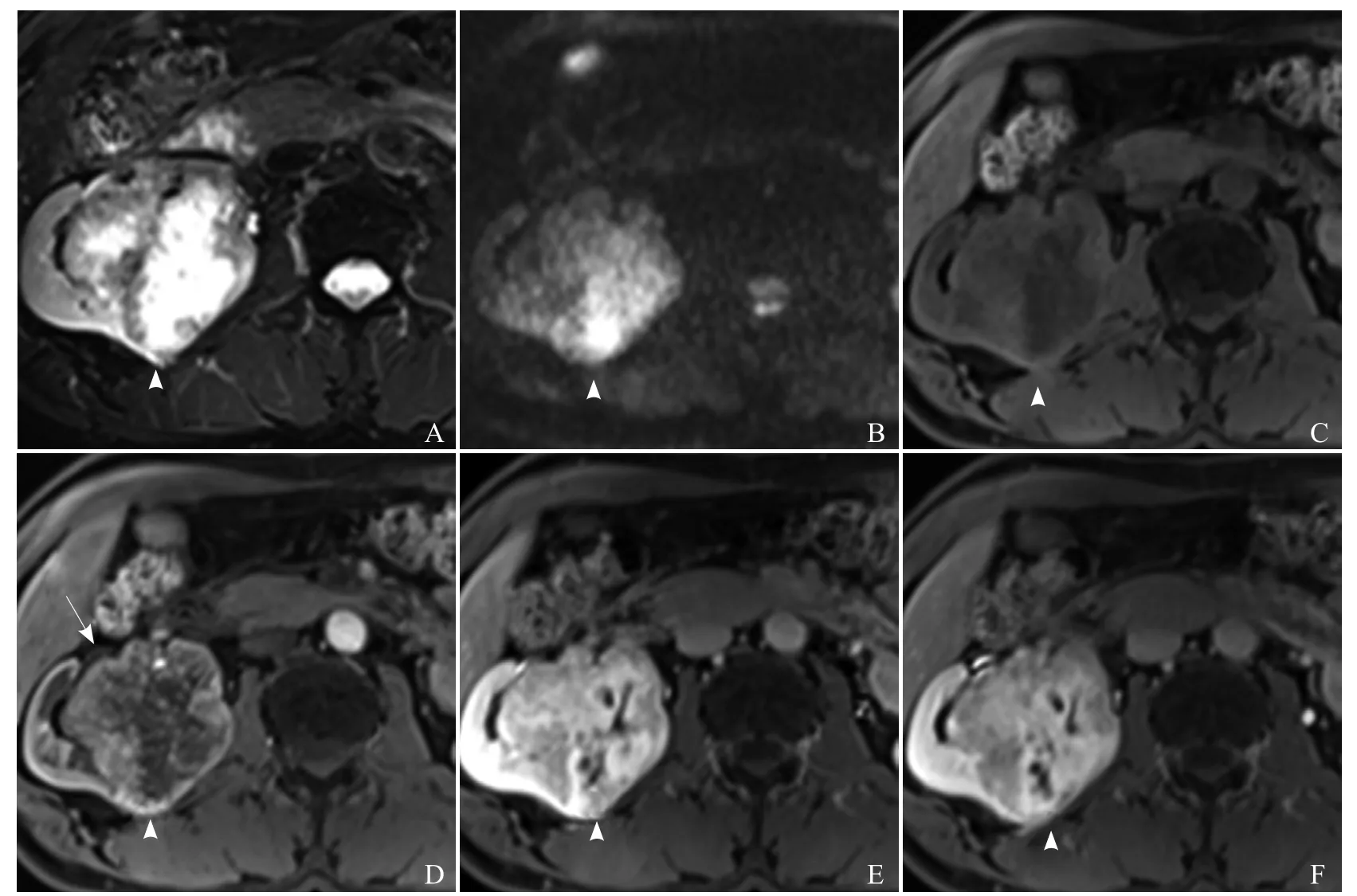
图3 男,60岁,右肾RO。脂肪抑制T2WI示右肾分叶状肿块(箭头),边界清晰,突出包膜,中央见星芒状高信号灶(A);DWI示病灶(箭头)呈稍高信号(B); T1WI示病灶(箭头)呈稍低信号,中央星芒状瘢痕呈低信号(C);增强扫描皮髓质期肿瘤(箭头)实质部分明显强化(D),实质期较前强化更加明显(E),排泄期信号下降(F);中央瘢痕延迟强化,低信号范围明显变小,并可见包膜显示(箭)
3 讨论
3.1 临床特点 RO是一种肾脏良性实质性肿瘤,最初由Zipple于1942年描述;1976年,Klein等[2]报道了13例RO并证实其起源于肾皮质近曲小管上皮细胞。本病好发于60岁以上人群,男性较女性多见[3],本组女性较男性稍多,可能与病例数较少有关。RO病灶多为单侧单发,双侧发生的病例约占4%~5%,13%为多发[4,5];少数可合并肾癌、血管平滑肌脂肪瘤等其他肿瘤。本组病例均为单发,均未合并其他肾脏肿瘤。大多数RO患者无临床症状,为体检时偶然发现,少数患者可以出现腰痛、肉眼血尿、腹部包块或高血压等症状。本病预后较好,随访均未见复发及转移,若能在术前明确诊断,倾向于采用肿瘤剜除术、肾部分切除术或射频消融术等,可以避免不必要的根治性肾切除[6]。
3.2 影像表现及其病理基础 因RO发病隐匿,影像学检查是主要诊断手段,其中MRI在诊断RO中有独特的价值[7]。本组病例的主要CT和MRI表现有以下特点:①肿瘤均位于肾皮质,向肾轮廓外突出,边缘清晰,病理证实肿瘤起源于肾皮质。CT平扫示较大肿瘤密度多不均匀,<3.0 cm者密度尚均匀,出血、囊变及坏死很少见。MRI平扫T1WI呈等、低信号,T2WI呈以稍高信号为主的混杂信号,DWI呈高信号。CT及MRI增强扫描皮髓质期肿瘤实质部分多呈明显均匀强化,强化程度多低于或稍高于正常肾皮质,强化峰值位于皮髓质期或实质期,至排泄期密度或信号明显减低,低于正常肾实质,但高于肌肉。张洁等[8]研究认为RO强化峰值位于肾皮髓质期,但本组病例中6例强化峰值位于实质期,此强化方式与肾细胞癌典型的“快进快出”强化方式明显不同,但是仅比较强化峰值无较大意义,因为临床所获得的图像有时并非真正意义的皮髓质期或实质期图像。②包膜:病理证实肿瘤有包膜存在,CT平扫呈等密度,多不易显示,MRI可以很好地显示呈低信号的包膜,增强扫描包膜多呈延迟强化。本组13例中有8例病灶可见包膜,多见于相对较大的肿瘤。③星状瘢痕:中央星芒状瘢痕是RO较为特征性的表现之一,但嫌色细胞癌及少部分透明细胞癌也可以出现此征象[9],瘢痕多为中心性,也可以为偏心性。瘢痕形成的原因主要是肿瘤生长较缓慢且长期缺血,故肿瘤越大则越容易显示此征象[10],病理检查证实瘢痕对应于组织学上所见的中央纤维带融合区和受压的血管[11]。Eiss等[12]认为直径>3.0 cm的RO,63%出现中央或偏心瘢痕;直径<3.0 cm的RO,其出现率为13%。本组13例患者中,8例显示星状瘢痕,2例直径<3.0 cm的病灶中央也可以见到灰白色瘢痕,与Eiss等[12]的研究结果一致。廖茜等[13]报道1例RO内见一钙化性单房囊肿,Syriac等[14]报道中央瘢痕可因退行性变而形成囊肿,呈单房或多房,本组1例表现为病灶中央的囊状改变。④节段性增强反转:Kim等[15]报道节段性增强反转为RO较为特征性的增强形式,其定义为肿瘤的不同节段在皮髓质期呈不同程度的增强,皮髓质期相对高增强的节段在排泄早期表现为较低强化,而相对低增强的节段在排泄早期则表现为较高的强化,98例经病理证实的直径<4 cm的肾肿瘤,10例RO中8例显示此征象,而88例肾癌中仅1例有此征象,故认为此征象可以用于鉴别较小的RO与肾癌。本组13例中均未观察到此征象,考虑与本组肿瘤较大、病例数较少有关。⑤钙化:相对少见,Perez-Ordonez等[5]和毕文杰等[10]发现RO中钙化出现率分别为31%(22/70)和33%(4/12),钙化可以位于肿瘤中央或周围,本组13例中仅1例显示点状钙化,且位于中央星状瘢痕内。若钙化发生在瘢痕的基础上,应首先考虑良性肿瘤;若钙化位于肿瘤实质区,应考虑恶性肿瘤[5]。
3.3 鉴别诊断 RO需与以下肿瘤鉴别:①肾透明细胞癌:瘤体密度或信号多不均匀,坏死、出血及囊变较常见,边缘多不清晰,且包膜多不完整;而RO密度或信号多较均匀,中央星状瘢痕较常见。肾透明细胞癌与RO均为富血供肿瘤,但两者的强化方式不同:肾癌多表现为“快进快出”,即皮髓质期明显不均匀强化,强化程度高于或接近肾皮质,实质期强化程度明显减退,低于周围的肾皮质,排泄期强化程度进一步减低。②肾嫌色细胞癌:为肾癌的一个少见亚型,恶性程度较低,与RO的临床特点、影像学特点及病理特征较相似,两者鉴别诊断困难[16]。CT或MRI平扫密度或信号多较均匀,坏死及囊变较少见,但其多呈乏血供,皮质期强化程度不如RO明显[17]。较大的嫌色细胞癌中央也可见星状瘢痕,但此征象较RO少见。③肾血管平滑肌脂肪瘤:是最常见的肾脏良性肿瘤,较为特征性的表现是瘤内含脂肪成分,较易鉴别,但对于肿瘤较小或乏脂肪的肾血管平滑肌脂肪瘤则较难鉴别。
总之,RO在CT和MRI表现上具有一定的特点,但仅凭影像学检查难以做出定性诊断,确诊有赖于病理检查。如果发现无临床症状的肾脏肿块,突出于肾轮廓之外,无钙化,无明显出血、坏死,增强扫描呈“快进慢出”表现,有典型的星状瘢痕及节段性增强反转等特征,应高度怀疑RO,结合术中冰冻活检确诊,可以避免不必要的根治性肾脏切除手术。
[1] Dechet CB, Bostwick DG, Blute ML, et al. Renal oncocytoma: multifocality, bilateralism, metachronous tumor development and coexistent renal cell carcinoma. J Urol, 1999, 162(1): 40-42.
[2] Klein MJ, Valensi QJ. Proximal tubular adenomas of kidney with so-called oncocytic features. A clinicopathologic study of 13 cases of a rarely reported neoplasm. Cancer, 1976, 38(2): 906-914.
[3] Kuroda N, Toi M, Hiroi M, et al. Review of renal oncocytoma with focus on clinical and pathobiological aspects. Histol Histopathol, 2003, 18(3): 935-942.
[4] Villanueva Peña A, Roca Edreira A, De Diego Rodríguez E, et al. Bilateral multiple renal oncocytoma. Case report and review of the literature. Prog Urol, 2007, 17(5): 997-999.
[5] Perez-Ordonez B, Hamed G, Campbell S, et al. Renal oncocytoma: a clinicopathologic study of 70 cases. Am J Surg Pathol, 1997, 21(8): 871-883.
[6] 王芳, 陆菁菁, 秦明伟, 等. 肾嗜酸细胞腺瘤的CT表现及病理基础. 实用放射学杂志, 2008, 24(9): 1230-1232.
[7] 王祖飞, 纪建松, 苏金亮, 等. 肾嗜酸细胞腺瘤CT及MRI表现. 放射学实践, 2011, 26(9): 974-977.
[8] 张洁, 马大庆, 贺文, 等. 肾脏嗜酸细胞腺瘤和肾癌的螺旋CT鉴别诊断. 中国医学影像技术, 2007, 23(5): 718-720.
[9] 史玉振, 童明敏, 田迎, 等. MSCT多期扫描对肾嗜酸细胞腺瘤与嫌色细胞癌的鉴别诊断价值. 临床放射学杂志, 2012, 31(4): 519-523.
[10] 毕文杰, 孙庆举, 李长勤, 等. 肾脏嗜酸细胞腺瘤的CT征象分析与鉴别诊断. 医学影像学杂志, 2007, 17(11): 1195-1198.
[11] Pedrosa I, Sun MR, Spencer M, et al. MR imaging of renal masses: correlation with findings at surgery and pathologic analysis. Radiographics, 2008, 28(4): 985-1003.
[12] Eiss D, Larousserie F, Mejean A, et al. Renal oncocytoma: CT diagnostic criteria revisited. J Radiol, 2005, 86(12 Pt 1): 1773-1782.
[13] 廖茜, 白人驹, 汪俊萍. 肾嗜酸细胞瘤的CT表现与病理对照分析. 中国医学影像学杂志, 2011, 19(4): 283-286.
[14] Syriac S, Wilfrido M, Frank C, et al. Cystic renal oncocytoma: a case report with review of the literature. N A J Med Sci, 2009, 2(3): 97-98.
[15] Kim JI, Cho JY, Moon KC, et al. Segmental enhancement inversion at biphasic multidetector CT: characteristic fnding of small renal oncocytoma. Radiology, 2009, 252(2): 441-448.
[16] 肖立, 陆孝禹, 陈忠伟, 等. 肾嫌色细胞癌和嗜酸细胞腺瘤的形态学、组织化学和免疫表型的比较研究. 临床与实验病理学杂志, 2005, 21(4): 422-426.
[17] 蔡瑞萍, 周东升. 肾嗜酸细胞腺瘤的CT表现与病理对照分析. 医学影像学杂志, 2012, 22(6): 963-965.
(责任编辑 张春辉)
CT and MRI Features of Renal Oncocytoma
PurposeTo investigate the imaging features of renal oncocytoma on CT and MRI, and to correlate with pathology.Materials and MethodsThe imaging and pathology of 13 pathology proven renal oncocytomas were retrospectively reviewed including 8 cases with CT and 5 with MRI to evaluate the location, size, morphology, border, calcifcation, necrosis and cystic degeneration, stellate scar, enhancement features in different phases, as well as perinephric invasion and lymph node metastasis.ResultsAll 13 cases were solitary, with 7 in the left kidney and 6 in the right kidney. The largest diameter was (4.4±1.7) cm. Three tumors were isotense on non-contrast CT. In corticomedullary phase, 8 cases showed apparent enhancement with 6 tumors less than renal cortex and 2 tumors slightly greater than renal cortex. In parenchymal phase, the enhancement decreased in 4 cases and was lower than renal medulla. Four tumors showed persistent enhancement with decreased attenuation in excretory phase. On MRI, all 5 tumors were iso- or hypointense on pre-contrast T1WI. On T2WI and DWI, the lesions were heterogeneously hyperintense. The enhancement pattern was similar to CT on dynamic contrast enhanced MRI. Stellate scar was seen in 8 tumors. Eight were capsulated. There was calcification in 1 tumor. The low molecular weight cytokeratin was positive in 13 cases, with CD10 positive in 10 cases, cadherin-E positive in 5, epithelial membrane antigen positive in 3 and cellular cytokeratin-7 positive in 5 cases.ConclusionRenal oncocytoma has characteristic imaging features, which are helpful in accurate diagnosis.
Kidney neoplasms; Adenoma, acidophil; Tomography, spiral computed; Magnetic resonance imaging; Pathology, surgical
1. 福建医科大学福总临床医学院(南京军区福州总医院)医学影像科 福建福州350025
2. 南京军区福州总医院医学影像科 福建福州 350025
陈自谦
Department of Medical Imaging, Fuzhou General Hospital of Nanjing Command, PLA, Fuzhou 350025, China
Address Correspondence to: CHEN Ziqian
E-mail: chenziqianfz@sina.com
R737.11;R445.2;R445.3
2013-09-24
修回日期:2014-02-15
中国医学影像学杂志
2014年 第22卷 第3期:199-203
Chinese Journal of Medical Imaging
2014 Volume 22(3): 199-203
10.3969/j.issn.1005-5185.2014.03.010

