HPLC-MS/MS同时检测乌龙茶中草铵膦、草甘膦和氨甲基膦酸残留
陈磊
HPLC-MS/MS同时检测乌龙茶中草铵膦、草甘膦和氨甲基膦酸残留
陈磊
(国家茶叶质量监督检验中心(福建),福建 安溪 362400)
建立了基于HPLC-MS/MS同时检测乌龙茶中草铵膦、草甘膦和氨甲基膦酸的分析方法,3种农药的检出限均为0.1 ng/mL,定量限为0.2~0.3 ng/mL,回收率在91 %~102 %之间,能够满足国家标准对乌龙茶中草铵膦和草甘膦(含氨甲基膦酸)限量的检测要求,并利用所建立的分析方法,对福建市场上的140个茶叶产品的上述农残进行检测,均未超过国家标准限量。
HPLC-MS/MS,乌龙茶,草铵膦,草甘膦,氨甲基膦酸
草甘膦(Glyphosate,简写PMG)和草铵膦(Glufosinate-ammonium,简写GLUF)是广谱非选择性除草剂,广泛用于控制一年生和多年生双子叶及禾本科杂草,它们的机制在于对植物中的酶抑制[1],能干扰植物中的氨基酸和其他化学成分的形成[2]。由于这2种除草剂在全球范围内的广泛使用,以及欧盟对其在水中残留的严格限定,检测其残留的精密方法是十分必要的。然而,因为其具有离子性、低挥发性、小分子量等特点,使得低于µg/L水平的检测较困难[3]。目前已报道的草铵膦、草甘膦以及代谢物氨甲基膦酸((Aminomethyl)phosphonic acid,简写AMPA)的分析方法,包括气相色谱[2]、液相色谱[4-5]、毛细管电泳、气质联用仪、液质联用仪[6-7]和毛细管电泳质谱[8]等方法,但从这3种化合物的物理、化学特性来看,比较适合的是基于液相分析的方法。但因为它们的分子量小、化学基团少和缺失发色团、紫外或荧光吸收等缘故,大多数的分析方法都需要采用衍生程序增强对分析物的分析。柱前和柱后衍生都有应用,柱前程序有与氯甲酸-9-芴基甲酯(FMOC-CL)衍生化形成荧光衍生物(提高检测)和/或减少极性的被分析物的色谱保留。在柱后的程序最常见的是与邻苯二甲醛(OPA)和巯基乙醇或OPA和N,N-二甲基-2-巯基乙胺反应[9]。
草甘膦和草铵膦虽然对人体健康不存在主要风险,但有证据表明其暴露在环境中,可引起人体神经系统疾病[10]。草甘膦广泛滥用给环境带来了许多污染问题,引起了人们对食品中草甘膦含量水平的关注[11]。有研究表明草铵膦对人类的生殖系统有毒性作用[12]。我国的国家标准中将对茶叶中的草甘膦和草铵膦最大残留限量值限定为 1 mg/kg、0.5 mg/kg,而目前尚没有检测草铵膦的国家标准方法。
本文研究建立了一种基于HPLC-MS/MS(高效液相色谱-三重四级杆串联质谱)结合固相萃取技术(SPE),同时测定乌龙茶中草铵膦、草甘膦和氨甲基膦酸(其分子结构见图1)的分析方法。并利用所建立的方法,检测了我国部分茶类中草铵膦、草甘膦(含氨甲基膦酸)的残留水平,评价茶叶中草铵膦、草甘膦的安全性,以期能更加准确地评价茶叶的消费安全。
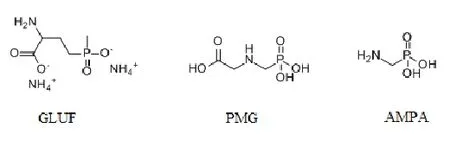
图1 草铵膦(GLUF)、草甘膦(PMG)和氨甲基膦酸(AMPA)分子结构图Fig. 1 Molecular structure of glufosinate (GLUF), glyphosate (PMG) and (aminomethyl) phosphonic acid (AMPA)
1 材料与方法
1.1仪器与试剂
Agilent 1290/6460 HPLC-MS/MS(配置Waters BEH C18 高效液相柱);水浴超声清洗器;涡旋混匀器;高效粉碎机;数字气浴振荡器;离心机;数显鼓风干燥箱;超纯水器。草铵膦和氨甲基膦酸标准品均为Dr. Ehrenstorfer(德国)公司生产;草甘膦标准品为农业部环境保护科研监测所生产。通过甲醇稀释/溶解以上标准物质,制备100 µg/mL储备标准溶液以及工作标准液,保存在-5 ℃,储备液保存期3个月,工作液保存期1个月。实验用水是Mili−Q水(18.2 MΩ/cm);色谱用的流动相试剂:乙酸铵(色谱级)、甲酸(色谱级)均为美国ROE公司生产,乙腈(色谱级)为美国TEDIA公司生产;四硼酸钠(分析纯);氯甲酸-9-芴基甲酯(FMOC-Cl,分析纯,纯度不低于99.0%)。
1.2样品前处理
称取2.5 g乌龙茶样品,放入50 mL具塞塑料离心管中,加50 mL水,充分振荡1 min,45℃水浴超声提取30 min,4000 r/min离心10 min,取上层澄清提取液5 mL,过C18-N小柱,弃去前2 mL流出液,收集后3 mL流出液。然后,吸取600 μL该流出液,加入200 μL 30 g/L硼酸钠溶液和200 μL 1.0g/L FMOC-Cl乙腈溶液,涡旋振荡1 min后,室温放置2 h衍生。最后,4000 r/min离心10 min,将上清液过0.45 μm有机相滤膜,滤液用于HPLC-MS/MS 检测。
1.3分析方法
液相色谱柱是Waters BEH C18 柱(2.1×100 mm,1.7 μm),柱温40℃,进样量5.0 μL,流动相流速0.3 mL/min;流动相A为0.01 mol/L 乙酸铵溶液(甲酸调节pH=4.0),流动相B为乙腈,梯度洗脱:0.0~4.0min:10%B(V/V)逐渐线性增至60%B,4.0~4.1 min:60%B逐渐线性增至80%B,4.1~6.0 min:保持80%B,6.0~6.1 min:80%B逐渐线性降至10%B,保持10%B驻留2 min。
质谱仪是ESI离子源,正离子扫描模式,多反应监测(MRM),脱溶剂气温度300 ℃;脱溶剂气流速 8 L/min,雾化气压力35 psi,鞘气温度350 ℃,鞘气流速12 L/min,毛细管电压4000 V。用于3种农药测定的参数见表1:
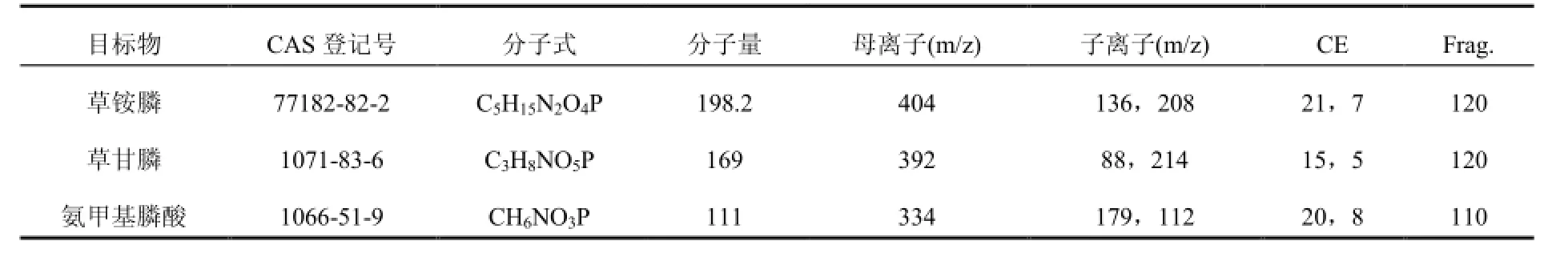
表1 草铵膦、草甘膦和氨甲基膦酸衍生后化合物在液质联用仪上的检测参数Table 1 Detection parameters of Glufosinate, glyphosate and (aminomethyl) phosphonic acid derivatives in HPLC-MS/MS
2 结果与讨论
2.1检测前处理优化
草铵膦、草甘膦和氨甲基膦酸均易溶于水,不易溶于有机溶剂,所以一般草甘膦和草铵膦农药被加工成水剂农药。有研究报道,选取水和丙酮作为提取试剂提取大豆、米和小麦等试样中的草铵膦、草甘膦和氨甲基膦酸,提取效果良好[2,8]。也有人利用硼酸盐溶液提取玉米中的草铵膦,回收率较好[13]。本文首先对提取溶剂进行优化,分别选取了水、水和丙酮混合溶剂、硼酸盐溶液和氢氧化钠溶液[14]作为提取试剂,结果发现含有丙酮的提取剂,提取出的色素较多,对净化提出了更高的要求;而硼酸盐和氢氧化钠溶液提取剂提取的溶液中,杂质较多,衍生后产生浑浊并出现较多沉淀。而水作为提取试剂时,提取液色素和杂质均较少,同时提取回收率在90%以上,而且操作简便、试验成本低。所以选择水作为提取溶剂。
对提取方式的优化比较了常温振荡提取、恒温振荡提取和水浴超声提取等,发现水浴超声提取的效果较好,而且温度较易控制。另外在提取时间上,超声提取30 min提取回收率已能满足实验要求,而恒温振荡提取需40 min以上,才能充分提取。从提高效率的角度,本文最终选择水浴45℃条件下的超声提取30 min。
经过上述超声提取后,提取液中含有少量的色素和多酚类物质,色素和多酚类物质对后面的衍生化反应有抑制作用,需净化处理。考虑到C18是强疏水性硅胶基质吸附剂,对非极性化合物具有强保留特性。本文尝试选用Cleanert C18-N SPE和Cleanert S C18 SPE小柱(过柱时小柱预先先用5 mL甲醇和5 mL水活化),移取5 mL提取液到预淋洗后的小柱中,弃去前面2 mL流出液,收集后面3 mL流出液[14-15],然后再取收集到的后面3 mL流出液用于衍生化反应。最后选取Cleanert C18-固相萃取小柱。
衍生化反应首先需保证反应完全,衍生化试剂氯甲酸-9-芴基甲酯需足量,但过量的氯甲酸-9-芴基甲酯会造成反应的溶液浑浊,不好过滤膜,对仪器也有一定的损伤。经过优化,移取净化后的溶液60 μL,分别加入200 μL 30 g/L硼酸钠溶液、200 μL 1. g/L氯甲酸-9-芴基甲酯乙腈溶液,室温下衍生反应至少2 h,衍生化反应充分。
2.2仪器条件的优化
本试验比较了两种C18液相色谱柱(Waters BEH C18,2.1×100mm,1.7μm和Agilent Zorbax SB-C18,2.1×150mm,3.5μm)的分离和峰型效果结果发现前者的峰型较干净、对称,分离效果也较好,所以选其作为高效液相的分离色谱柱。对色谱柱柱温,流动相的试剂、流量和梯度洗脱等均进行了优化,优化结果见1.3所述:
茶叶基质中草铵膦、草甘膦和氨甲基膦酸与氯甲酸-9-芴基甲酯衍生后,在质谱上正离子模式的响应值明显高于负离子模式。正离子模式条件下,草铵膦、草甘膦和氨甲基膦酸与氯甲酸-9-芴基甲酯衍生物在全扫描质谱后,得到的母离子[M + H]+,分别为m/z= 404、m/z =392和m/z= 334,定量和定性离子分别为(m/z= 136,208)、(m/z= 88,214)和(m/z= 179,112)。草铵膦、草甘膦和氨甲基膦酸与氯甲酸-9-芴基甲酯衍生化反应及其在质谱离子化后定量和定性离子碎片示意图如下图2所示。从图中也可以看出,本文所选取的定量离子的碎片,一般为分子量较小或稳定性强的;而所选取的定性离子的碎片,一般较易产生,敏感性强,更能代表该碎片形成的方式。
2.3标准曲线的优化
在上述最优条件下,草甘膦、氨甲基膦酸和草铵膦混合标准溶液和它们在乌龙茶基质中的总离子图(TIC)和提取离子的色谱图如下图3所示。
从图3可清楚地观察到3种农药在4.0 min内完全分离,没有任何干扰。为了获得校准曲线我们分析检测了一系列不同浓度的混合标准溶液1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10 ng/mL、20 ng/mL、和50 ng/mL),其线性方程、相对标准偏差及其检出限见下表2。
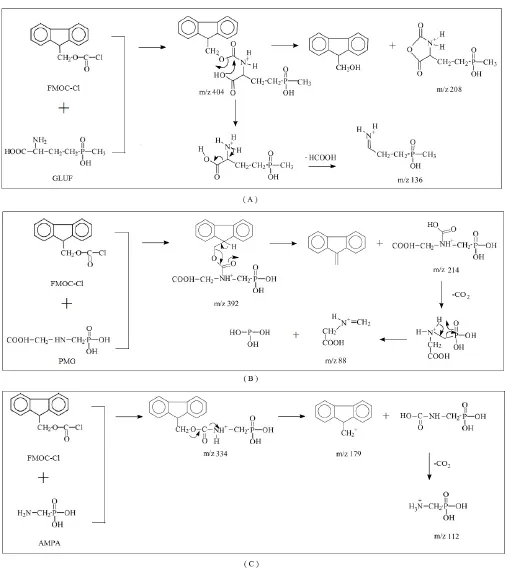
图2 FMOC-Cl衍生化后草铵膦、草甘膦和氨甲基膦酸在HPLC-MS/MS检测中的主要碎片离子A:草铵膦(GLUF);B:草甘膦(PMG); C:氨甲基膦酸(AMPA)Fig. 2 Major fragment ions in HPLC-MS/MS detection of glufosinate, glyphosate and (aminomethyl) phosphonic acid after derivatization with FMOC-Cl A: glufosinate (GLUF); B: glyphosate (PMG); C: (aminomethyl) phosphonic acid (AMPA)
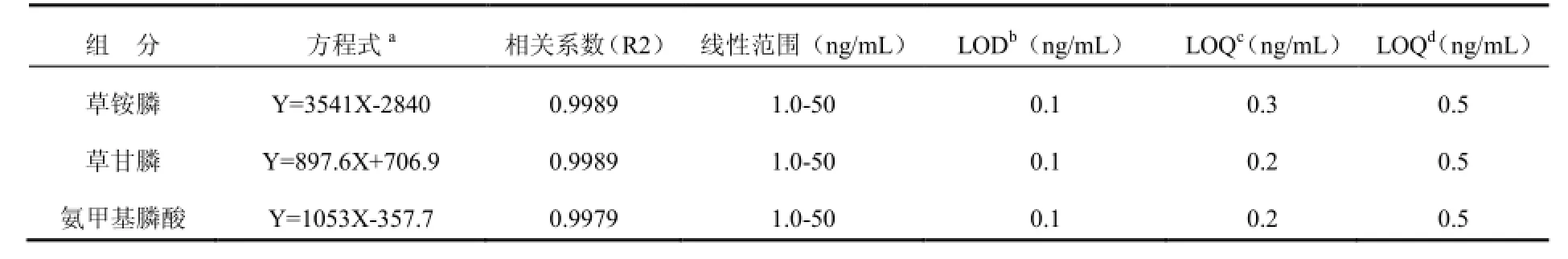
表2 液质联用仪检测草铵膦、草甘膦和氨甲基膦酸的标准曲线回归方程和方法检出限Table 2 Standard curve regression equation and detection limits of glufosinate, glyphosate and (aminomethyl) phosphonic acid in HPLC-MS/MS detection method
从表2中IUPAC(国际纯粹与应用化学联合会)方法检出限(LOD)和定量限(LOQ),分别以3.84和10倍空白溶液信号的标准偏差进行计算。EURACHEM(欧洲分析化学中心)方法LOQ,待测目标物信号的RSD%为10%时的浓度。如表2所示,这3种农药的IUPAC检出限均为0.1 ng/mL,定量限在0.2~0.3 ng/mL之间,EURACHEM定量限均为0.5 ng/mL。中国出入境检验检疫行业标准SN/T 1923-2007《进出口食品中草甘膦残留量的检测方法 液相色谱-质谱/质谱法》对茶叶中草甘膦(含氨甲基膦酸)的定量限为0.10 mg/kg,而本文方法对草铵膦、草甘膦和氨甲基膦酸3种农药残留的定量限均为0.02 mg/kg。
为了验证方法的可靠性,利用以上的检测方法对茶叶样品进行加标回收率实验,结果表明茶叶样品中3种农药残留的平均加标回收率为91 %~ 102 %,6次重复测定的日内和日间相对标准偏差分别在1 %~3 % 和3 %~6 %之间。
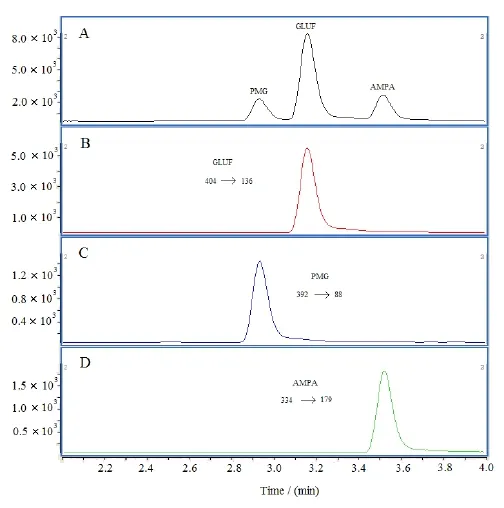
图3 分别为10 ng/mL草甘膦(PMG)、氨甲基膦酸(AMPA)和草铵膦(GLUF)标准溶液在乌龙茶基质中的总离子图和提取的各定量离子色谱图A:混合标液;B:草铵膦的定量离子色谱图;C:草甘膦的定量离子色谱图;D:氨甲基膦酸的定量离子色谱图。Fig. 3 TIC and extracted quantitative ion chromatogram of respectively 10 ng/mL of glyphosate (PMG), (aminomethyl) phosphonic acid (AMPA) and glufosinate (GLUF) standard solution in the tea matrix.A: mixed standard solution; B: GLUF quantitative ion chromatogram; C: PMG quantitative ion chromatogram; D: AMPA quantitative ion chromatogram.
2.4茶叶样品的检测结果
利用本文所建立的方法对福建省市场上的140个茶叶产品进行检测,其中乌龙茶128 份、绿茶4份、红茶3份、普洱茶3份和白茶2份。结果草铵膦残留均未检出,与林永辉等的检测研究相同,原因可能是草铵膦的价格较高,因此在国内茶叶种植中使用较少[14]。有35个茶叶样品有检出草甘膦(草甘膦和氨甲基膦酸残留量之和)。若将检测的草甘膦含量(X)大小分为四个区间:即X<LOD(检出限LOD为0.04 mg/kg),LOD<X<0.1,0.1≤X≤1.0,X>1.0。统计发现,X<LOD的样品有105个,LOD<X<0.1的样品有17个,0.1≤X≤1.0的样品有18个,没有X>1.0的样品。即140个茶叶样品中草甘膦均未超过国家标准GB 2763-2012中的限量值,所测茶叶样品中草甘膦含量的分布图如图4所示。但是抽样的乌龙茶、绿茶、红茶和普洱茶中均有检出草甘膦,只有白茶没有检出,说明草甘膦作为除草剂,在茶园中的施用较为普遍,未发现超标现象,但25%的检出率表明草甘膦类除草剂的施用应加以管控,防止草甘膦残留量增高,影响饮茶安全。
3 结论
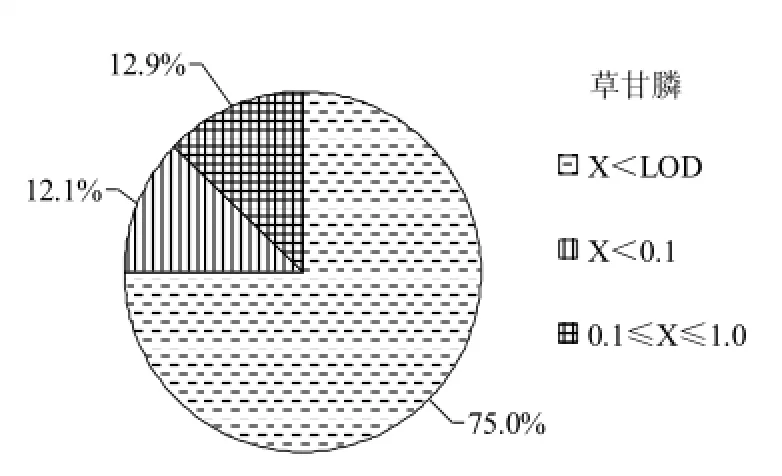
图4 茶叶样品中草甘膦残留量的分布图Fig. 4 Distribution map of glyphosate residues in tea samples
本研究建立了HPLC-MS/MS同时检测茶叶中草铵膦、草甘膦和氨甲基膦酸的分析方法,提取和前处理方法简单、快速,检测方法能够满足国家标准对乌龙茶中草铵膦和草甘膦限量的检测要求。利用所建立的方法,分析检测了采集福建省市场上的140个茶叶样品中的草铵膦、草甘膦和氨甲基膦酸残留情况,均未检出草铵膦残留,有35个样品检出含有草甘膦残留(包含氨甲基膦酸),但其含量均未超过国家标准限量值,但是25%的检测率也足以反映出草甘膦在茶叶种植过程中施用的普遍性,国家标准已规定其限量,茶叶在种植过程中应尽量减少草甘膦的使用。
[1] C. D. S. Tomlin. World Compendium-The Pesticide Manual,Thirteenth Edition[M], BCPC(British Crop Protection Council): Hampshire, UK. 2003.
[2] Tseng S H, Lo Y W, Chang P C, et al. Simultaneous Quantification of Glyphosate, Glufosinate, and Their Major Metabolites in Rice and Soybean Sprouts by Gas Chromatography with Pulsed Flame Photometric Detector[J]. J. Agric. Food Chemistry, 2004, 52: 4057-4063.
[3] Ibáñez M, Pozo Ó J, Sancho J V, et al. Residue determination of glyphosate, glufosinate and aminomethylphosphonic acid in water and soil samples by liquid chromatography coupled to electrospray tandem mass spectrometry[J]. Journal of Chromatography A, 2005, 1081: 145-155.
[4] Patsias J, Papadopoulou A, Papadopoulou-Mourkidou E. Automated trace level determination of glyphosate and aminomethyl phosphonic acid in water by on-line anion-exchange solid-phase extraction followed by cation-exchange liquid chromatography and post-column derivatization[J]. Journal of Chromatography A, 2001, 932: 83-90.
[5] Hori Y, Fujisawa M, Shimada K, et al. Quantitative determination of glufosinate in biological samples by liquid chromatography with ultraviolet detection after p-nitrobenzoyl derivatization[J]. Journal of Chromatography B, 2002, 767: 255-262.
[6] Ibáñez M, Pozo Ó J, Sancho J V, et al. Re-evaluation of glyphosate determination in water by liquid chromatography coupled to electrospray tandem mass spectrometry[J]. Journal of Chromatography A, 2006, 1134: 51-55.
[7] 李波,邓晓军,郭德华,等.高效液相色谱-串联质谱法检测食品中的草甘膦及其主要代谢产物氨甲基膦酸残留[J].色谱,2007,25(4):486-490.
[8] Goodwina L, Startinb J R, Keelya B J, et al. A nalysis of glyphosate and glufosinate by capillary electrophoresis–mass spectrometry utilising a sheathless microelectrospray interface[J]. Journal of Chromatography A, 2003, 1004: 107-119.
[9] Durán Merás I, Galeano Díaz T, Alexandre Franco M. Simultaneous fluorimetric determination of glyphosate and its metabolite, aminomethylphosphonic acid, in water, previous derivatization with NBD-Cl and by partial least squares calibration(PLS) [J]. Talanta, 2005, 65: 7-14.
[10] Grichar W J, Prostko E P. Effect of glyphosate and fungicide combinations on weed control in soybeans[J]. Crop Protection, 2009, 28: 619-622.
[11] Coutinho C F B, Coutinho L F M, Mazo L H, et al. Direct determination of glyphosate using hydrophilic interaction chromatography with coulometric detection at copper microelectrode [J]. Analytica Chimica Acta, 2007, 592: 30-35.
[12] Schulte-Hermann R, Wogan G N, Berry S C, et al. Analysis of reproductive toxicity and classification of glufosinate-ammonium[J]. Regulatory Toxicology and Pharmacology, 2006, 44: S1-S76.
[13] Qian K, He S, Tang T, et al. A rapid liqui chromatography method for determination o glufosinate residue in maize after derivatisatio [J]. Food Chemistry, 2011, 127:722-726.
[14] 林永辉,刘正才,杨方,等.柱前衍生化液相色谱-串联质谱法测定茶叶中草铵膦的残留量[J].色谱,2012, 30(12):1260-1264.
[15] 曹赵云,牟仁祥,陈铭学.液相色谱-串联质谱法测定稻米中的草甘膦和氨甲基膦酸残留[J].色谱,2010, 28(8):743-748.
Simultaneous Detection of Glufosinate, Glyphosate and (Aminomethyl)Phosphonic Acid in Oolong Tea by HPLC-MS/MS
CHEN Lei
(National Tea Quality Supervision and Inspection Center (Fujian),Anxi,Fujian 362400,China)
A method for simultaneous determination of glufosinate, glyphosate and (aminomethyl) phosphonic acid residues in Oolong tea by HPLC-MS/MS was described. The method has a LOD of 0.1 ng/mL, a LOQ of 0.2~0.3 ng/mL and a recovery of 91%~102%. The method can meet the national standard detecting requirements for the MRL of glufosinate and glyphosate(containing (aminomethyl) phosphonic acid) in Oolong tea. By using the proposed method, we had determined 140 tea samples collected from Fujian market, which indicated that all these samples conformed to the MRL of the national standard of above-mentioned pesticide residues.
HPLC-MS/MS, Oolong tea, glufosinate, glyphosate, (aminomethyl) phosphonic acid
陈磊(1981-),男,工程师,研究方向:食品安全与药物化学。Email: leon1981@126.com

