1-丁烯与H2S反应制备仲丁硫醇动力学研究
张斌浩,张泽凯,李林林,陈银飞
(浙江工业大学化学工程与材料学院催化反应工程研究所,浙江 杭州 310014)
仲丁硫醇是一种重要的化学中间体,广泛用于杀虫剂、制药和试剂分析[1]。随着制药工业的迅猛发展,对于仲丁硫醇的需求也越来越多,合成仲丁硫醇已经成为一个重要的研究课题,目前已经开发出几种不同的合成路线。
工业生产仲丁硫醇的主要方法有硫脲法和丁烯硫化法。目前主要采用硫脲法[3],该方法通常以溴代烷和硫脲为原料,在常压下经过加成、碱裂解、酸中和的反应步骤获得仲丁硫醇。该方法反应步骤较多,流程过长,环境污染严重,并且原料价格昂贵,不适宜规模化生产。丁烯硫化法合成仲丁硫醇的反应方程如式(1)。

该方法合成仲丁硫醇原子利用率为 100%,符合原子经济性原则[4],并且流程简单、可连续化生产、原料价格低廉、副产物少,是一条非常具有潜力的合成路线[5]。Elf Aquitaine等[6]采用阳离子交换树脂作为催化剂,在压力0.1 mPa、温度100 ℃、LHSV=0.5 h-1的条件下制备了仲丁硫醇,反应的转化率为20%,选择性约为70%。到目前为止,文献尚未报道一种有效的催化剂可以使反应达到较高的转化率。因此,开发一条合理的工艺流程路线,寻找一种高效的催化剂来制备仲丁硫醇具有广阔的市场发展潜力。
为了对反应过程有进一步了解并辅助催化剂体系的改进,对该反应的动力学研究是十分有必要的[7]。目前对于催化1-丁烯硫化制备仲丁硫醇的研究报道很少,其反应机理和动力学研究还未见报道。为了研究该反应本征动力学,探讨其反应机理,本文采用等体积浸渍法制备了P2O5-MoO3/Al2O3催化剂,在固定床微分反应器上进行 P2O5-MoO3/A l2O3催化剂催化1-丁烯硫化的数据采集,对所得数据进行拟合得到相关动力学特征和数据。
1 实验部分
1.1 催化剂的制备
实验采用购买的γ-A l2O3破碎成20~40目的小颗粒,500 ℃焙烧2 h后作为催化剂的载体。采用H3PO4、(NH4)6Mo7O24·4H2O作为活性组分的前体。等体积浸渍法浸渍H3PO4,110 ℃烘干,500 ℃焙烧 4 h,然后采用等体积浸渍法浸渍(NH4)6Mo7O24·4H2O,110 ℃烘干,500 ℃焙烧4 h冷却后即得到P2O5-MoO3/Al2O3催化剂。
1.2 动力学实验
1-丁烯的催化硫化反应在连续流动气固微分反应装置上进行,反应管为9 mm×450 mm的不锈钢管,等温区约长100 mm。催化剂的装填量为2 g,首先在反应器下端填装石英砂,然后装填用石英砂稀释过的催化剂,最后在催化剂上层装填石英砂,催化剂床层上下两端用石英棉隔离。使用质量流量计来控制气体的流量,反应压力和空速分别为 0.2 MPa和240 h-1。尾气采用日本岛津公司GC-2014气相色谱在线分析,Rtx○R-1填充柱,FID检测器。
2 结果与讨论
2.1 本征反应动力学
本征反应动力学研究是指在消除了传质、传热和催化剂失活对反应速率影响的实验条件下进行的反应动力学研究[8]。微分稳态反应动力学研究方法特征是反应转化率低,可以远离反应的热力学平衡区,同时可以避免由于高转化率造成的热效应对反应过程的影响,并且催化剂基本可以保持稳定的活性,能够体现催化剂较为真实的催化活性和反应过程,同时得到的反应数据容易处理[9]。
2.1.1 催化剂的稳定性
在动力学条件下考察了催化剂的稳定性,具体的实验结果如图1所示,给出了P2O5-MoO3/A l2O3床层上反应动力学考察的最低温度和最高温度下,转化率、选择性与反应时间的关系。结果发现,反应的转化率和选择性几乎不随反应时间的延长而发生变化,表明在此段时间内催化剂的动力学行为稳定。本文中的实验数据均是在小于8 h的范围内获得的。
2.1.2 外扩散影响的消除

图1 动力学条件下催化剂的稳定性
为了消除外扩散对反应速率的影响,在温度180 ℃和氮气条件下,改变气体流量(q,m L/min),测定不同接触时间m/q所对应的丁烯转化率,结果如图2所示。图2表明当接触时间在 0.375~20 m in·g/m L内变化时,随着接触时间的延长,反应的转化率不断增加,可以认为在此实验条件下,外扩散对反应速率的影响基本可以消除。

图2 转化率与接触时间的关系
2.1.3 内扩散影响的消除
为了消除内扩散对反应速率的影响,反应器内径至少应为催化剂粒径的5~8倍以上,反应器床层的高度为粒径的 30倍以上[10]。因此,在恒定接触时间、反应器内径为9 mm、床层高度5 cm、进料浓度50%、反应温度180 ℃的条件下,测定不同粒径所对应的丁烯转化率,结果见图3。图3表明,催化剂粒径在0.2~0.9 mm内变化时,丁烯转化率基本保持不变,内扩散影响消除。
2.1.4 排除传热的影响

图3 不同催化剂粒径下的1-丁烯转化率
1-丁烯催化硫化反应是放热反应,因此当反应转化率较高的情况下,反应过程中的热效应是不能忽视的。稳态微分反应器反应过程中应尽可能避免反应热对反应速度的影响[11]。所以要得到某温度下的反应动力学特征,必须尽可能降低反应过程中催化剂床层的温度变化。在原料气中加入一定量的N2,增大进料的气时空速,降低反应转化率,使反应产生的热量降低,减少反应热效应的影响。采用惰性的石英砂来稀释催化剂床层,避免反应过程中催化剂床层热效应的影响。反应过程中催化剂床层的温度波动不超过2 ℃,此时基本消除了反应的热效应对1-丁烯催化硫化反应的影响。

图4 1-丁烯和H2S反应机理
2.2 反应机理的探讨和动力学模型的建立
根据文献[12]对反应机理进行初步探讨。图4为1-丁烯和H2S的反应机理图。两种反应物同时在催化剂活性位上吸附,1-丁烯以C4H的形式存在,然后与吸附在催化剂表面的H2S结合形成带有质子氢的巯基中间体(b)或(h),然后此中间体失去巯基质子氢生成硫醇,最后从催化剂上脱附出来。
根据表征、实验结果及文献[4]报道,1-丁烯的催化硫化反应基本无其他副反应,此类反应多为不可逆反应,且非扩散控制的所有非均相反应中75%以上都是表面反应控制[13]。因此,假设表面反应为速率控制步骤,提出了3种P2O5-MoO3/Al2O3催化剂催化1-丁烯硫化反应机理,并推导了每种机理的反应速率方程。用下面的命名法表示反应的各种物质:A=1-丁烯,B=H2S,C=仲丁硫醇,*=催化剂的活性位。
(1)机理Ⅰ 1-丁烯在催化剂上吸附,H2S未在催化剂上吸附,如式(2)。
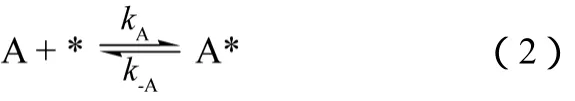
1-丁烯在催化剂表面的吸附,见式(3)。

表面反应生成吸附态的仲丁硫醇,如式(4)。

仲丁硫醇从表面脱附,式(2)~式(4)表示了所提出的反应机理。
推导这些步骤的速率方程时,将每步视为基元反应,气相中物质的浓度由各物质的分压代替。
1-丁烯的吸附速率表达式如式(5)。

表面反应的速率方程见式(6)。

仲丁硫醇的脱附速率如式(7)。
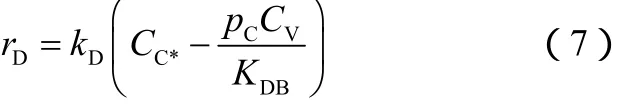
根据吸附速率方程,即式(2),表面反应为速率控制步骤时,kA较大,可得到被吸附的1-丁烯表面浓度,如式(8)。

将CA*和CC*代入式(6),得式(10)。

剩下需要消除的变量是CV,如式(11)。

代入被吸附物质的浓度CA*和CC*得式(12)。

将式(12)代入式(10)得式(13)。
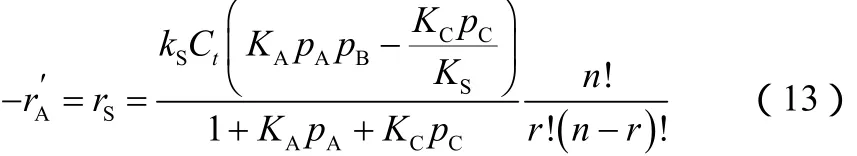
反应刚开始时,pC=0,因此速率方程简化为式(14)。

(2)机理Ⅱ 1-丁烯和 H2S在催化剂表面同时吸附动力学方程的推导过程与机理Ⅰ相似,最后可得到速率方程(15)。

反应刚开始时,pC=0,速率方程简化为式(16)。
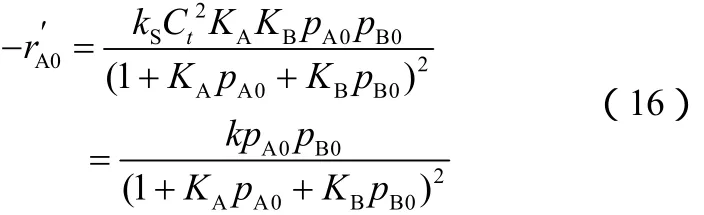
(3)机理Ⅲ H2S在催化剂上吸附,丁烯在催化剂上不吸附,动力学方程的推导过程与机理Ⅰ相似,最后可得到速率方程(17)。
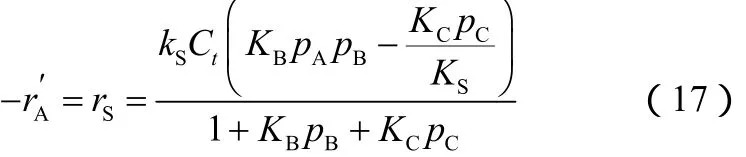
反应刚开始时,pC=0,速率方程简化为式(18)。

2.3 反应速率方程的确立
为保证实验在动力学区进行,控制接触时间m/q<20 m in·g/m L,催化剂颗粒粒径为0.45 mm,床层直径均为0.9 cm,床层高度为5 cm。在不同的反应浓度下测定了反应速率随原料浓度的变化曲线,实验结果如表1所示。根据得到的数据验证速率方程。
采用表1中的数据对3种机理推导出的速率方程进行验证,并拟合动力学参数,结果如表2所示。分析表2中的数据可知,机理Ⅱ推导出的动力学方程与实验数据最符合。而且方程中的各个参数的计算误差也是 最小的。因此,认为机理Ⅱ为1-丁烯的催化硫化反应机理的可能性更大。

表1 微分反应器数据
2.4 指前因子和反应活化能的计算
在气固两相催化反应体系中,温度对反应速率的影响在一定范围内服从阿伦尼乌斯方程[14]。本文作者测定了不同反应温度下的反应速率,计算了不同温度下的k值,数据如表3所示。根据阿伦尼乌斯方程,由ln k对1/T作图,如图5所示,由斜率求出表观活化能 Ea=60.78kJ/mol,由截距求出 k0= 3.3×109。

表3 不同反应温度下的动力学参数
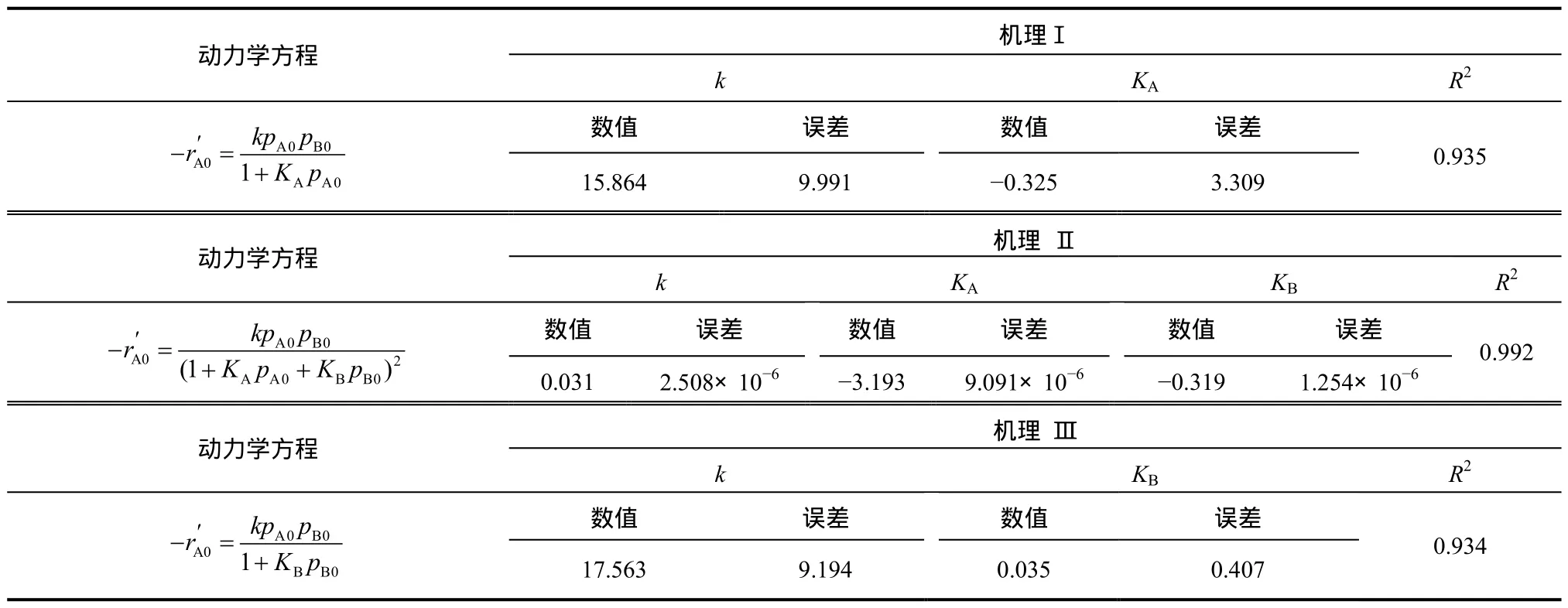
表2 动力学方程的拟合

图5 对数据进行线性回归
3 结 论
本文研究了P2O5-MoO3/Al2O3催化剂催化1-丁烯硫化制备仲丁硫醇反应动力学,探讨了可能的反应机理,提出了3种动力学模型,推导了各自的速率方程,并使用实验数据对速率方程进行验证。结果发现1-丁烯和H2S同时在催化剂上吸附的模型最符合实验结果,速率方程为:

实验结果和动力学研究表明,1-丁烯在P2O5-MoO3/Al2O3催化剂床层上的本征反应是一个双吸附表面控制的二级催化反应。根据实验数据拟合出动力学参数,其中指前因子 k0=3.3×109,活化能Ea=60.78 kJ/mol。
符 号 说 明
CA*——1-丁烯活性位浓度,mol/(gcat)
CB*——H2S活性位浓度,mol/(gcat)
CC*——仲丁硫醇活性位浓度,mol/(gcat)
Ct——总活性位浓度,mol/(gcat)
Cv——活性位空位的浓度,mol/(gcat)
Ea——反应活化能,kJ/mol
KA——吸附平衡常数,量纲为1
KDB——脱附平衡常数,量纲为1
KS——反应平衡常数,量纲为1
k0——指前因子,量纲为1
PA0——1-丁烯的初始分压,atm
pA——1-丁烯在气相中的分压,atm
PB0——H2S的初始分压,atm
pB——H2S在气相中的分压,atm
pC——仲丁硫醇在气相中的分压,atm
rAD——吸附速率,mol/(gcat·s)
rD——脱附速率,mol/(gcat·s)
rS——反应速率,mol/(gcat·s)
[1] 何磊.硫化氢下游产品开发与应用[J].化工中间体,2003,8(9):10-13.
[2] 高枫.硫醇的开发应用[J].精细化工原料及中间体,2003(12):27-28.
[3] 高潮,丛志远,樊学忠,等.仲丁硫醇的合成方法:中国,102417473 A[P].2012-04-18.
[4] 苏海兰.Co-Mo/γ-Al2O3在合成乙硫醇中的应用[J].世界科技研究与发展,2007,29(6):11-13.
[5] 徐琼,尹笃林.硫化氢加成直接合成硫醇的催化剂研究进展[J].精细化工中间体,2005,35(1):17-19.
[6] Frquy C,Arretz E,Elf Aquitaine.Heterogeneous Catalysis and Fine Chem icals[M].Amsterdam:Elsevier Science Publishers B V,1988:91-104.
[7] 秦高飞,周莹,蒋文伟,等.乙炔氢氯化均相催化反应动力学的初步研究[J].化工进展,2011,30(4):777-781.
[8] 陈诵英,陈平,李永旺,等.催化反应动力学[M].北京:化学工业出版社,2007:234-236.
[9] Cui Yuehua,Xu Hengyong,Ge Qingjie,et al.Kinetic study on the CH4/CO2reform ing reaction:Ni-H in Ni/α-Al2O3catalysts greatly improves the initial activity[J].Journal of Molecular Catalysis A:Chemical,2006,243:226-232.
[10] 张会平,彭冠兰,鄢英,等.CO在Cu-Mn催化剂上的催化氧化本征反应动力学[J].华南理工大学学报,2009,37(6):13-16.
[11] Wei J M,Iglesia E.Isotopic and kinetic assessment of the mechanism of reactions of CH4with CO2or H2O to form synthesis gas and carbonon nickel catalysts[J].Journal of Catalysis,2004,224(2):370-383.
[12] 唐津莲,许友好,徐莉,等.庚烯与H2S在酸性催化剂上的反应机理Ⅱ:噻吩类化合物生成机理[J].石油学报,2008,24(3):243-250.
[13] H.斯科特·福格勒.化学反应工程原理[M].第4版.北京:化学工业出版社,2011:684-686.
[14] 张海娟,连丕勇,高文艺,等.苯与长链烯烃在磷铝系催化剂上的烷基化反应动力学研究[J].精细石油化工进展,2002,3(6):12-18.

