新生小鼠海马神经元培养及形态学观察的优化方法*
常 翔,方淑环,张 玉,闫 蓉,屈 赵,侯雪芹,苏如玉,张 磊,杨 从,王 奇
(广州中医药大学临床药理研究所,广州510405)
海马在认知、学习和记忆等方面都扮演着极为重要的角色[1],是阿尔茨海默病(Alzhei mer′s disease,AD)的主要病变部位,利用海马神经元建立一个直观的体外研究的神经元活动的实验模型,对阿尔茨海默病等神经性疾病的研究有着极大的价值。关于神经突触的研究方面,树突棘的形态学观察具有很重要的价值,绿色荧光蛋白(green fluorescent protein,GFP)对神经元进行转染后能够清晰观察到单个神经元轴突、树突、树突棘等,但这一方法对神经元状态及转染效率的控制要求较高,而一般胎鼠海马神经元培养以及利用脂质体介导的转染较难达到这一要求。本文在文献基础上[2-7]进行改进优化,培养出具有良好形态的小鼠海马神经元,并用适当方法转染,得到单个神经元和树突棘形态特征清晰的显像,为神经突触研究提供基础,现将方法报道如下。
1 材料与方法
1.1 材料 新生小鼠(P0),由广州中医药大学实验动物中心提供;DMEM、F12、B27、HBSS、FBS、Neurobasal medium培养基、丙酮酸钠等均购自Gibico公司,多聚赖氨酸、DNAse购自Sig ma公司,24孔培养板(COSMO)由广州友田生物科技有限公司提供。
1.2 原代细胞培养
1.2.1 培养板的处理 24孔板中每孔加入30μg/mL的多聚赖氨350μL,37℃培养箱中过夜,灭菌水洗3次,晾干,封口胶封边,4℃保存。使用前于每孔中加入500μL的DMEM润洗,放入37℃培养箱中备用。
1.2.2 试剂配制 解剖液成分:HBSS 49 mL,1 M葡萄糖500μL,双抗(青霉素/链霉素)500μL,置于冰上备用。消化液成分:HBSS 2.5 mL,0.25%胰酶2.5 mL。重悬液成分:F12 2.5 mL,DMEM 2.5 mL,双抗2.5 mL,DNAse 5μL。培养液成分:神经干细胞培养基47.5 mL,丙酮酸钠500μL,双抗500 μL,L-谷氨酰胺500μL,B27 1 mL。消化液及培养液放入37℃水浴箱中预热。
1.2.3 培养方法 用70%乙醇消毒超净台及使用器械,超净台上铺手术巾,打开紫外灯照射40 min。打开解剖显微镜,取1个60 mm培养皿倒入解剖液,置于解剖显微镜下。取新生小鼠(P0)置于手术巾上,70%乙醇消毒,断头处死,剪开头皮及颅骨,取出全脑,放入解剖液中,于解剖显微镜下剔除脑膜和血管,剥离出海马组织,移入装有解剖液的15 mL离心管中置于冰上。以上解剖应在1 h内完成。用冰解剖液将海马洗3次,弃去解剖液,加入0.125%的低浓度胰酶于37℃水浴箱中消化20 min,其间每隔4~5 min充分晃动离心管以促进消化。消化结束后加入10%体积分数的胎牛血清终止消化。以2 000 r/min离心5 min后弃上清液,加入重悬液重悬细胞,用火焰抛光的巴斯德滴管吹打数次,充分分离神经元,用细胞筛过滤细胞至一新的离心管中,加入10%体积分数的胎牛血清后以2 000 r/min离心5 min,弃去上清液,加入培养液重悬细胞,充分吹打混匀,进行细胞计数,以每孔8×104个细胞接种于24孔板中,置于37℃细胞培养箱中培养。每隔3~4 d更换1/4培养基。选取不同时间点在倒置显微镜下观察并拍照。
1.3 GFP转染 GFP在细胞和分子生物学中通常被用来作为一个报告基团[8],在蓝光照射下可以发出明亮的绿色荧光。培养至第17天的细胞采用磷酸钙共沉淀法[9],配制CaCl2-DNA-磷酸缓冲液的复合物,进行GFP质粒DNA的转染,转染48 h后固定细胞,于荧光显微镜下进行形态学观察。
2 结 果
在倒置显微镜下观察,细胞接种后为透亮圆形较小的细胞,12 h后完全贴壁,长出短小的突起;3~4 d后突起逐渐增长增多,形成稀疏的网络,此时神经元胞体多为椭圆形或三角形;5~7 d神经元胞体逐渐增大,突起增粗,细胞间形成网络,细胞体核突起明显,立体感增强(图1)。第17天进行GFP转染,48 h后固定细胞于荧光显微镜下观察,胞体进一步增大,呈椭圆形,可以清楚观察到从胞体伸出的轴突和多条树突,树突棘明显(图2~4),为典型的海马神经元的结构特征。

图1 培养7 d的海马神经元细胞(普通光学显微镜×400)

图2 培养17 d转染GFP后的神经元细胞(荧光显微镜×400)
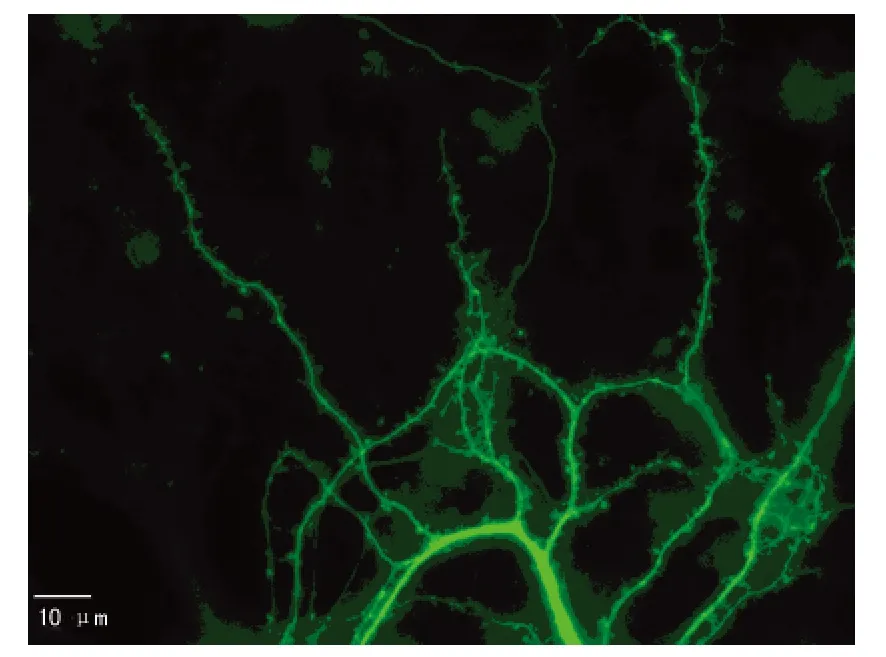
图3 培养17 d的海马神经元树突及树突棘明显增多(荧光显微镜×600)
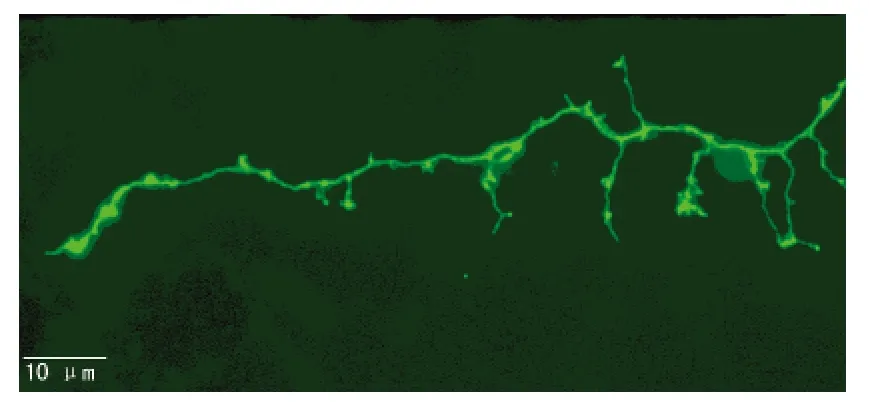
图4 转染GFP后的树突及树突棘(荧光显微镜×600)
3 讨 论
在阿尔茨海默病的研究中,神经元是研究的重要物质基础,神经突触是研究的重要方面。海马是神经元比较集中的组织,非神经元细胞在此处较少,故在进行神经元的原代培养时首选海马组织。传统方法多用胎鼠进行原代海马神经元的培养,但是胎鼠的胎龄不易掌握,海马剥离困难,且某些核团和功能区的解剖部位不易准确定位[10],而新生小鼠的海马易于剥离,且神经元分化程度较高,神经突起发育成熟,故新生鼠是更好的选择[11-12]。另外,在进行神经突触研究时,树突棘的形态学观察和计数是一个重要方面,因此,对于单个神经元的清晰显像就显得尤为重要,本实验所应用的磷酸钙共沉淀法转染GFP不失为一种理想的选择。
在海马神经元的培养中,对于实验条件的要求较为苛刻,因此,在实验中要尤其注意取材及组织消化过程、培养基成分、细胞接种数量等问题。首先,新生小鼠的海马外包裹有一层血管膜,在取材过程中一定要注意将这层血管膜清除干净,否则血管膜的一部分成纤维细胞会混入原代培养中,这些细胞会大量分裂,导致实验失败。其次,新生小鼠的神经元之间以及神经元与纤维组织之间结合比较紧密,消化分离的过程容易造成损伤,因此,消化分离过程中一般使用0.125%的低浓度胰酶,其间动作要轻柔,消化时间不宜过长,控制在20 min内,并轻柔均匀振摇分散组织,尽可能减少消化分离过程中造成的机械和化学损伤。第三,在神经元的培养中,培养基是实验成功的关键因素之一,在本实验中使用B27代替血清配置无血清培养基,相对于血清而言,B27成分清楚,含有多种细胞生长的必要因子,是较为理想的添加剂。采用B27无血清培养基可以选择性地使神经元生长,而抑制非神经元细胞的生长和增殖[13],能够起到纯化神经元的作用。此外,该培养基含有多种抗氧化剂,能够保持神经元的活性[14]。最后,种板密度也是实验中重要一环,在神经突触研究中对树突棘的形态学观察常需要以单个神经元作为观察对象,故种板密度不宜过高,当然,种板密度过低,神经元不能相互接触,也会导致神经元难以存活或者成熟。因此,通常需要在预实验中接种不同密度细胞观察获得合适的细胞密度。另外,在本实验中未应用阿糖胞苷等抑制细胞有丝分裂的药物来抑制胶质细胞的生长,因阿糖胞苷的用量较难控制,剂量过小则不能起到抑制胶质细胞增殖的作用,而剂量过大会对神经元产生毒性作用,影响神经元活性[15]。
在本实验中应用的GFP是一种不需要任何外源反应底物,只需要蓝光照射就可以发出荧光的一种蛋白,常被用来进行活细胞标记。由于GFP对神经元仅有极小的毒性作用,因此,在神经生物学研究中常被用来作为报告基团[16]。本实验用e GFP质粒转染培养17~19 d的小鼠海马神经元细胞,采用了传统的磷酸钙共沉淀法进行转染,相较于常用的脂质体介导的转染,前者更适合于做神经元细胞爬片的转染[7],并且磷酸钙共沉淀法转染效率较低,对于以单个神经元为观察对象的神经突触的形态学方面的研究,该方法显得更为优越。本实验中,转染48 h后在荧光显微镜下进行形态学观察,结果显示神经元胞体饱满、细胞突起丰富,神经元细胞处于最佳状态,轴突、树突及树突棘显像清晰。磷酸钙共沉淀法对小鼠海马神经元进行GFP转染效果良好。
综上所述,在阿尔茨海默病的研究中,选用最优化的方法培养海马神经元细胞是研究的基础,而用GFP标记单个神经元在神经突触的形态学[9]及电生理[17]等研究中都极为重要。本文中所采用的神经元培养方法及GFP转染方法具有极大优越性,可进行推广使用。
[1]Frey U,Huang YY,Kandel ER.Effects of c AMP simulate a late stage of LTP in hippocampal CA1 neurons[J].Science,1993,260(11):1661-1664.
[2]Beaudoin GM,Lee SH,Singh D,et al.Culturing pyramidalneurons from the early postnatal mouse hippocampus andcortex[J].Nat Protoc,2012,7(9):1741-1754.
[3]Wesley CC,David WS.Novel high-resolution micropatterningfor neuron culture using polylysine adsorption on a cell repellant,plasma-polymerized background[J].Langmuir,2008,24(22):13048-13057.
[4]Yu Z,Liu J,Guo S,et al.Neuroglobin-overexpression alters hypoxic response gene expression in primary neuronculture following oxygen glucose deprivation[J].Neuro-science,2009,162(2):396-403.
[5]Paul D,Saias L,Pedinoti JC,et al.A“dry and wet hybrid”lithography technique for multilevel replication templates:aplications to microfluidic neuron culture and two-phaseglobal mixing[J].Biomicrofluidics,2011,5(2):24102.
[6]徐祖才,刘华,李雨芹,等.新生大鼠海马神经元癫痫样放电模型的初步研究[J].重庆医科大学学报,2008,33(6):696-699.
[7]Matus A,Biou V,Brinkhaus H,et al.Transfecting CulturedHippocampal Neurons with an Actin-GFP Plasmid[J].CSHProtoc,2007:pdb.prot4664.doi:10.1101/pdb.prot4664.
[8]Phillips GJ.Gene fluorescent protein-a bright idea for thestudy of bacterial protein localization[J].FEMS MicrobiolLett,2001,204(1):9-18.
[9]Calabrese B,Shaked GM,Tabarean IV,et al.Rapid,con-current alterations in pre-and postsynaptic structure in-duced by soluble natural amyloid-βprotein[J].Mol CellNeurosci,2007,35(2):183-193.
[10]Chang H,Lin H,Yi L,et al.3,6-Dihydroxyflavone in-duces apoptosis in leukemia HL-60 cell via reactive oxygen species-mediated p38 MAPK/JNK pathway[J].Eur JPharmacol,2010,648(1):31-38.
[11]陈香青,黄爱军,路长林,等.CNTF对烧伤大鼠血清引起大鼠海马神经元细胞毒性的影响[J].细胞生物学杂志,2000,22(1):43-47.
[12]杨燕玲,郭勇.适用于电生理研究的新生大鼠神经细胞简易培养方法[J].神经科学进展,1998,4(3):272-275.
[13]Brever GJ,Torricelli JR,Evege EK,et al.Optimized survival of hippocampal neurons in B27-supplemented neuro-basal,a new serum-free medium combination[J].NeurosciRes,1993,35(5):567-576.
[14]Lesuise C,Martin LJ.Long-term culture of mouse corticalneurons as a model for neuronal development,aging,anddeath[J].J Neurobiol,2002,51(1):9-23.
[15]王英,车宇,苗建亭,等.新生大鼠海马神经元原代培养方法的研究[J].细胞与分子免疫学杂志,2003,19(2):197-199.
[16]Aoshima Y,Hokama R,Sou K,et al.Cationic amino acidbased lipids as effective nonviral gene delivery vectors forprimary cultured neurons[J].ACS Chem Neurosci,2013,4(12):1514-1519.
[15]王英,车宇,苗建亭,等.新生大鼠海马神经元原代培养方法的研究[J].细胞与分子免疫学杂志,2003,19(2):197-199.
[17]Watanabe SY,Albsoul-Younes AM,Kawano T,et al.Calcium phosphate-mediated transfection of primary culturedbrain neurons using GFP expression as a marker:application for single neuron electrophysiology[J].NeurosciRes,1999,33(1):71-78.

