si RNA沉默ST MN1对食管癌Eca-109细胞紫杉醇敏感性的影响*
朱鸿武,江 丹,谢子英,周梅花,孙大勇,赵亚刚
(广州军区广州总医院消化内科,广州510010)
食管癌是最为常见的肿瘤之一,在世界肿瘤疾病导致的死亡原因中位居第六[1]。中国是食管癌死亡率最高的国家之一,食管癌在中国癌症所致的死亡原因中位居第四[2]。有研究报道,食管癌患者即使在严格的病例选择和术前予以新辅助化疗,联合手术根除性治疗后预后仍较差,5年存活率仅在20%左右[3]。因此,提高食管癌放化疗有效性、通过多模态治疗提高患者生存期和改善生存质量成为近年食管癌的研究热点。导致化疗失败的一个最主要的原因就是食管癌细胞对化疗药物的原发性或继发性耐药。但是,目前食管癌的耐药机制尚不清楚。因此,进一步研究并阐明食管癌的耐药机制有助于为临床提高食管癌患者的治疗预后提供重要的理论依据。
紫杉醇是从美国短叶红豆杉的树皮中提取而来的一种物质,因其可以促进微管聚合,抑制微管降解,使细胞分裂周期阻滞在G2/M期,最终导致肿瘤细胞凋亡,因而具有很强的抗肿瘤作用,目前已被应用于包括食管癌在内的多种肿瘤化疗之中[4]。但是,随着临床应用的增多,对紫杉醇耐药的现象也在逐渐增多[4]。ST MN1是一种能够在细胞的有丝分裂期和分裂间期改变微管动力学的微管脱稳定化磷蛋白[5],在许多人类癌组织中表达增加,参与了细胞增殖、细胞运动、微管动力学调节和周期调节等功能[5]。近年来,有报道称ST MN1在乳腺癌和骨肉瘤对紫杉醇的耐药中发挥了关键的作用[6-8],提示STMN1也是一个耐药相关基因。ST MN1是否在食管癌对紫杉醇的耐药中具有促进作用呢?目前尚无研究报道。本研究使用小干扰RNA(si RNA)在食管癌Eca-109细胞中沉默STMN1的表达,进而通过药敏和凋亡等实验观察干预前、后食管癌细胞对紫杉醇的敏感性变化,初步探索沉默ST MN1对食管癌细胞紫杉醇敏感性的影响。
1 材料与方法
1.1 材料 人食管癌Eca-109细胞购自中科院上海细胞库;Trizol、LipofectamineTM2000和Opti-MEM®I购自Invertrogen公司;RIPA裂解液、5 X蛋白上样缓冲液、十二烷基磺酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)凝胶配制试剂盒、PMSF、丽春红染色液、MTT和结晶紫购自碧云天生物技术研究所;NC膜和ECL购自Millipore公司;RPMI-1640培养基和Hyclone胎牛血清购自Hyclone公司;紫杉醇购自美国施贵宝公司;Hoechst染色试剂盒购自碧云天生物技术研究所;STMN1 si RNA和scramble si RNA购自上海吉玛制药公司;逆转录试剂盒和实时定量PCR试剂盒购自宝生物(大连)公司。anti-ST MN1一抗(#3352)购自Cell Signaling公司;anti-β-actin一抗(sc-47778)购自Santa Cruz Biotechnology公司;辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠二抗购自中杉金桥公司。
1.2 实验方法
1.2.1 细胞培养 Eca-109细胞所用培养液为添加有10%胎牛血清的RPMI-1640培养基,除用于瞬时转染的细胞在实验前1周开始不使用抗菌药物以外,所有培养液中已加入青霉素/链霉素。细胞培养于含5%CO2的37℃恒温培养箱内。所有用于实验的细胞均处于对数生长期。所有实验均重复3次。
1.2.2 相关引物序列和q PCR 使用pub med BLAST工具和查阅文献设计并合成相应的引物,ST MN1上游引物:5′-TAC ACT GCC TGT CGC TTG TC-3′,下 游 引 物:5′-GGG GAA AGG GGG AAT TCT GG-3′;GAPDH[9]:上 游 引 物5′-CGG AGT CAA CGG ATT TGG TCG TAT-3′,下游引物:5′-AGC CTT CTC CAT GGT GGT GAA GAC-3′。采用Trizol氯仿法提取RNA,按照逆转录试剂盒说明书配制反应体系并进行逆转录反应,按照实时定量PCR试剂盒说明书配制反应体系并进行实时定量PCR反应。
1.2.3 相关si RNA序列及转染实验 根据文献[7]合成STMN1 si RNA,正义链:5′-GAA ACG AGA GCA CGA GAA A-3′,反 义 链:5′-UUU CUC GUG CUC UCG UUU C-3′;无 关si RNA,正义链:5′-GCA AAA GAG CGA AAA G-3′,反义链:5′-CUU UUC GCU CUU UUG C-3′。按LipofectamineTM2000说明书进行瞬时转染步骤,转染6 h以后更换培养液,72 h以后收取细胞进行相应的实验。
1.2.4 Wester n blot实验 胰酶消化并收集细胞,裂解液裂解并提取总蛋白,测定蛋白浓度,SDS-PAGE电泳,转膜并进行裁剪,用含5%脱脂牛奶的PBST封闭,一抗4℃孵育过夜;洗膜,二抗室温孵育1 h;洗膜后加ECL溶液显影观察。
1.2.5 MTT药敏实验 胰酶消化收集细胞,按5×103/孔的密度接种于96孔培养板中,每孔培养液200μL,待细胞贴壁16 h;加入适当浓度梯度的紫杉醇进行体外药物敏感性检测,同时设置调零孔、对照孔,培养板置于培养箱中继续孵育72 h;72 h以后先后加入MTT溶液和二甲基亚砜(DMSO),用酶标仪检测吸光度并进行分析。
1.2.6 平板克隆形成实验 胰酶消化收集细胞,按1×103/孔的密度接种于24孔培养板中,待细胞贴壁16 h后;加入0.04μmol/L的紫杉醇进行体外药物敏感性检测,每3 d更换培养液1次,共计培养14 d;14 d后,弃培养液,清洗、固定,0.5%结晶紫染色,数码相机拍照后用Photoshop CS3软件进行统计分析。
1.2.7 Hoechst 33258核染色实验 胰酶消化收集细胞,按1×106/孔的密度接种于6孔板,待细胞贴壁16 h;加入0.1 μmol/L的紫杉醇,培养板置于培养箱中继续孵育36 h诱导凋亡;36 h以后,按Hoechst试剂盒说明书染色、封片,用荧光显微镜观察并拍照。
1.3 统计学处理 采用SPSS16.0统计软件对实验数据进行分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 转染ST MN1 si RNA前、后Eca-109细胞ST MN1表达水平的变化 q PCR和Wester n blot检测结果提示,转染STMN1 si RNA 72 h以后,食管癌Eca-109细胞中的ST MN1的mRNA表达水平(图1)和蛋白水平(图2)均明显下降。
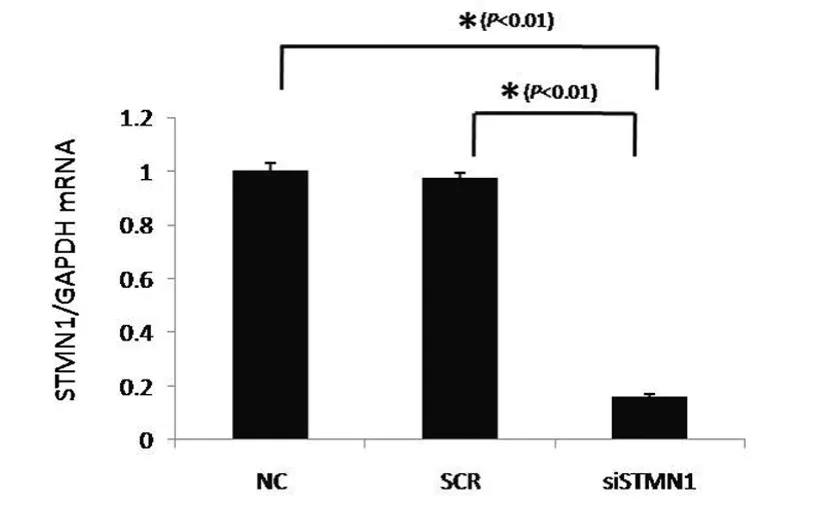
图1 转染si RNA前、后食管癌Eca-109细胞中ST MN1 mRNA的表达变化(GAPDH作为内参基因)
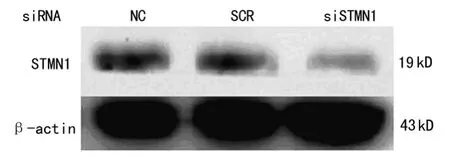
图2 转染si RNA前、后食管癌Eca-109细胞中ST MN1蛋白的表达变化(β-actin作为内参)
2.2 MTT药敏实验结果提示沉默ST MN1可增加紫杉醇对Eca-109细胞的抑制率 MTT药敏实验结果显示,采用特异性si RNA沉默ST MN1的表达后,食管癌Eca-109细胞相对于非特异si RNA转染组的细胞,对紫杉醇的IC50值明显下降(P<0.01),提示对药物敏感性增加(图3)。
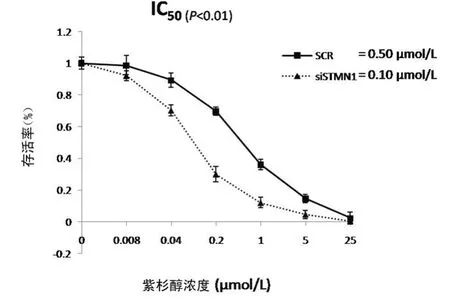
图3 沉默ST MN1后Eca-109细胞对紫杉醇的敏感性
2.3 平板克隆形成实验结果提示沉默ST MN1可增加Eca-109细胞对紫杉醇的敏感性 平板克隆形成实验结果显示,采用特异性si RNA沉默ST MN1的表达后,食管癌Eca-109细胞在0.04μmol/L紫杉醇的作用下平板克隆数目与非特异si RNA转染组比较有明显减少,见图4。
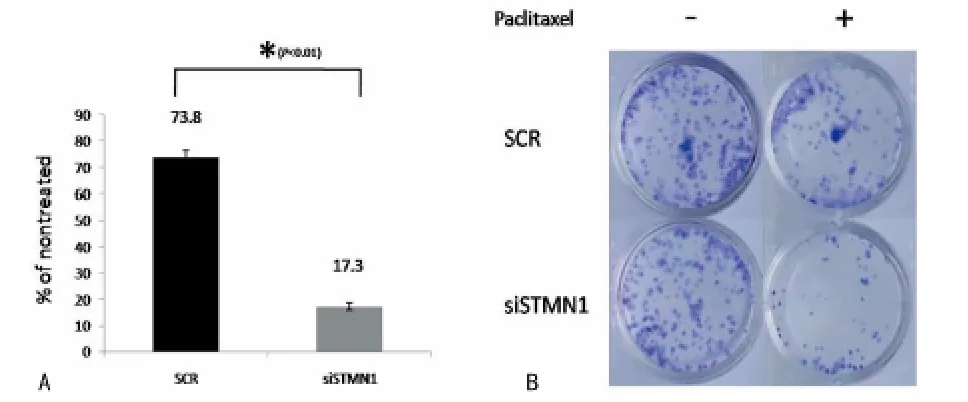
图4 沉默ST MN1后食管癌Eca-109细胞紫杉醇作用下克隆形成数目
2.4 沉默ST MN1后Eca-109在紫杉醇作用下凋亡增加 与空白对照组和无关si RNA转染组相比,转染了ST MN1特异性si RNA的Eca-109细胞在0.1μmol/L紫杉醇作用36 h以后,Hoechst 33258染料核染色显示核浓染和碎裂的细胞明显增多(图5),提示凋亡细胞数目增加。
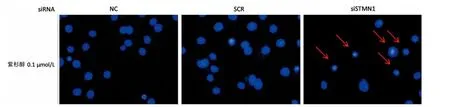
图5 沉默ST MN1后食管癌Eca-109细胞在紫杉醇作用下凋亡增加(×400)
3 讨 论
紫杉醇为紫杉烷类代表性的一种物质,目前已被广泛应用于食管癌等多种恶性肿瘤的化疗方案之中[4,10]。但是,紫杉醇也具有较强的不良反应,如过敏反应、脱发、骨髓抑制和周围神经病等[11],一定程度上影响了该药的使用。近年来,紫杉醇在肿瘤治疗中的原发性和继发性耐药问题逐渐受到重视。如何降低紫杉醇耐药的发生,甚至在降低该药的使用浓度亦能同样达到有效杀伤肿瘤细胞的作用,对临床食管癌患者的治疗具有重要的意义。
ST MN1也被称作stathmin 1、肿瘤蛋白18、metablasin、p18或p19,它由位于人染色体1p36.1的ST MN1基因编码,是一种能够在细胞有丝分裂期和分裂间期改变微管动力学的微管脱稳定化磷蛋白[5]。ST MN1在细胞正常生理中参与了有丝分裂中微管的调节,但是,在肿瘤细胞中常常发生因为ST MN1失调而导致有丝分裂纺锤体功能减退和导致对紫杉醇的耐药[12]。近年来亦有研究报道ST MN1可促进乳腺癌和骨肉瘤对紫杉醇的耐药[6-8]。因此,推测ST MN1很可能也参与了食管癌细胞对紫杉醇的耐药。
本研究通过脂质体转染法将ST MN1 si RNA瞬时转染入食管癌Eca-109细胞中,q PCR和Wester n blot提示基因干扰效果确切,转染后ST MN1无论是mRNA水平还是蛋白水平均有明显下降。进一步在细胞药敏实验中发现,沉默ST MN1的表达后食管癌Eca-109细胞对紫杉醇的化疗敏感性明显增强。由此推测,在有效沉默ST MN1的表达后,即使降低紫杉醇的药物浓度亦可以同样有效地杀伤食管肿瘤细胞,因此有助于临床中降低化疗药物用量,减少不良反应的发生和提高治疗有效性。在细胞凋亡实验的检测中,发现沉默ST MN1的表达后,食管癌Eca-109细胞在紫杉醇作用下凋亡也明显增加,提示ST MN1导致的耐药机制之一可能为减少食管癌细胞在紫杉醇作用下的凋亡。
综上所述,ST MN1在食管癌对紫杉醇的化疗敏感性中发挥了关键的作用,通过si RNA有效沉默ST MN1的表达有助于增强食管癌对紫杉醇化疗的敏感性并导致食管癌细胞化疗下凋亡的增加。本研究结果有助于进一步阐明食管癌对紫杉醇耐药的机制,亦可能有助于为临床中减少紫杉醇类药物不良反应和降低化疗耐药的发生提供理论依据。
[1]Schweigert M,Dubecz A,Stein HJ.Oesophageal cancer--an overview[J].Nat Rev Gastroenterol Hepatol,2013,10(4):230-244.
[2]钟钏,谭家驹,徐致祥.食管癌流行病学病因学研究进展[J].河南预防医学杂志,2011,22(1):1-10,17.
[3]Crosby T,Evans M,Gillies RS,et al.The management ofa patient with an operable carcinoma of the oesophagus[J].Ann R Coll Surg Engl,2009,91(5):366-370.
[4]Yared JA,Tkaczuk KH.Update on taxane development:new analogs and new formulations[J].Drug Des Devel Ther,2012,6:371-384.
[5]Rubin CI,Atweh GF.The role of stathmin in the regulation of the cell cycle[J].J Cell Biochem,2004,93(2):242-250.
[6]Carr JR,Park HJ,Wang Z,et al.Foxm1 mediates resistance to herceptin and paclitaxel[J].Cancer Res,2010,70(12):5054-5063.
[7]Wang R,Dong K,Lin F,et al.Inhibiting proliferation andenhancing chemosensitivity to taxanes in osteosarcomacells by RNA interference-mediated downregulation ofstathmin expression[J].Mol Med,2007,13(11/12):567-575.
[8]Alli E,Bash-Babula J,Yang JM,et al.Effect of stathminon the sensitivity to antimicrotubule drugs in humanbreast cancer[J].Cancer Res,2002,62(23):6864-6869.
[9]Ford J,Jiang M,Milner J.Cancer-specific functions ofsirt1 enable human epithelial cancer cell growth and survival[J].Cancer Res,2005,65(22):10457-10463.
[10]Jordan MA.Mechanism of action of antitumor drugs thatinteract with microtubules and tubulin[J].Curr MedChem Anticancer Agents,2002,2(1):1-17.
[11]Gligorov J,Lotz JP.Preclinical pharmacology of the taxanes:implications of the differences[J].Oncologist,2004,9(Suppl 2):3-8.
[12]McGrogan BT,Gilmartin B,Carney DN,et al.Taxanes,microtubules and chemoresistant breast cancer[J].Biochim Biophys Acta,2008,1785(2):96-132.
——水芹主要害虫识别与为害症状

