药学干预联合系统化处方评估对促进喹诺酮类药临床合理使用的效果
王鹛嵩,吴海涛
(海南省人民医院药学部,海口570311)
喹诺酮类(4-quinolones)又称吡酮酸类或吡啶酮酸类,它是以细菌DNA为作用靶点,通过抑制DNA旋转酶,进一步造成细菌DNA的不可逆损害,达到抗菌效果[1]。由于该类药物与许多抗菌药物间无交叉耐药性,因而受到广大临床医师的认可。虽然喹诺酮类抗菌药物在治疗感染方面取得了不错的效果,但是该药使用后仍然存在很多潜在的威胁,如耐药性、肝脏损伤等;特别是耐药性近年呈明显的增长趋势[2-3]。为了控制喹诺酮类药物耐药性的增长,延长药物的使用寿命,本院从2011年开始参考国外的相关经验,并结合本院的实际,开展了药物干预联合系统化处方评估模式,以期为加强喹诺酮药物的临床合理使用提供依据,现报道如下。
1 资料与方法
1.1 一般资料 选择2010年3月至2012年5月本院4358张含喹诺酮类抗菌药物处方作为研究对象,其中2010年3月至2011年3月药学干预前处方2371 张,2011年5月至2012年5月药学干预后处方1987 张。
1.2 方法
1.2.1 系统化处方评估及药学干预方法 参照WHO“对不合理用药原因及干预研究”的思想[4],并依据本院实际情况建立系统化处方评估和药学干预方法,具体流程为:按照本研究专家小组制订相应的评估标准,对已经发出的处方进行回顾性评价;对不合理的问题进行分析,将问题分类整理研究,并分析其中的原因。根据分析结果制订相应的干预措施,将干预措施在全院推广普及,向医师宣教合理用药。对干预措施定期评估,并持续改进干预措施。根据处方分析后发现当前喹诺酮类的不合理应用情况主要有:病毒性感染为主的呼吸道疾病,如急性咽炎、急性支气管炎广泛应用喹诺酮类抗菌药物;无指征的围术期预防用喹诺酮类;不进行病原菌药物敏感测定广泛用于泌尿生殖系统感染等;因此要求临床科室治疗感染时宜参考细菌药物敏感结果选用或根据药物敏感结果调整用药。若主要目标细菌耐药率超过75%,应暂停使用喹诺酮类抗菌药物,并根据追踪的细菌耐药检测结果,再决定是否恢复其临床应用。另外加强医务人员的宣教,一旦发生感染,及时控制,控制方法包括解除隔离、对尿或粪便培养进行检测。
1.2.2 系统化处方评估标准[5-6]建立评估专家小组,主要成员包括院内感染科、呼吸科、ICU、外科等临床专家;由评估专家小组指导,依据药品相关资料、《抗菌药物临床应用指导原则》,对本院目前的喹诺酮类抗菌药物左氧氟沙星片、左氧氟沙星注射液、加替沙星胶囊、加替沙星注射液、莫西沙星片、莫西沙星注射液、诺氟沙星片等制定统一、合理的评估标准。
1.2.3 评价指标[7-9](1)喹诺酮类药物使用情况评价指标:抗菌药物使用频度和药物利用指数。抗菌药物使用频度=总使用药量/日剂量,使用频度越高,说明临床上对该类药物选择性越高,药物使用越广泛。药物利用指数=用药频度/实际用药时间;当药物利用指数大于1,说明药物存在滥用的趋势,药物利用指数接近1,说明药物使用合理。(2)喹诺酮类药物耐药率相关指标:统计临床分离革兰阴性菌对左氧氟沙星、诺氟沙星的耐药率。(3)喹诺酮类药物处方合理性评估指标:超适应证用药、禁忌证用药、用法用量的合理性、联合用药的合理性等。
1.2.4 药学干预措施[10](1)医院药事管理部门制定《喹诺酮类药物临床使用管理规范》,定期对不合理用药情况进行调查,情节严重的临床医师暂停其处方权,并给予相应处分。(2)参考国外相关办法,对处方相关问题进行药学干预风险分级管理,对高风险处方的科室进行宣传教育,并加强药学监测等措施。(3)加强药师对处方的审核与干预,对药师进行喹诺酮类药物处方合理性培训、考核;在发药前药师对处方进行分析,一旦发现不合理用药情况立刻进行干预。(4)对临床医师进行合理用药教育。
1.2.5 观察指标 对干预前后本院喹诺酮类处方合理性评估指标进行对比,以评估干预的效果。
1.3 统计学处理 采用SPSS 16.0统计学软件进行数据分析,率的比较采用χ2检验,检验水准α=0.05,以P<0.05 为差异有统计学意义。
2 结 果
2.1 药学干预前后诺酮类药物使用频度、药物利用指数比较 药学干预后本院喹诺酮类药物使用频度由干预前的5526/日降低至4158/日,下降24.76%;绝大多数药品干预后药物利用指数接近于1,见表1。
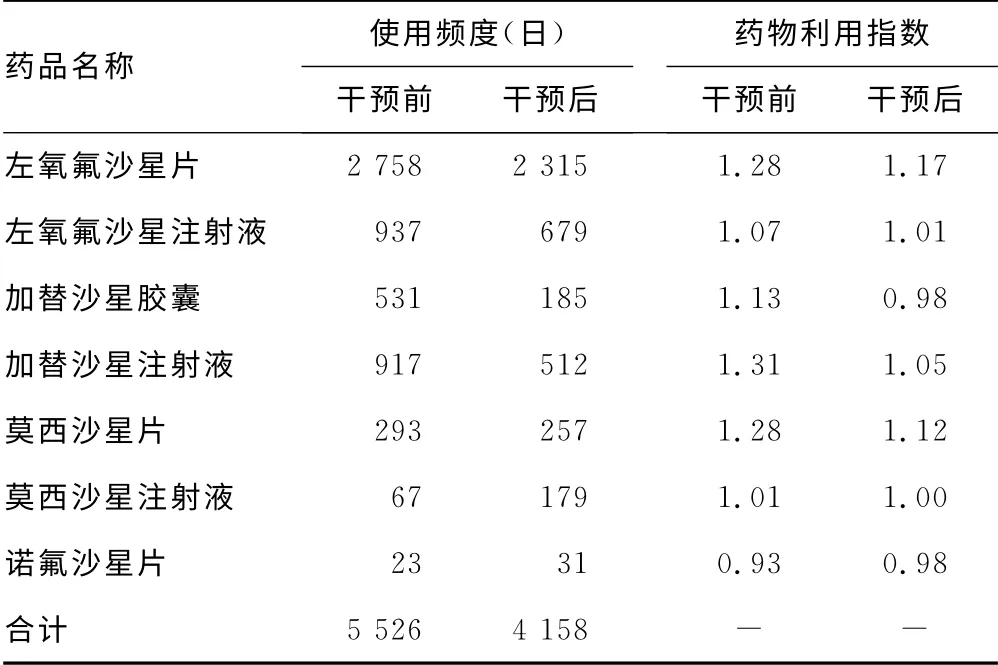
表1 药学干预前后喹诺酮类药物使用频度、 药物利用指数比较
2.2 药学干预前后喹诺酮类药物不合理使用情况比较 药学干预后本院总喹诺酮类药物不合理使用处方量明显下降,严重问题、重要问题、一般问题处方量均有显著降低,与干预前相比差异具有统计学意义(P<0.05),见表2。
2.3 药物干预前后主要喹诺酮类药物禁忌证用药、超适应证用药情况比较 药学干预后本院主要喹诺酮类药物无禁忌证用药情况;超适应证用药比例也显著降低,其中加替沙星胶囊、加替沙星注射液、诺氟沙星片等超适应证用药情况显著低于干预前(P<0.05),见表3。

表2 药学干预前后喹诺酮类药物不合理 使用情况比较[n(%)]
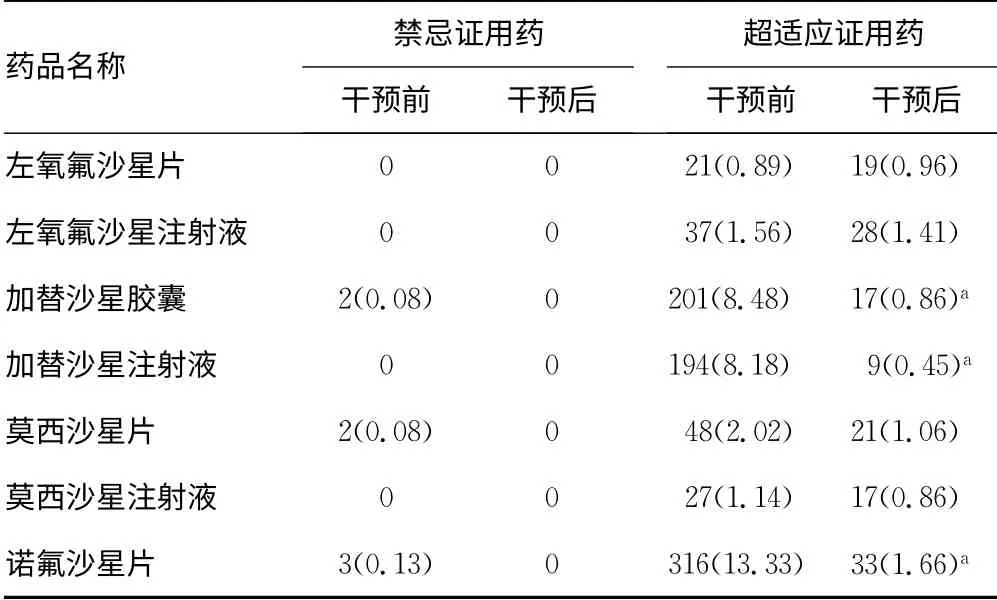
表3 药物干预前后主要喹诺酮类药物禁忌证用药、 超适应证用药情况比较[n(%)]
2.4 药学干预前后喹诺酮类药物用法用量、联合用药不合理情况比较 药学干预后本院喹诺酮类药物不合理用法用量比例明显降低(P<0.05),不合理联合用药情况也得到了一定改善,但与干预前差异无统计学意义(P>0.05),见表4。
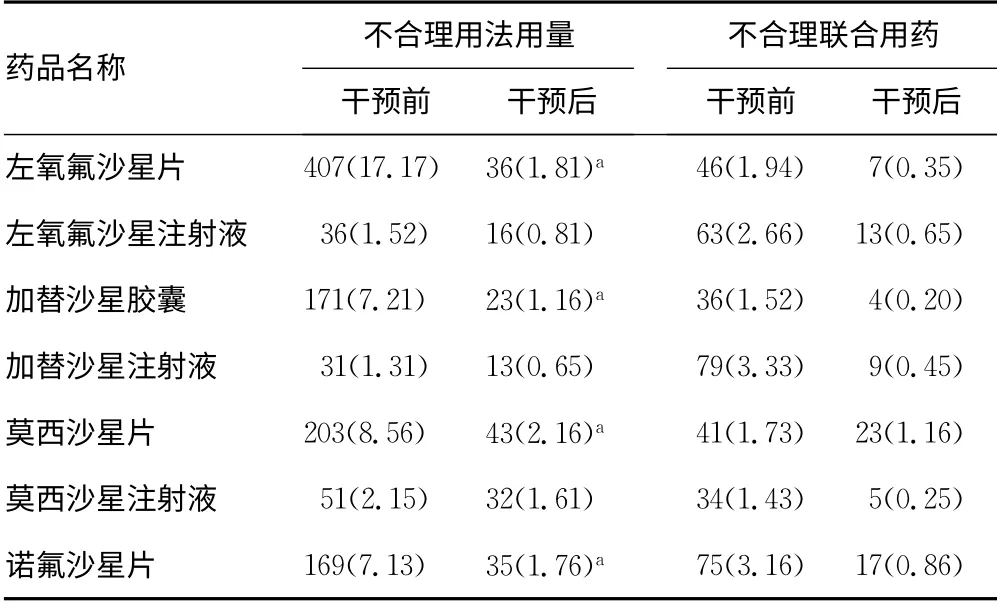
表4 药学干预前后喹诺酮类药物不合理用法用量、 联合用药情况比较[n(%)]
2.5 常用喹诺酮类药物干预前后耐药率对比 药学干预后,本院临床分离的主要革兰阴性菌对常用喹诺酮类抗菌药物耐药率均有所下降,其中铜绿假单胞菌干预后耐药率降低程度差异有统计学意义(P<0.05),见表5。
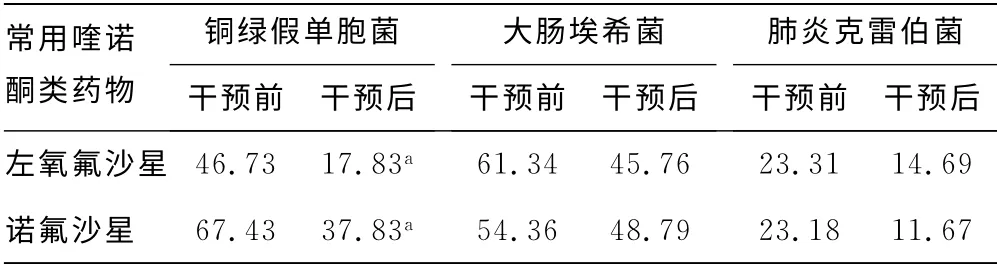
表5 常用喹诺酮类药物干预前后耐药率比较(%)
3 讨 论
喹诺酮类抗菌药物属合成类抗菌药物,主要包括诺氟沙星、环丙沙星、氧氟沙星、依诺沙星等。此类抗菌药物具有抗菌谱较广、高效、使用方便及不良反应少等特点。其作用机制是抑制细菌核酸的合成,此点与其他抗菌药物显著不同,不会与其他抗菌药物形成交叉耐药性,对其他抗菌素产生的耐药菌株仍然具有良好的抗菌活性。因此,喹诺酮类抗菌药物已成为目前临床上应用最为广泛的抗菌药物之一;常用于泌尿生殖系统、呼吸系统、消化系统感染性疾病的治疗。虽然喹诺酮类药物临床使用非常广泛,但是其耐药性、不良反应以及不合理用药情况依然常见[11]。有大量报道证实[12-15],临床上已经出现对喹诺酮类药物耐药的细菌。导致耐药菌出现的主要原因与院内抗菌药物滥用有关,因此严格按照规范使用抗菌药物的要求迫在眉睫。
在本研究中,作者对院内喹诺酮类药物使用实施系统化处方评估和药学干预联合模式,为探索符合本院实际的药学管理运行模式提供参考。根据处方分析后发现当前喹诺酮类的不合理应用情况主要在病毒性感染的呼吸道疾病、急性支气管炎,无指征的围术期预防用药,无病原菌药敏检测的泌尿生殖系统感染等方面,针对以上不合理用药进行了相关的调整,要求以上科室参考细菌药敏检测结果合理用药,定期对用药情况进行调查,情节严重的临床医师暂停其处方权,临床医师进行合理用药教育,对处方相关问题进行药学干预风险分级管理,加强药师对处方的审核与干预等多种措施。结果显示药学干预后本院喹诺酮类药物使用频度明显下降,且药物利用指数也更加合理。这说明药学干预和系统化处方评估模式可以规范喹诺酮类药物的合理使用,具体体现在:(1)临床药师可以对临床医师进行合理用药宣教,提高医师的用药安全意识;(2)药事管理委员会和药品管理部指定合理的使用规范和监管机制对喹诺酮药物的使用起到了很好的约束作用。另外从表2~4 中可以看出干预后喹诺酮类药物不合理使用情况得到明显改善,说明本运行管理模式对问题处方的发生具有显著的干预作用,通过对处方进行分析,找到问题根结,并采用针对性的干预策略,可以显著提高药物合理使用的比例。在本研究中作者同时对本院常用的喹诺酮类抗菌药物左氧氟沙星、诺氟沙星的耐药情况进行分析,结果显示本院临床分离的主要革兰阴性菌对常用喹诺酮类抗菌药物耐药率均有所下降,其中铜绿假单胞菌干预后耐药率降低程度差异有统计学意义(P<0.05);这一结果充分表明对喹诺酮类药物进行合理选择使用是控制细菌耐药性扩散的主要途径,这也为本院实施《抗菌药物使用管理办法》提供了很好的思路。
综上所述,药学干预联合系统化处方评估模式可以显著促进喹诺酮类药物的临床合理使用;这种模式可以考虑推广至其他药物的临床管理,为医院规范药物使用提供了一条崭新的思路。
[1] Sendzik J,Shakibaei M,Sch äfer-Korting M,et al.Synergistic effects of dexamethasone and quinolones on humanderived tendon cells[J].Int J Antimicrob Agents,2010,35(4):366-374.
[2] 朱健铭,姜如金,孔海深,等.多重耐药肺炎克雷伯菌发现一组gyr A、parC、qnrS 基因新变异型[J].中华流行病学杂志,2013,34(1):61-66.
[3] 糜祖煌,翁幸鐾,高军晖.肺炎克雷伯菌DNA旋转酶A亚单位喹诺酮耐药决定区变异型与底物分子对接分析[J].中华传染病杂志,2013,31(4):208-211.
[4] Bennett DE,Bertagnolio S,Sutherland D,et al.The World Health Organization′s global strategy for prevention and assessment of HIV drug resistance[J].Antivir Ther,2008,13(Suppl 2):S1-13.
[5] Fong DT,Pang KY,Chung MM,et al.Evaluation of combined prescription of rocker sole shoes and custom-made foot orthoses for the treatment of plantar fasciitis[J].Clin Biomech(Bristol,Avon),2012,27(10):1072-1077.
[6] Hassani Y,Hochart C,Hassani L,et al.Monitoring and evaluation tools for irinotecan and bevacizumab in glioblastoma:from prescription to patient′s information[J].Bull Cancer,2012,99(5):513-520.
[7] 尤浩.23例氟喹酮药严重不良反应分析[J].中国医院药学杂志,2012,32(9):735-736.
[8] 颜善活,卓永光.2131例女性泌尿生殖道支原体感染情况及药敏试验结果分析[J].重庆医学,2011,40(7):650-651,654.
[9] Narabayashi M,Mizowaki T,Matsuo Y,et al.Dosimetric evaluation of the impacts of different heterogeneity correction algorithms on target doses in stereotactic body radiation therapy for lung tumors[J].J Radiat Res,2012,53(5):777-784.
[10] 陈宏,樊莲莲,龚莎莉,等.德阳市人民医院呼吸内科住院患者在临床药师干预前后抗生素使用情况的分析[J].华西药学杂志,2011,26(3):303-304.
[11] 严莲珍,仲华,刘祖德,等.门诊氟喹诺酮类药物的不合理应用分析[J].中华医院感染学杂志,2011,21(1):77.
[12] Aldred KJ,Mcpherson SA,Wang P,et al.Drug interactions with Bacillus anthracis topoisomeraseⅣ:biochemical basis for quinolone action and resistance[J].Biochemistry,2012,51(1):370-381.
[13] Yamade M,Sugimoto M,Uotani T,et al.Resistance of helicobacter pylori to quinolones and clarithromycin assessed by genetic testing in Japan[J].J Gastroenterol Hepatol,2011,26(9):1457-1461.
[14] Sonnevend A,Rotimi VO,Kolodziejek J,et al.High level of ciprofloxacin resistance and its molecular background among Campylobacter jejuni strains isolated in the United Arab Emirates[J].J Med Microbiol,2006,55(Pt 11):1533-1538.
[15] 马池,吕媛.流感嗜血杆菌对β内酰胺类和氟喹诺酮类药物的耐药机制[J].中国临床药理学杂志,2012,28(7):483-486.

