夹心ELISA法测定正常人血浆sDC-SIGN浓度及其意义初步探讨
陈尚良李慧杰李延利梁剑锋陆倩雯陈政良★
·论著·
夹心ELISA法测定正常人血浆sDC-SIGN浓度及其意义初步探讨
陈尚良1,2李慧杰2李延利2梁剑锋1陆倩雯1陈政良2★
目的测定正常人血浆sDC-SIGN浓度。方法对本室建立的夹心ELISA法检测sDC-SIGN体系进行灵敏度和重复性评估,并采用该体系对352例健康志愿者外周血进行sDC-SIGN浓度测定。结果本室所建立的检测体系灵敏度可达6 ng/ml,批内变异10.4%,批间变异13.8%;352例志愿者检出sDC-SIGN的比例约58%,中位数1.18 ng/ml,百分之75分位数11.94 ng/ml。结论本室建立的体系可初步用于人血浆sDC-SIGN浓度测定;正常人血浆sDC-SIGN浓度较低,总体呈正偏态分布。
可溶性DC-SIGN;ELISA;健康志愿者;血浆
树突状细胞特异的结合细胞间黏附分子3的非整合素(dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin,DC-SIGN)是DC表面Ⅱ型跨膜受体,属于C型凝集素受体超家族成员,由糖识别域(carbohydrate recognition domain,CRD)、颈区、跨膜区和胞浆区等4个结构域组成[1]。CRD参与识别并结合细胞或病原体表面的糖基包括:岩藻糖、Lewis糖、甘露糖等。研究普遍认为膜DC-SIGN启动获得性免疫应答和病原体感染中的关键作用[2_4]。
2001年Mummidi等[5]发现细胞内存在多种无跨膜区和胞浆区的短截DC-SIGN mRNA剪切体,并认为其编码sDC-SIGN(soluble DC-SIGN,sDCSIGN)。2011年,Plazolles等[6]报道,人体液中存在sDC-SIGN,炎症可刺激其释放,sDC-SIGN可促进CMV感染DC。sDC-SIGN的发现,开创了DCSIGN研究的新方向。鉴于膜型DC-SIGN在启动获得性免疫应答和病原体感染中的关键作用,推测sDC-SIGN亦具有重要的生物学意义。但健康人群与疾病人群的sDC-SIGN浓度存在何种差异,目前尚未有明确报道。本研究利用前期已经建立的单、双抗夹心法ELISA检测体系,对健康人血浆sDC-SIGN浓度进行检测,现报道如下。
1 材料与方法
1.1样本来源
正常人血浆样本由肇庆市中心血站提供,源于无偿献血志愿者。按照《献血者健康检查要求》(GB 18467-2011)对志愿者进行体格检查,样本采集前均进行了告知并签署知情同意书。
1.2试剂与仪器
sDC-SIGN标准品[7,8](本室制备),兔抗sDCSIGN多克隆抗体(简称:兔多抗;本室制备),生物素化鼠抗sDC-SIGN单克隆抗体(简称:生物素化1c6;本室制备),亲和素-HRP(Ebioscicence),DAB显色试剂盒(Ebioscicence),Bio-Rad550酶标仪(Bio-Rad)。
1.3灵敏度和重复性测试
使用本室制备的sDC-SIGN作为标准品梯度稀释对所建立的测试方法进行灵敏度测试,同时设立阴性对照孔,以OD比值(样本/阴性)接近1为检出下限;选取高、中、低三个浓度(1∶150 ng/ml;2∶60 ng/ml;3∶30 ng/ml)标准品进行批内、批间变异测试,进行重复性评价。
1.4正常人血浆sDC-SIGN浓度检测
5 μg/ml兔多抗包被至96孔板,100 μl/孔,4℃包被12 h;1%PBS-Tween洗板5次,0.25%的酪蛋白封闭液300 μl/孔,37℃、封闭2 h;1%PBSTween洗板5次,加样本100 μl/孔,37℃、孵育2 h;1%PBS-Tween洗板5次,加入生物素化1c6抗体100 μl/孔,37℃、孵育1 h;1%PBS-Tween洗板5次,加入亲和素-HRP 100 μl/孔,37℃、孵育30 min;1%PBS-Tween洗板5次,TMB(A:B=1∶1)室温、避光显色5 min;2 M H2SO4终止,A450 nm读值。每次检测均同时设立标准曲线和阴性对照。
2 结果
2.1灵敏度和重复性
样品1-11为一系列稀释度的sDC-SIGN标准品,12号样品为阴性对照,以Ratio(样本/阴性)接近1为检出下限,可见该体系的最低检出限约6 ng/ml(第6个稀释度),具体见表1。S1(150 ng/ml)、S2(60 ng/ml)、S3(30 ng/ml)分别为高中低三个浓度的标准品,测得批内变异分别为8%,12.6%和10.6%,平均10.4%,批间变异分别为14.4%。14.3%,12.6%,平均13.8%,具体见表2。
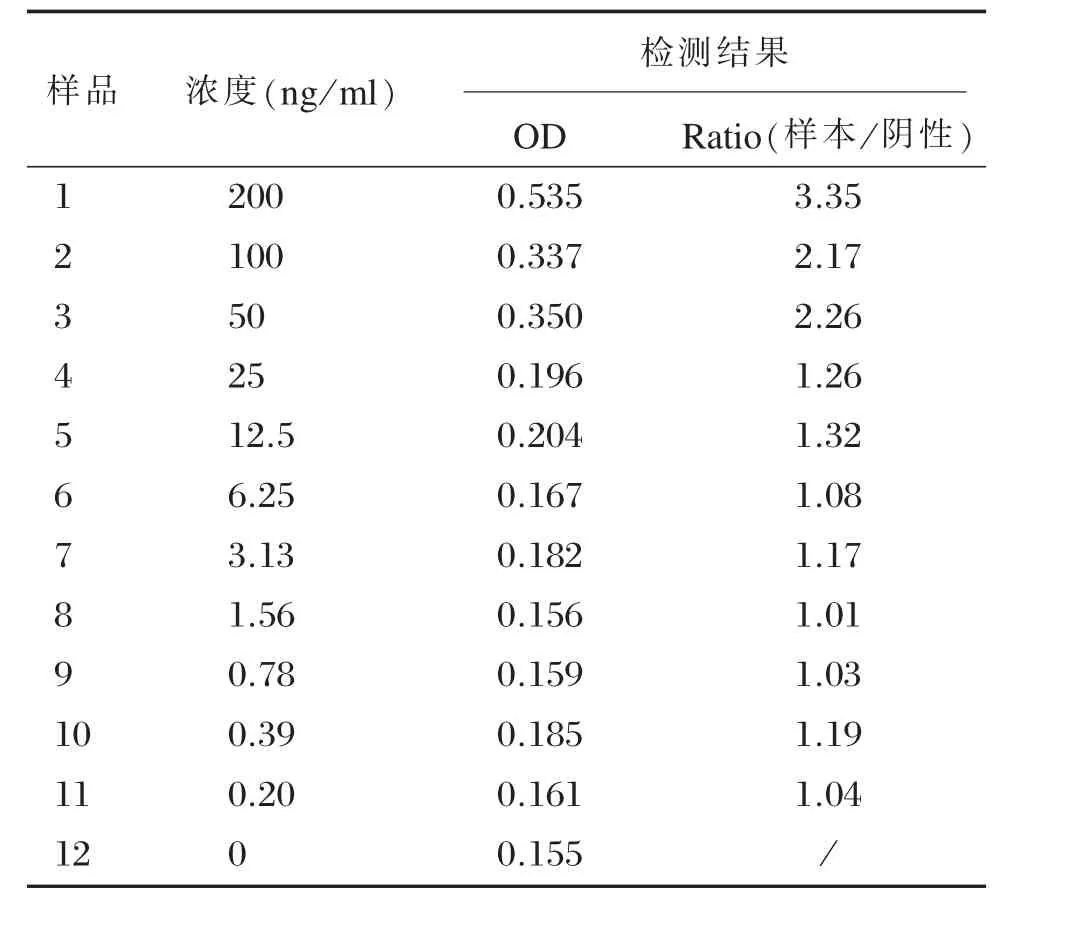
表1 灵敏度测定Table 1Sensitivity determination of ELISA
2.2样本检测结果
352例正常人血浆sDC-SIGN浓度呈正偏态分布,见图1,中位数1.18 ng/ml,百分之75分位数是11.94 ng/ml,总体检出率约58%(204/352)。
3 讨论
近十几年来,天然免疫越来越受到人们的青睐。天然免疫系统是由多种识别及效应分子组成的复杂的网络结构,它们协同作用,构成机体抗感染的第一道防线;并感受危险信号,指导获得性免疫应答的性质和强度,越来越多的证据表明天然免疫对于获得性免疫应答具有重要的指导作用。在这个重要的防御系统中,凝集素家族分子扮演着不可或缺的角色[9]。

表2 批内、批间重复性测定Table 2Variations in group and inter batch
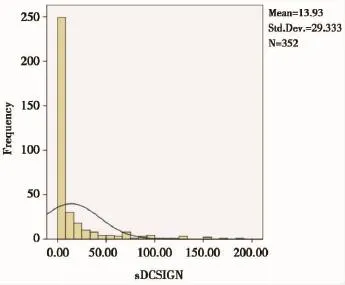
图1352 例正常人血浆sDC-SIGN浓度分布Figure 1The distribution of sDC-SIGN concentration from 352 healthy donors
DC-SIGN是DC表面Ⅱ型跨膜受体,属于C型凝集素受体超家族成员,主要表达于髓系DC,亦见于皮肤DC、间质DC和巨噬细胞,由CRD、颈区、跨膜区和胞浆区等4个结构域组成。CRD参与识别并结合细胞或病原体表面的糖基包括:岩藻糖、Lewis糖、甘露糖等。一方面,DC-SIGN识别并结合外源性配体如病原体糖结构而捕获抗原,与内源性配体如内皮表面ICAM-2、Lewis糖结合而参与DC的黏附、迁移及分化成熟,并与T细胞表面ICAM-3相互作用,参与形成免疫突触,触发初始T细胞应答,并影响Th1、Th2应答的平衡;另一方面,某些引起慢性感染的病原体如HIV、结核杆菌等通过DC-SIGN介导内吞进入DC,抑制DC功能,逃避宿主免疫系统攻击,并与易感细胞表面配体如ICAM-3、Lewis糖相互作用,形成“感染性突触”而感染宿主细胞[10_13]。
Plazolles等[6]报道炎症可刺激其释放sDCSIGN,如类风湿关节炎(rheumatoid arthritis,RA)病人体液中sDC-SIGN浓度升高,sDC-SIGN可促进CMV感染DC等。我们前期的研究工作中也初步发现在HBV感染者体内存sDC-SIGN明显增高的现象[14]。要深入研究sDC-SIGN与疾病感染,以及其对天然免疫的调控作用,必须对健康人群和发病人群进行大样本检测。
前期研究中[7,8],我们原核表达并纯化了sDCSIGN蛋白,同时利用该蛋白筛选、制备多株单克隆抗体和兔多抗,建立、优化检测血浆sDC-SIGN的双夹心ELISA体系。本研究中,我们对该检测体系进行了灵敏度和重复性评价,并利用该体系检测了352份健康献血者新鲜血浆,为后续的研究提供基础数据。
结果显示,我们前期所建立的检测体系具有较高的灵敏度和较强的特异性。该体系的灵敏度约6 ng/ml;批内变异约10.4%,批间变异约13.8%,均小于15%,基本满足免疫学检测要求。352例健康献血者检测结果显示,血浆sDC-SIGN浓度在健康人群中呈正偏态分布,检出比例为约58%,与国外报道的检出比例存在较大差异。2011年,Plazolles等[6]报道:应用Western blot方法对21例志愿者的血浆进行sDC-SIGN检测,其中19例为检出阳性;应用ELISA方法检测61例健康志愿者血浆,则几乎全部检出存在sDC-SIGN。我们猜想造成差异的原因可能如下:①与国外报道相比(国外报道可达0.1 ng/ml),检测灵敏度不够,导致部分样本漏检;②与MBL一样,单核苷酸多态性(SNP)导致不同种族人群血浆水平sDCSIGN的变异。这一差异的成因有待后续研究证实。
此外,我们还发现血浆sDC-SIGN浓度存在性别差异,女性高于男性,这或者与某些参考标志物一样,例如血浆ALT浓度等,本身就存在性别差异。由于需要进一步确认数据的可靠性,本研究结果中没有给出这一部分数据。但毫无疑问的是,人血浆中存在sDC-SIGN,而且与人体感染状况相关。本研究对352例健康志愿者进行了血浆sDCSIGN浓度测定,为研究sDC-SIGN与疾病的发生发展提供了基础数据,为后续的深入研究奠定了基础。
[1]Manzo C,Torreno-Pina J A,Joosten B.The neck region of the C-type lectin DC-SIGN regulates its sueface spatiotemporal organization and virus-binding capacity on antigen-presenting cells[J].Journal of Biological Chemistry,2012,(46):38946_38955.
[2]Van den Berg L M,Gejjtenbeek T B.Antivirual immuneresponsebyhumanlangerhanscellsand dendritic cells in HIV-infection[J].Advances in Experimental Medicine and Biology,2013,(1):45_70.
[3]Du T,Hu K,Yang J,et al.Bifunctional CD4-DCSIGN fusion proteins demonstrate enhanced avidity to gp120 and inhibit HIV-1 infection and dissemination [J].Antimicrob Agents Chemother,2012,56(9):4640_ 4649.
[4]Lugo-Villarino G,Hudrisier D,Tanne A,et al.C-type lectinswithasweetspotforMycobacterium tuberculosis[J].Eur J Microbiol Immunol(Bp),2011,1 (1):25_40.
[5]Mummidi S,Catano G,Lam L,et al.Extensive repertoire of membrane-bound and soluble dendritic cell-specificICAM-3-grabbingnonintegrin1(DCSIGN1)and DC-SIGN2 isoforms.Inter-individual variation in expression of DC-SIGN transcripts[J].J Biol.Chem,2001,276:33196_33212.
[6]Plazolles N,Humbert J M,Vachot L.The promotion of soluble DC-SIGN release by inflammatory signals and itsenhancementofcytomegalovirus-mediatedcisinfection of myeloid dendritic cells[J].Journal of Leukocyte Biology,2011,3:329_342.
[7]刘莹,左大明,卢晓.人DC-SIGN全长编码区基因的克隆及其胞外段的原核表达[J].细胞与分子免疫学杂志,2009,5:396_398.
[8]张婧,张丽芸,卢晓,等.人可溶性DC-SIGN的原核表达及鉴定[J].热带医学杂志,2013,6:701_707.
[9]Berg L M,Gringhuis S I,Geijtenbeek T B.An evolutionary perspective on C-type lectins in infection and immunity[J].Annals of the New York Academy of Sciences,2012,1:149_158.
[10]Jain P,Manuel S L,Khan Z K,et al.DC-SIGN mediates cell-free infection and transmission of human T-cell lymphotropic virus type 1 by dendritic cells[J].J Virol,2009,83(21):10908_10921.
[11]De Jong M A,de Witte L,Bolmstedt A,et al.Dendritic cells mediate herpes simplex virus infection and transmission through the C-type lectin DC-SIGN [J].J Gen Virol,2008,89(10):2398_2409.
[12]Geijtenbeek T B,den Dunnen J,Gringhuis S I.Pathogen recognition by DC-SIGN shapes adaptive immunity[J].Future Microbiol,2009,4:879_890.
[13]Wang S F,Huang J C,Lee Y M,et al.DC-SIGN mediates avian H5N1 influenza virus infection in cis and in trans[J].Biochem Biophys Res Commun,2008, 373(4):561_566.
[14]马静,刘莹,卢晓.可溶性DC-SIGN对T淋巴细胞增殖及分泌细胞因子的调节作用[J].细胞与分子免疫学杂志,2011,8:856_858.
Preliminary study of soluble DC-SIGN concentration by ELISA in healthy volunteers
CHEN Shangliang1,2,LI Huijie2,LI Yangli2,LIANG Jianfeng1,LU Qianwen1,CHEN Zhengliang2★
(1.Zhaoqing Center Blood Stations,Guangdong,Zhaoqing 526020,China;2.Department of Immunology,Southern Medical University,Guangdong,Guangzhou 510515,China)
ObjectiveTo detect the concentrations of soluble DC-SIGN in normal human plasma.MethodsThe sensitivity and repeatability experiments were tested respectively for the specific sDC-SIGN ELISA which was developed in our laboratory,and then 352 serum samples from healthy volunteers wered detected for sDC-SIGN concentration by the ELISA.ResultsThe sensitivity of ELISA developed in our laboratory was up to 6 ng/ml and the variation of group and inter batch were 10.4%and 13.8%,respectively.About 58%healthy donors contained detectable amounts of sDC-SIGN ranging from 0 to 187 ng/ml with a median value of 1.18 ng/ml.ConclusionsThe specific sDC-SIGN ELISA was developed in our laboratory could detect serum sDC-SIGN,and the serum sDC-SIGN concentrations are low in healthy volunteers,which is positive skew distribution.
Soluble DC-SIGN;Sandwich-ELISA;Healthy donor;Plasm
肇庆市科技计划(2013E2815)
1.肇庆市中心血站,广东,肇庆526020 2.南方医科大学基础医学院免疫学教研室,广东,广州510515
★通讯作者:陈政良,E-mail:zhlchen@fimmu.com

