胃癌CyclinD1、PTEN表达及与化疗药物耐药性关系的研究
王翠翠 郑金峰 周露婷 景洪标 曹永成 李培峰 刘晓红 耿明
·论著·
胃癌CyclinD1、PTEN表达及与化疗药物耐药性关系的研究
王翠翠 郑金峰 周露婷 景洪标 曹永成 李培峰 刘晓红 耿明★
目的探讨胃癌组织中CyclinD1、PTEN蛋白的表达和与化疗药物敏感性的关系。方法取胃癌手术标本84例,用免疫组化检测CyclinD1、PTEN蛋白在胃癌组织中的表达。并用MTT比色法观察胃癌原代培养细胞在体外对化疗药物HCPT、CDDP、5-Fu、ADM和MMC的敏感性。结果胃癌组织中CyclinD1和PTEN蛋白的阳性率分别为67.86%和46.43%。胃癌细胞对不同化疗药物敏感性不同:5-Fu、MMC和DDP对胃癌细胞的抑制率显著高于ADM和HCPT(P<0.05)。CyclinD1阳性者对5-Fu、HCPT的敏感性显著高于阴性者(P<0.05)。PTEN蛋白表达与五种化疗药物的体外耐药无相关性(P>0.05)。结论CyclinD1蛋白与胃癌对化疗药物敏感性相关,检测其表达对选择化疗药物有实用价值。
胃癌;抑癌基因;免疫组化;化疗药物;MTT比色
对癌基因和抑癌基因在恶性肿瘤中表达的研究已有较多报道[1_3],研究癌基因和抑癌基因与化疗药物耐药性的关系已成为目前肿瘤研究中的一个热点[4,5]。本研究取手术切除的新鲜胃癌组织,用免疫组化法检测CyclinD1和PTEN蛋白的表达情况,并对原代胃癌细胞进行体外培养,用MTT比色法检测胃癌细胞对5种常用化疗药物的敏感性,分析CyclinD1和PTEN蛋白与胃癌化疗药物敏感性的关系,为探讨与胃癌原发性耐药发生的相关因素提供资料和依据。
1 材料与方法
1.1临床资料
收集济南军区总医院2011年8月至2012年2月手术切除的84例胃癌新鲜标本。男性47例,女性37例,年龄28~78岁,中位年龄56岁。病理学类型为乳头状腺癌17例、管状腺癌20例、低分化腺癌25例、粘液腺癌9例、印戒细胞癌13例。
1.2免疫组化
免疫组化染色采用SP法。一抗CyclinD1和PTEN单克隆抗体均购自福州迈新生物公司,按试剂盒说明书操作,用生理盐水代替一抗做阴性对照。高倍镜下取10个高倍视野,每个视野计数100个细胞,阳性细胞数≥10%阳性。
1.3肿瘤细胞悬液制备
自浆膜面分离肿瘤,从无坏死部位取材,用酸性离子水反复冲洗,置于Hanks液的无菌冻存管中。在超净工作台上,用无菌剪刀将肿瘤组织剪成糊状,200目铜网研磨过滤,3 000 r/min离心10 min,Hanks液漂洗二次,台盼蓝染色记数活细胞数大于95%,并用倒置显微镜观察细胞形态,确定肿瘤细胞比例≥90%。再用10%胎牛血清RPMI-1640培养液重悬,血细胞计数板调整单细胞悬液至活细胞浓度3×105个/ml。
1.4MTT药物敏感试验
实验分组,用药组:取单细胞悬液加入96孔培养板,每孔180 μl,分别加入药物终浓度为血浆峰值浓度的羟基喜树碱(HCPT)、顺铂(DDP)、阿霉素(ADM)、5-氟尿嘧啶(5-FU)、丝裂霉素(MMC),每组药物设3个复孔;对照组:加入单细胞悬液180 μl,不加药物;空白组:加180 μl培养液,无培养细胞和药物。置于37℃、5%CO2、饱和湿度的培养箱中培养48小时,每孔加入5 mg/m l的MTT 10 μl,继续培养4小时后,加入0.04N盐酸异丙醇100 μl/孔,静止10分钟,用酶标仪在570 nm波长检测光密度值(OD值)的变化。取4复孔OD值的平均值作为细胞在此药物组的平均OD值。肿瘤细胞抑制率=(对照组OD值_用药组平均OD值)/(对照孔平均OD值_空白组OD值)×100%。
1.5统计学分析
实验数据用SPSS 12.0统计包进行分析,P<0.05视为差异具有统计学意义。
2 结果
2.1CyclinD1和PTEN在胃癌组织中的表达
在胃癌组织中,CyclinD1蛋白阳性物质呈棕色,在细胞核表达(图1),84例胃癌组织的阳性率为67.9%(57/84)。在不同类型胃癌中,经统计学分析,分化差的印戒细胞癌、粘液腺癌及低分化腺癌显著高于分化好的乳头状腺癌及管状腺癌,差异有统计学意义(P<0.05,表1)。PTEN蛋白阳性物质呈棕黄色,分布在胃癌细胞膜和细胞质内(图2),阳性率为46.4%(39/84),在乳头状腺癌和管状腺癌,PTEN阳性率显著高于低分化腺癌、印戒细胞癌和粘液细胞癌,差异有统计学意义(P<0.05,表2)。
2.2MTT药敏检测结果
84例胃癌标本,MTT法药敏实验成功80例,成功率95.2%(80/84)。失败原因:3例污染,另1例细胞生长不良,活细胞过少。经化疗药物作用48h后,MTT检测结果提示,胃癌细胞对不同化疗药物的敏感性不同,DDP、MMC及5-FU显著高于ADM及HCPT,差异具有统计学意义(P<0.05),DDP、MMC及5-FU之间敏感性差异无统计学意义(P>0.05,表3)。
2.3CyclinD1蛋白表达与化疗药物体外抑制率的关系
将MTT检测结果中抑制率≥30%者判为敏感,而<30%者判为耐药。在5-FU及HCPT耐药组中,CyclinD1的阳性率分别为27.8%(5/18)和30.8%(4/13),其阳性表达与5-FU及HCPT的体外耐药显著相关,二种药物对CyclinD1阳性表达者的抑制率显著高于阴性表达者,差异具有统计学意义(P<0.05),而与ADM、CDDP及MMC的耐药性无关(P>0.05,表4)。
2.4PTEN蛋白表达与化疗药物体外抑制率的关系统计分析显示,PTEN蛋白表达与胃癌对五种化疗药物的体外耐药无相关性(P>0.05,表5)。
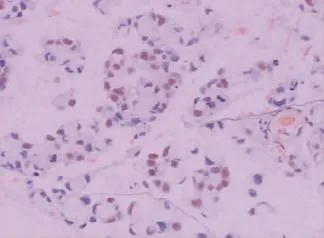
图1 印戒细胞癌,Cyclin D1在细胞核阳性表达(×100)Figure 1Cyclin D1 positive expression in the signet-ring cell carcinoma
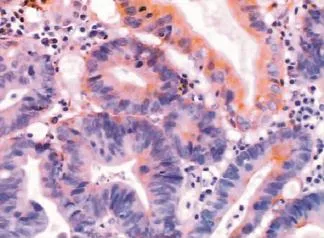
图2 管状腺癌,PTEN在细胞膜和细胞质内阳性表达(×200)Figure 2PTEN positive expression in the tubular adenocarcinoma
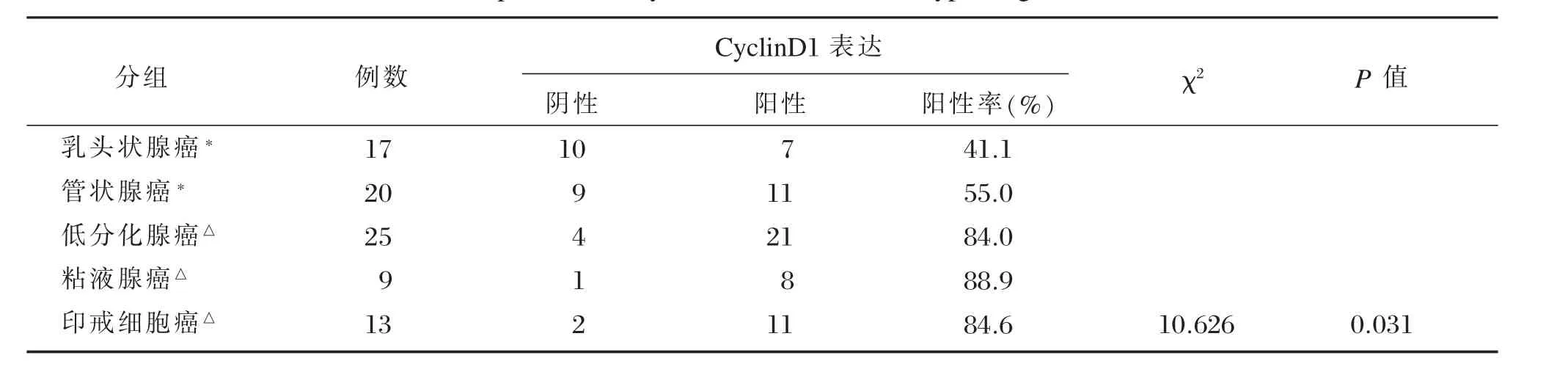
表1 CyclinD1蛋白在不同类型胃癌组织中的表达Table 1Expression of CyclinD1 in the different type of gastric cancer
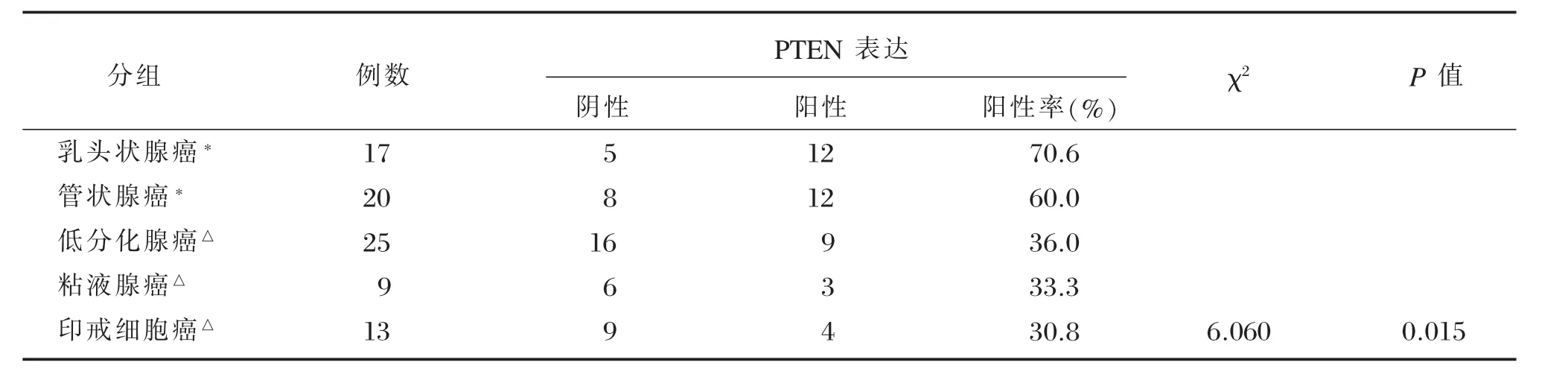
表2 PTEN在不同类型胃癌组织中的表达Table 2Expression of PTEN in the different type of gastric cancer
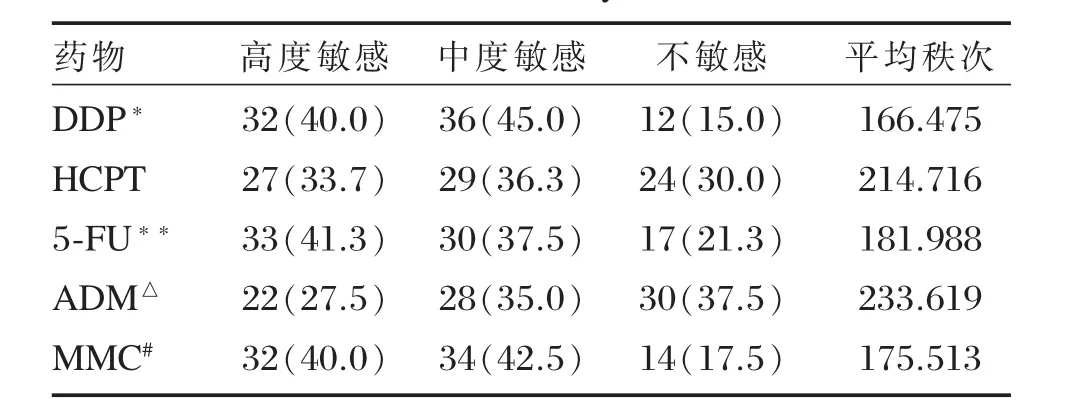
表3 胃癌组织MTT药敏检测结果(例,%)Table 3Result of chemotherapeutic drug sensitive test by MTT assay
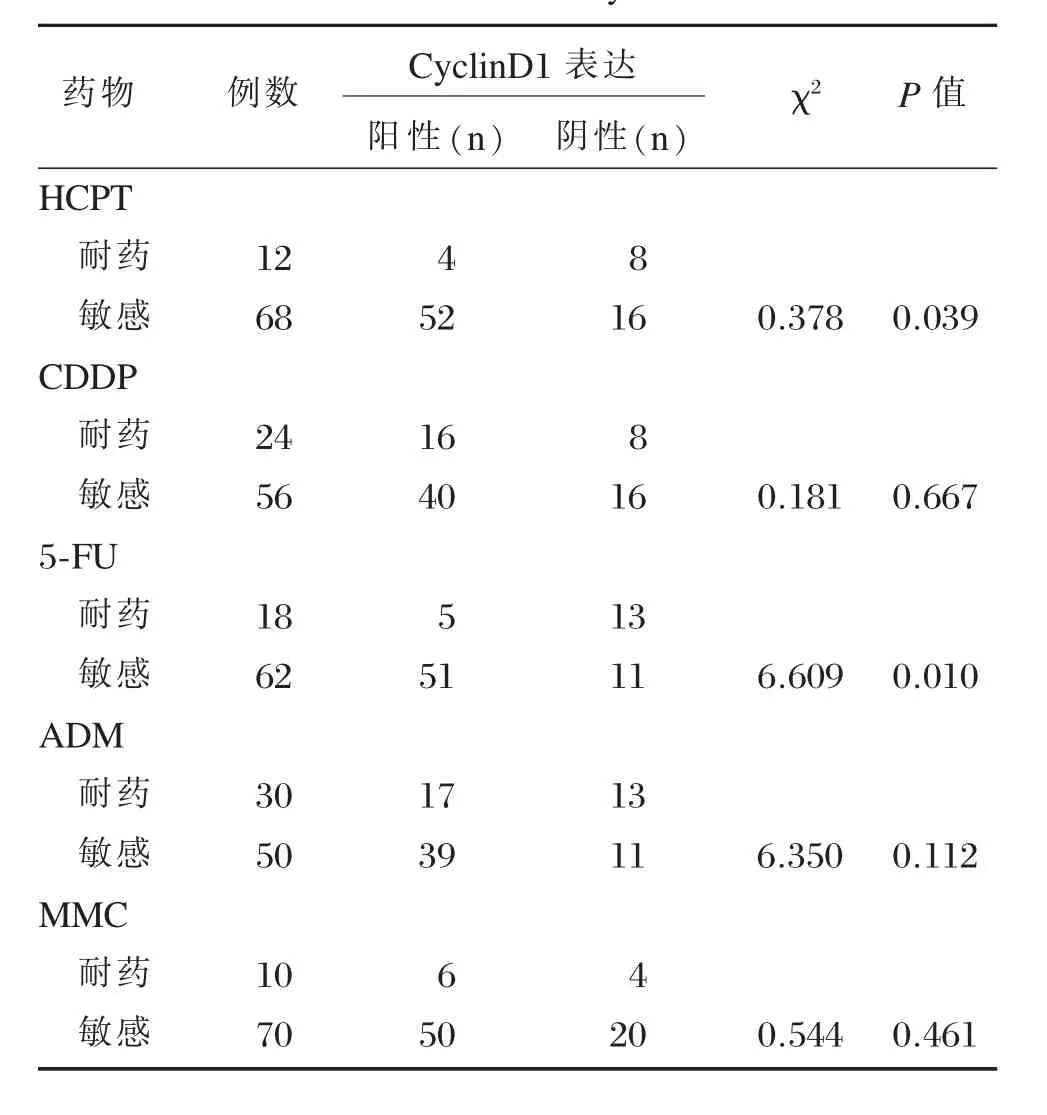
表4 CyclinD1表达与MTT检测结果的关系Table 4Relationship of CyclinD1 expression with results of MTT assay
3 讨论
癌基因的激活及抑癌基因的失活是肿瘤发生过程中最常发生的基因改变[6,7],在不同阶段具有不同的基因表达异常,这些基因的表达异常同时影响着肿瘤的生物学行为。化疗作为中晚期胃癌患者的主要治疗手段和围手术期的辅助治疗,对延长患者生存期发挥着重要作用[8]。但是由于遗传特征不同,化疗药物药效和毒性存在较大个体差异性,目前胃癌的化疗缺乏可靠的药敏实验指导,当临床确定患者对某种化疗药物不敏感时,药物已产生严重的毒副作用,使化疗不可避免地存在盲目性及随意性。因此观察癌基因和抑癌基因在胃癌组织中的表达研究,通过用胃癌原代培养细胞检测其对不同化疗药物的敏感性,对探讨胃癌对化疗药物的耐药性有重要意义。
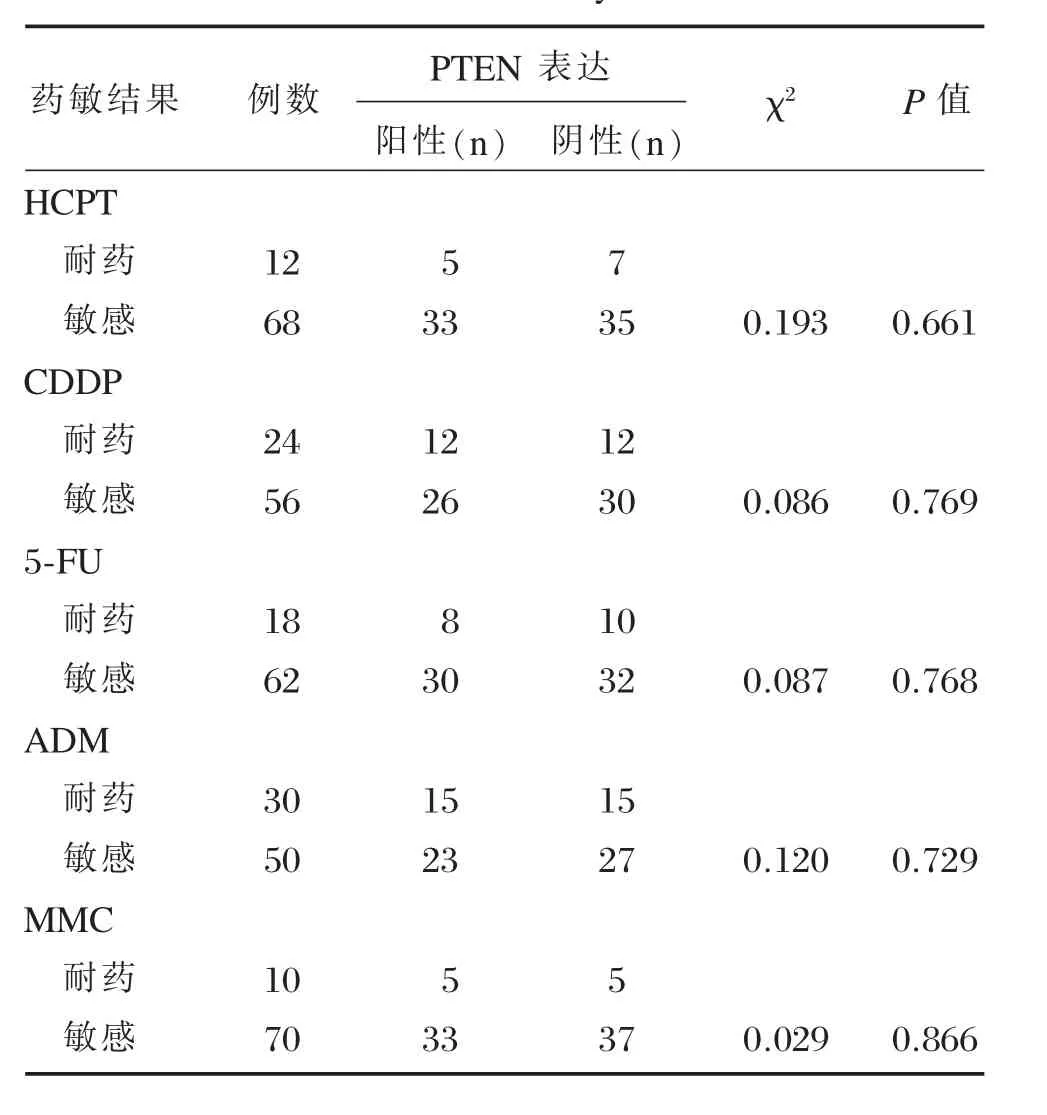
表5 PTEN表达与MTT检测结果的关系Table 5Relationship of PTEN expression with results of MTT assay
肿瘤细胞的耐药性与多种基因的表达异常有密切关系[9_11]。已经证实:即使组织学类型和分化程度相同的肿瘤,对化疗药物敏感性也存在差异[12]。因此检测与肿瘤发生有关的基因表达对选择有效化疗药物有理论依据和实用价值。CyclinD1是细胞周期成分中与肿瘤有最直接关系的癌基因,研究表明,CyclinD1在许多肿瘤中都有过度表达,其基因扩增或过度表达是细胞转化和维持转化表型所必需的[13];CyclinD1由于基因扩增、染色体易位、染色体倒位、转录增加、mRNA稳定性增强等原因导致蛋白过度表达,如果CyclinD1持续高表达,将导致G1期缩短,提前进入S期,使细胞增殖失控,最终形成肿瘤[14]。抗肿瘤药物5-Fu是细胞周期特异性药物,在体内可转变为5-氟尿嘧啶脱氧核苷酸,抑制胸腺嘧啶核苷合成酶,阻断尿嘧啶脱氧核苷转变为胸腺嘧啶脱氧核苷,从而影响DNA的合成而抑制肿瘤细胞生长。而羟基喜树碱作用于DNA拓朴异构酶I,使之与DNA断裂复合物稳定从而干扰DNA复制,是主要作用于S期的细胞周期特异性药物。本实验结果证实:CyclinD1表达与胃癌分化有关,分化程度越低的胃癌,CyclinD1阳性率越高,对5-Fu和HCPT的敏感性显著高于CyclinD1阴性者。提示CyclinD1阳性的肿瘤,由于处在DNA合成期的细胞数目增多,使用细胞周期化疗药物5-Fu和HCPT能够更加有效地杀伤肿瘤细胞。MMC、ADM和DDP不作用于细胞周期,因此对肿瘤细胞的抑制与CyclinD1表达不存在明显相关性。
PTEN具有双特异磷酸酶功能,通过对细胞周期和细胞生存的阴性调节抑制细胞生长,在细胞信号转导和凋亡中发挥重要作用。研究表明PTEN是一个强有力的抑癌基因,在多种肿瘤中频繁发生突变,其突变频率可以与p53相匹敌,这些特点使其成为后P53时代最引人注目的一种肿瘤抑制基因[15,16]。研究发现PTEN与胃癌关系密切[17],Kang等在310例胃癌标本中,62例(20%)免疫组化显示PTEN表达缺失,随机66例病例中的26例(39%)胃癌组织PTEN基因启动子异常甲基化,其中73%(19/26)PTEN蛋白表达缺失[18]。本实验结果显示:在胃癌组织PTEN蛋白阳性表达与胃癌分化程度显著相关。提示PTEN基因的失活参与了胃粘膜上皮细胞的恶性转化过程,而在胃癌的发展过程中PTEN蛋白表达进行性下降,PTEN蛋白表达下降对癌细胞增殖的抑制作用减弱,促进了癌细胞的浸润和转移,因此PTEN作为抑癌基因在胃癌的进展、转移、分化和预后中有重要作用,其表达水平可作为判断胃癌病程的参考指标。关于PTEN与化疗药物耐药性的关系,Fahimeh等观察了PTEN表达情况与多柔比星治疗乳腺癌的关系,结果发现在不同类型乳腺癌组织中,PTEN的上调或下调表达与多柔比星对肿瘤细胞的抑制效果不同[19]。提示在不同肿瘤,甚至同一组织来源但不同组织学分型的肿瘤中PTEN的功能可能不同。在我们的研究中,没有发现PTEN与胃癌对五种化疗药物的耐药性相关,推测可能由于在不同肿瘤中PTEN的作用机制存在差异,或与不同化疗药物对肿瘤细胞杀伤机制的不同有关。
[1]Angelo C,Giuseppina B,Cristina E,et al.The tumorsuppressor p53regulates polarity of self-renewing divisions in mammary stem cells[J].Cell,2009,138(18): 1083_1095.
[2]Theodore S,Lialiaris A,Kouskoukis G,et al.Expression of 6 common antigenic markers in invasive ductal breast carcinoma:potential clinical implications[J].Applied Immunohistochemistry&Molecular Morphology,2011,19(2):106_111.
[3]耿明,王琳,曹永成,等.胃粘膜癌前病变和胃癌组织相关癌基因和抑癌基因表达差异的研究[J].中华肿瘤防治杂志,2008,15:1212.
[4]Mavridis K,Talieri M,Scorilas A.KLK5 gene expressionisseverelyupregulatedinandrogenindependent prostate cancer cells after treatment with the chemotherapeutic agents docetaxel and mitoxantrone [J].Biological Chemistry,2010,391(4):467_474.
[5]Wang L,Wang C,Su B,et al.Recombinant human PDCD5protein enhances chemosensitivity of breast cancer in vitro and in vivo[J].Biochemistry and Cell Biology,2013,91(6):526_531.
[6]Li Y,Gao Q,Yin G,et a1.wNT/beta_cateninsignalingpathwaystimulatestheproliferatjonof cultured adult human Sertoli cells via upregulation of C-mycexpression[J].Reprod Sci,2012,19(11):l232_ 1240.
[7]Carwyn,Davies Linda A,Hogarth Philipp A,et al.p53-independentepigeneticrepressionofthep21 (WAF1)gene in T-cell acute lymphoblastic leukemia [J].The Journal of Biological Chemistry,2011,286(43): 37639_37650.
[8]Geng M,Wang L,Li P F,et al.Correlation between chemosensitivitytoanticancerdrugsandBcl-2 expression in gastric cancer[J].Int J Clin Exp Pathol, 2013,6(11):2554_2559.
[9]Hamed S S,Roth C M.RothMathematical modeling to distinguishcellcyclearrestandcellkillingin chemotherapeuticconcentrationresponsecurves[J].Journal of Pharmacokinetics and Pharmacodynamics, 2011,38(3):385_403.
[10]Engelmann D,Knoll S,Ewerth D.Functional interplay betweenE2F1andchemotherapeuticdrugsdefines immediate E2F1 target genes crucial for cancer cell death[J].Cellular and Molecular Life Sciences,2010,67 (6):931_948.
[11]Lan F F,Wang H,Chen Y C,et a1.Hsa-1et-79 inhibits proliferation 70f hepatoceUular carcinoma cells by downregulation of c-IⅥyc and upregulation of p1 6 (1NK4A)[J].Int J Cancer,2011,28(2):319_331.
[12]耿明,尹迎春,曹永成,等.化疗药物对原代胃癌细胞的体外杀伤效应及其与端粒酶逆转录酶mRNA表达的关系[J].中华肿瘤杂志,2007,29(11):838_841.
[13]Kandel R,LI S Q,Bell R,et al.Cyelin D1 and p21 is elevated in the Giant Cells of Giant Cell Tumors[J].Journal of Orthopaedic Research,2006,24(3):428_437.
[14]Jung K H,Kim J K,Noh J H,et a1.Targeted disruption of Nemo—like kinase inhibits tumor cell growth by sim-ultaneous suppression of cyclin D1 and CDK2 in humanhepatocellular carcinoma[J].J Cell Biochem,2010,110(3):687_696.
[15]Yao D,Alexander C L,Quinn J A,et al.Fos cooperation with PTEN loss elicits keratoacanthoma not carcinoma,owing top53/p21WAF-induced differentiation triggered by GSK3{beta}inactivation and reduced AKT activity.J Cell Sci,2008,121(10):1758_1769.
[16]Bassi C,Stambolic V.PTEN,here,there,everywhere [J].Cell Death and Differentiation,2013,20(12):1595_ 1596.
[17]Raftpoulou M.Etienne-Manneville S,Self A,et a1.Regulation of cell migration by the C2 domain of the tumor suppressor PTEN.Science,2004,303(5661):l179.
[18]Kang Y H,Lee H S,Kim W H.Promoter methylation and silencing of PTEN in gastric carcinoma.Lab Invest,2002,82(3):285_291.
[19]Fahimeh A,Jalil P,Islamian B,et al.Enhancing the Effects of Low Dose Doxorubicin Treatment by the Radiation in T47D and SKBR3 Breast Cancer Cells[J].J Breast Cancer,2013,16(2)164_170.
Relationship between Cyclin D1 or PTEN expression and chemoresistance in gastric carcinoma
WANG Cuicui,ZHENG Jinfeng,ZHOU Luting,JING Hongbiao,CAO Yongcheng,LI Peifeng,LIU Xiaohong,GENG Ming★
(Department of Pathology,General Hospital of Jinan Military Unit,Shandong,Jinan 250031,China)
ObjectiveTo investigate the relationship between CyclinD1、PTEN expression and the the sensitivity to chemotherapeutic-drugs in gastric carcinoma.Methods84 samples of gastric cancer was collected,CyclinD1、PTEN was detected by immunohistochemistry.Primary single-cell suspensions were prepared from fresh specimens of primary gastric cancer and exposed to hydroxycamptothecin(HCPT),cisplatin(CDDP),5-fluorouracil(5-FU),adriamycin(ADM)and mitomycin(MMC)respectively for 48 h.Cell metabolic activity and rate of inhibition were evaluated by tetrazolium(MTT)assay.ResultsPositive rate ofCyclinD1 and PTEN expressed in gastric cancer was 67.86%and 46.43%,respectively.Chemosensitivity of the gastric cancer cells varied;the rates of inhibition of cells exposed to MMC,CDDP and 5-FU were significantly higher than that of cells exposed to ADM and HCPT(P<0.05).Cyclin D1 positive cells showed more sensitive to 5-Fu、HCPT than the negative cells(P<0.05).ConclusionExpression of CyclinD1 was related with primary drug-resistance of gastric cancer,and Cyclin D1 expression detection could be used as predictors in chemotherapeutic drug administration and for identifying drug resistance in gastric carcinoma.
Gastric cancer;Antioncogene;Immunohistochemistry;Chemotherapeutic-drugs;MTT colorimetric assay
国家科技部863计划(2011AA02A110)
济南军区总医院病理科,山东,济南250031
★通讯作者:耿明,E-mail:gm2227@sina.com

