香菇纤维素衍生物抑制黄曲霉菌产毒的研究
李红波,王淼焱,胡梁斌,*,莫海珍,潘道东
(1.宁波大学海洋学院,浙江宁波 315211)
(2.河南科技学院食品学院,河南新乡 453003)
香菇纤维素衍生物抑制黄曲霉菌产毒的研究
李红波1,2,王淼焱2,胡梁斌2,*,莫海珍2,潘道东1
(1.宁波大学海洋学院,浙江宁波 315211)
(2.河南科技学院食品学院,河南新乡 453003)
黄曲霉毒素具有诱导突变、抑制免疫和致癌作用。控制黄曲霉毒素污染一直是世界性难题,也是近年来的研究热点之一。实验研究了香菇纤维素衍生物GPX抑制黄曲霉菌产毒活性,初步探究了GPX抑制黄曲霉菌产毒的作用机制。 结果表明,10、50μg/mL的GPX对黄曲霉菌产毒的抑制率分别达到70%、95%,而100、250、500、750、1000μg/mL的GPX对黄曲霉菌产毒的抑制率均可达到100%,抑制活性极其明显。GPX离体抗氧化能力很低,但是能够缓解黄曲霉菌丝的氧化胁迫。此外GPX促进了黄曲霉细胞内囊泡过早与大液泡的融合,该现象能够抑制黄曲霉毒素的产生。
黄曲霉毒素B1,香菇,纤维素,抑制作用
黄曲霉菌(Aspergillus flavus)产生的黄曲霉毒素(aflatoxin)是目前发现的毒性和致癌性最强的化学物质之一,被国际癌症研究所确定为一级人类致癌物。黄曲霉毒素通过原料、粮食产品的加工储藏,以及污染动物饲料等环节污染粮源性食品、食用油类以及畜禽类产品[1]。鉴于黄曲霉毒素污染给我国造成的重大经济损失以及对人们健康的威胁,科研人员一直在寻求能控制黄曲霉毒素污染的有效策略。
Reverberi等 报 道 香 菇(Lentinus edodes)中 的 多糖提取物能够抑制寄生曲霉(A.parasiticus)产生黄曲霉毒素。研究表明很可能是多糖提取物中的β-葡聚糖激活了与氧化胁迫反应相关的转录因子hsf-2,并且延迟了黄曲霉毒素产生相关基因aflR和norA的转录[2]。Zjalic等发现白腐菌(Trametes versicoior)产生的β-葡聚糖也能够抑制黄曲霉毒素的合成,再次展现 了 β-葡 聚 糖 在 黄 曲 霉 毒 素 控 制 中 的 应 用 前 景[3]。2009年,美国学者Chanda等提出了黄曲霉毒素黄曲霉亚细胞区域化、毒素基因表达、碳源途径的调控模型[4],随后提出了囊泡化合成释放毒素的理论模型,揭示了囊泡和大液泡在黄曲霉毒素合成、转运、输出等过程中的重要作用机制[5]。
在之前的研究中我们筛选了香菇多糖、海带多糖、石耳素等十余种多糖对黄曲霉生长及产毒的抑制作用[6]。其中发现香菇纤维素虽与花生壳纤维素结构相似,但香菇纤维素能够显著抑制黄曲霉毒素产生,而花生壳纤维素一定程度上能够促进黄曲霉菌生长及产毒。通过深入研究,我们发现了香菇纤维素的一种衍生物有着超强的抑制黄曲霉菌产毒活性。通过鉴定发现,该衍生物为单一组分的β-葡聚糖,我们将该物质命名为GPX(glycoprotein-x)。本文研究了黄曲霉菌经过GPX处理后,菌丝体的氧化系统活性变化和囊泡化现象,观察了GPX与黄曲霉菌膜的结合情况,初步探究了GPX抑制黄曲霉菌产毒的作用机制,为控制黄曲霉毒素多糖制剂的研发提供理论支持。
1 材料与方法
1.1 材料与仪器
黄曲霉菌CGMCC3.2890 购于中国普通微生物菌种保藏管理中心,PDA培养基4℃保存;沙氏液体培养基(蛋白胨1g,葡萄糖4g,蒸馏水100mL,自然pH,高压121℃灭菌15min),乙腈、单糖标准品 购于上海化学试剂公司;黄曲霉毒素B1购于美国Sigma-Aldrich公司。
DYCZ-24DN型双垂直电泳仪 北京市六一仪器厂;80i型高级多功能研究型生物显微镜 日本尼康公司;Quanta200型扫描电子显微镜 美国FEI公司;回转式恒温调速摇床 上海通特电讯设备厂。
1.2 实验方法
1.2.1 GPX提取及基本组成分析 取一定量的干香菇,粉碎,粉末水洗3~4次后挤干水分,按料液比1∶10~1∶13g/mL加入稀硫酸溶液,料液pH为1.5,于(85±5)℃下浸提1.5~2.0h,趁热过滤,热水洗涤滤渣。滤渣水洗至中性,用5%的H2O2漂白,干燥、打粉、过筛获得香菇水不溶性纤维素[7]。称取香菇水不溶性纤维素按水∶纤维素=100∶1放于三角瓶中,高压锅内121℃处理15min,趁热过滤,滤液冷冻干燥得GPX固体粉末。采用Sepharose CL-6B凝胶层析柱(1.6cm×100cm)进行柱层析测定纯度。用磷酸盐缓冲液(25℃、pH7.0)平衡,直至流出的液体的pH达到7.0,方可加样品。样品稀释至1%,上样量约为2mL,加样后用超纯水洗脱,收集器中每管约8mL,流速约为32mL/h,每次收集约60管。用苯酚硫酸法(490nm)测多糖,以考马斯亮蓝法(595nm)测定蛋白含量。最后以洗脱管数为横坐标,吸光度为纵坐标作图。
1.2.2 抑制黄曲霉菌产毒活性测定 将20mL沙氏培养基倒入50mL三角瓶中,向培养基中分别加入不同浓度的GPX溶液1mL,使得GPX浓度最终分别为0、10、50、100、250、500、750、1000μg/mL,灭菌后,每瓶分 别 加 入 预 先 稀 释 到 1 ×106CFU/mL的 孢 子 悬 浮 液100μL,置于30℃、120r/min恒速摇床中培养。培养60h后测定AFB1产量,计算毒素抑制率。抑制率(%)=(1-处理组毒素/对照组毒素)×100。
1.2.3 AFB1提取及含量测定 吸取一定量黄曲霉培养滤液,加三倍氯仿萃取,萃取液于60℃用氮吹仪吹干,溶解在甲醇中,过0.22μm微孔滤膜,然后用HPLC测定。色谱柱:COSMOSIL 5C18-MS-II Packed Column(4.6mm I.D.×250mm)(上海泉岛公司);柱温:22℃;进样量:10μL;检测波长:365nm;流动相:乙腈∶甲醇∶水(1∶1∶2,v/v/v);流速:1mL/min[8]。
1.2.4 GPX处理后黄曲霉氧化系统酶活性测定
1.2.4.1 SOD活性测定[9]分别添加5、50μg/mL GPX对黄曲霉进行处理,培养48h对照组未产毒前,分别采样。称取黄曲霉菌丝体0.3g加入到1.5mL预冷的酶提取液中,研磨匀浆,10000g,4℃离心20min。上清液用于SOD酶的活性测定。酶提取液各成分为50mmol/L磷酸钾缓冲液(pH7.0),0.2mmol/L EDTA,1.0%(w/v)PVP,0.1%TritonX-100。采用NBT(氯化硝基四氮唑兰)光还原法。吸取2.4mL 50mmol/L pH7.8磷酸缓冲液,加入0.2mL 195mmol/L硫氨酸,0.1mL 3μmol/L EDTA,0.2mL 1.125mmol/L NBT,0.1mL核 黄 素 60μmol/L,最后加入0.1mL粗酶液。加完1号管避光,其他管置于4000Lx日光灯下准确反应10min,25℃,反应结束后所有管用黑布遮盖以终止反应,避光管为对照,在波长560nm测定OD值。以每毫克蛋白在1mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位。
1.2.4.2 CAT活性测定[10]配制0.3%H2O2溶液作为底物溶液:吸5mL 30%H2O2,用0.05mol/L pH=7.0磷酸缓冲溶液(PBS)定容到500mL。 反应体系包含1mL 0.3%H2O2溶 液 、1.9mL H2O、0.1mL 酶 液 ,测 定OD240nm降低速度。将每毫克蛋白每分钟OD减少0.01定义为1个活力单位。
1.2.4.3 H2O2测定 使用100μg/mL GPX处理过的黄曲霉及对照组经过12、24、48h、72h的培养,分别采样。称取约0.1g的黄曲霉菌丝,置于1.5mL含1mmol/L盐酸羟胺的磷酸盐缓冲液中。10,000g离心10min,0.5mL上清液与1.5mL含0.1%TiCl4的20%H2SO4充分混合后,10,000g离心10min,在410nm处测定上清液吸光度值[9]。H2O2的消光系数采用0.28L·mol-1·cm-1。
1.2.4.4 脂质过氧化分析[11]MDA的浓度可作为黄曲霉细胞脂质过氧化指标。使用100μg/mL GPX处理过的黄曲霉及对照组经过12、24、48、72h的培养,分别采样。在8000×g离心10min收集样液中藻细胞,然后在2mL含有10%三氯乙酸中均质。匀浆在8000×g离心10min,吸取2mL的上清液,与2mL的TBA溶液混合。混合液在95℃加热30min,然后迅速冷却。随后在5000×g离心10min,上清液在532nm测其吸光度,在600nm纠正非特异吸光度。MDA含量计算依据公式:C=6.45(OD532-OD600)-0.56OD450
1.2.5 GPX造成黄曲霉细胞液泡化研究 沙氏培养基 添 加100μg/L GPX,接 种 黄 曲 霉 孢 子 液 ,设 置 对照组,30℃,120r/min培养60h后,对照组黄曲霉产毒,处理组没有毒素产生,分别挑取菌丝在显微镜下观察。
1.2.6 GPX与细胞膜结合实验 取正常培养未产毒的黄曲霉菌丝,滤纸吸干,用100μg/mL GPX处理,之后过滤,用蒸馏水冲洗3次,滤纸吸干,取处理后菌丝与未处理菌丝分别用环境扫描电镜进行观测。
2 结果与分析
2.1 GPX基本组成分析
经过测定发现GPX主要含多糖和蛋白质,含量分别为82%和18%。经过凝胶柱分离,采用考马斯亮蓝法和苯酚硫酸法分别测定吸光度值,得到单一峰形(见图1)。而且多糖峰和蛋白峰基本重合,由此推测GPX很有可能为一种糖蛋白组分,为单一的香菇纤维素衍生物,纯度较高。

图1 GPX凝胶柱谱图Fig.1 Gel column chromatogram of GPX
2.2 GPX抑制黄曲霉菌产毒活性测定
不同浓度的GPX加入到培养基中,接种黄曲霉60h,分别测定黄曲霉毒素含量。与对照组相比,10、50μg/mL GPX 对 黄 曲 霉 菌 产 毒 的 抑 制 率 分 别 达 到70%、95%,而 100、250、500、750、1000 μg/mL 的GPX对黄曲霉菌产毒的抑制率均达到100%(见图2),抑制活性极显著。
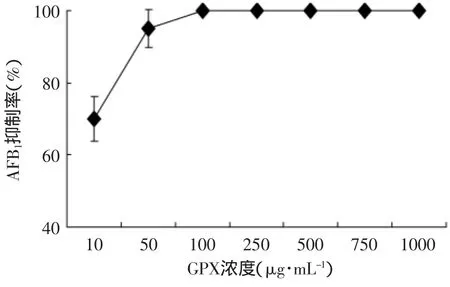
图2 不同浓度的GPX对黄曲霉产毒的抑制率Fig.2 Inhibition of aflatoxin production by GPX at different concentrations
2.3 GPX处理后黄曲霉氧化系统酶活性分析
2.3.1 SOD、CAT酶活性测定 SOD、CAT等组成机体清除ROS的保护酶系统。SOD是清除自由基的关键抗氧化酶之一,对机体的氧化和抗氧化平衡起着至关重要的作用;而CAT则能清除H2O2。如图3所示,分别 用5、50μg/mL GPX对 黄 曲 霉 进 行 处 理48h后 ,对SOD、CAT同工酶活性测定发现随着GPX处理浓度的增高,SOD、CAT活性也有一定程度的升高。
2.3.2 黄曲霉H2O2与脂质过氧化分析 有研究表明多糖能够缓解黄曲霉毒素对肝脏细胞的毒害,其机制与 抑 制 活 性 氧 的 形 成 缓 解 细 胞 的 氧 化 胁 迫 有 关[12]。黄曲霉菌体内的氧化还原状态被证实与产毒密切相关[13]。GPX是一种多糖,我们研究发现其并不具有良好的抗氧化能力。H2O2是黄曲霉内主要的ROS之一,丙二醛(MDA)含量的高低代表机体遭受氧化胁迫的程度。由图4可知,与对照组相比,GPX处理过的黄曲霉经过12、24、48h的培养后,H2O2和MDA值均有不同程度的下降,可见GPX处理能够激活抗氧化系统,缓解黄曲霉菌的氧化胁迫状态。

图3 5、50μg/mL GPX处理后,对黄曲霉CAT、SOD活性的影响Fig.3 Effects of the treatment with 5μg/mL and 50μg/mL GPX on the activities of CAT and SOD in A.flavus
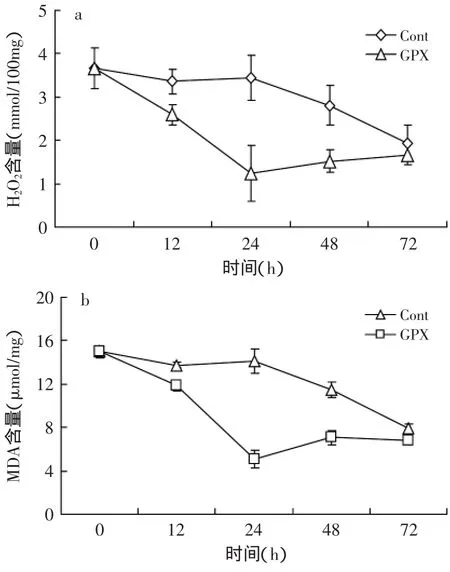
图4 GPX处理对黄曲霉体内H2O2水平和MDA水平的影响Fig.4 Effects of the treatment with GPX on the levels of H2O2and MDA in A.flavus
2.4 GPX造成黄曲霉细胞液泡化研究
研究表明黄曲霉毒素合成最后几步是在囊泡(vesicle)里完成的,然后通过囊泡运输到胞外,通过胞吐作用释放毒素[5]。囊泡融合成液泡,会导致合成酶发生降解,不利于毒素的合成。50μg/mL GPX处理48h后的黄曲霉菌丝在显微镜下观察,如图5所示,黄曲霉菌细胞内液泡化严重,而对照组菌丝细胞内几乎没有大液泡形成。囊泡被大液泡吞噬合并后,黄曲霉毒素合成转运、释放均受到阻碍。GPX很可能是促进了黄曲霉细胞内囊泡过早与大液泡的融合,从而抑制了黄曲霉毒素的产生。大液泡的形成与VeA蛋白复合体密切相关,而该复合体还参与了毒素合成相关基因的调控,因此GPX对黄曲霉产毒的抑制应该是多元化的。

图5 GPX处理导致的黄曲霉菌丝囊泡化(1000×)Fig.5 Vacuole formation in the mycelia of A.flavus exposed to GPX
2.5 GPX在菌丝表面的聚合
由图6可见,GPX可以在黄曲霉菌丝表面发生聚合,并形成了一种网状包被结构。由于GPX分子量较大,难以透过细胞膜进入黄曲霉细胞内部引起代谢调控,更有可能的是黄曲霉菌膜表面存在GPX结合受体,通过受体介导了黄曲霉毒素的代谢。已有研究发现黄曲霉菌丝膜上存在GPCR(G蛋白偶联受体),能够识别不同碳源,与黄曲霉产毒密切相关[14],GPX是否是通过与GPCR互作抑制黄曲霉产毒有待于进一步的研究。

图6 通过扫描电镜观察GPX在黄曲霉菌丝表面的聚合(4000×)Fig.6 Aggregation of GPX on the surface of mycelia of A.flavus under the scanning electronic microscope(4000×)
3 结论
研究表明,香菇纤维素的衍生物(GPX)具有很强的抑毒活性,10、50μg/mL的GPX对黄曲霉菌产毒的抑制率分别达到70%、95%,而100、250、500、750、1000μg/mL的GPX对黄曲霉菌产毒的抑制率均达到100%,可以用来作为食品或者饲料的添加剂控制黄曲霉毒素污染。GPX能够缓解黄曲霉菌丝的氧化胁迫,同时可以促进黄曲霉细胞内囊泡过早与大液泡的融合,为控制黄曲霉毒素污染的多糖制剂的研发提供了理论基础。
[1]郭耀东,陈璐,袁亚宏,等.基于概率分析的玉米食品中黄曲霉毒素B1膳食暴露及风险评估[J]. 食品科学,2013,34(11):24-27.
[2]M Reverberi,S Zjalic,A Ricelli,et al.Oxidant/antioxidant balance in Aspergillus parasiticus affects aflatoxin biosynthesis [J].Mycotoxin Research,2006,22(1):39-47.
[3]Zjalic S,Reverberi M,Ricelli A,et al.Trametes versicolor:A possible tool for aflatoxin control[J].International Journal of Food Microbiology,2006,107(3):243-249.
[4]Chanda A,Roze LV,Kang S,et al.A key role for vesicles in fungal secondary metabolism[J].Pnas,2009,106 (46):19533-19538.
[5]Chanda A,Roze LV,Linz JE.A possible role for exocytosis in aflatoxin export in aspergillus parasiticus[J].Eukaryotic Cell,2010,9(11):1724-1727.
[6]李红波,胡梁斌,王淼焱,等.几种多糖对黄曲霉菌生长及产毒的抑制作用[J]. 江西农业学报,2011(5):82-84
[7]詹耀才,钟细娥,高展炬.麦麸加工下脚料提取纤维素、半纤维素的工艺研究[J]. 粮食加工,2008,33(6):28-30.
[8]Moyne A L,Cleveland T E,Tuzun S.Molecular characterization and analysis of the operon encoding the antifungal lipopeptide bacillomycin D[J].FEMS Microbiology Letters,2004,234(1):43-49.
[9]Jana S , Choudhuri MA.Glycolate metabolism of three submersed aquatic angiosperms during ageing[J].Aquatic Botany,1982,12:345-354.
[10]Yan-Feng XUE,Ling LIU,Zhao-Pu LIU,et al.Protective role of Ca against NaCl toxicity in Jerusalem artichoke by upregulation of antioxidant enzymes[J].Pedosphere,2008,18(6):766-774.
[11]Chia-Tai Shiu,Tse-Min Lee.Ultraviolet-B-induced oxidative stress and responses of the ascorbate-glutathione cycle in a marine macroalga Ulva fasciata[J].Journal of Experimental Botany,2005,56(421):2851-2865.
[12]Pourahmad J,Shaki F,Tabakosazan F,et al.Protective effects of fungal β-(1→3)-D-glucan against oxidative stress cytotoxicity induced by depleted uranium in isolated rat hepatocytes[J]. Human&Experimental Toxicologyhttp,2011,30(3):173-181.
[13]Reverberi M,Zjalic S ,Ricelli A ,et al.Modulation of antioxidant defense in Aspergillus parasiticus is involved in aflatoxin biosynthesis:a role for the ApyapA gene[J].Eukaryot Cell,2008,7(6):988-1000.
[14]D R Georgianna,G A Payne.Genetic regulation of aflatoxin biosynthesis:from gene to genome[J].Fungal Genetics and Biology,2009,46(2):113-125.
Study on mushrooms vellulose ferivatives inhibiting aflatoxin production by Aspergillus flavus
LI Hong-bo1,2,WANG Miao-yan2,HU Liang-bin2,*,MO Hai-zhen2,PAN Dao-dong1
(1.School of Marine Sciences,Ningbo University,Ningbo 315211,China)2.College of Food Science,Henan Institute of Science&Technology,Xinxiang 453003,China)
Aflatoxin is well known with considerable adverse effects including the induction of genetic mutation ,liver cancer and the suppression of the immune system on human and animal.Control of aflatoxin contamination is a worldwide problem.Mechanism involved in the aflatoxin-production inhibition by Lentinus edodes cellulose derivatives GPX was investigated.The results showed that inhibition rates of toxin production by 10 and 50μg/mL of the GPX were 70%and 95%,respectively.More GPX (100,250,500,750,1000μg/mL) gave the rise to complete inhibition of toxin production.Without high antioxidant activity in vitro,GPX could modify oxidative stress in A.flavus.In addation,GPX was found to promote premature fusion of vesicles and formation of vacuole in A.flavus,which was proved association with the inhibition of aflatoxin production.
aflatoxin B1;Lentinus edodes;cellulose;inhibition
TS201
A
1002-0306(2014)20-0174-04
10.13386/j.issn1002-0306.2014.20.029
2014-03-11
李红波(1987-),男,博士,研究方向:黄曲霉毒素代谢及控制。
* 通讯作者:胡梁斌(1979-),男,博士,副教授,主要从事天然产物活性方面的研究。
国家自然科学基金青年科学基金项目(31101231)。

