低氧联合高脂饮食对SD大鼠心肌内皮型一氧化氮合酶/一氧化氮的影响*
赵艳霞,李玉红,王亚平,杨应忠,马兰,格日力
低氧联合高脂饮食对SD大鼠心肌内皮型一氧化氮合酶/一氧化氮的影响*
赵艳霞,李玉红,王亚平,杨应忠,马兰,格日力
目的:本研究旨在探讨低氧联合高脂饮食对SD大鼠心肌内皮型一氧化氮合酶(eNOS)/一氧化氮(NO)的影响及其可能机制。
低氧;高脂饮食;内皮型一氧化氮合酶;一氧化氮
(Chinese Circulation Journal, 2014,29:723.)
一氧化氮(NO)是一氧化氮合酶(NOS)催化产生的一种细胞信号分子,具有扩张血管、抑制平滑肌细胞增殖、抑制血小板聚集等作用,可调节心血管张力、维持血管稳态,调控心肌细胞收缩、氧耗、肥大和凋亡等。因而NO对心肌正常结构和功能有多重保护作用[1-2]。一氧化氮是高原适应与习服的重要指标[3],高原世居藏族循环血中NO代谢产物高于低海拔人群的水平,可增加血流灌注及氧传递,以抵消低氧影响[4],而机体NO含量降低则可引起高原适应不良。高脂血症亦影响NO含量[5],慢性低氧可引起血脂异常[6]。高脂血症对低氧环境(高原环境及慢性低氧性疾病)人群心肌存在怎样的影响尚不十分明确。本研究分析高脂饮食对低氧环境SD大鼠心肌组织内皮型一氧化氮合酶(eNOS)/一氧化氮(NO)的影响,并探讨其可能机制。
1 材料与方法
1.1实验材料
实验动物:60只6周龄,体重180~200 g,清洁级雄性SD大鼠(中国药科大学提供)随机分为三组(每组20只):常氧组(南京,海拔10米)、低氧组(模拟海拔5000米,低压氧舱)、低氧联合高脂饮食组(模拟海拔5000米,低压氧舱),低氧联合高脂饮食组大鼠灌服脂肪乳剂(10 ml/(kg.d),1次/天),另外两组大鼠灌服等体积生理盐水,普通饮食。于实验4周末取材,抽取大鼠外周静脉血置于乙二胺四乙酸二钾(EDTAK2)抗凝管,留取心肌标本于-80℃冰箱保存。
主要仪器和试剂:低压氧舱室(贵州风雷航空机械有限公司,DYC-3000),BC-2300全自动血细胞分析仪(深圳迈瑞生物医疗电子有限公司),ABI7500荧光实时定量PCR仪(美国,ABI公司),分光光度计(北京元业伯乐科技发展有限公司),DU800核酸蛋白仪、冷冻离心机(德国,BECKMAN),高速组织匀浆机(德国,Miccra D-8)。一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(南京建成生物公司),血脂检测试剂盒(北京利德曼生化股份有限公司),BCA蛋白分析试剂盒(USA Pierce Chemical Company),离心柱型-总RNA提取试剂盒(天根生化科技有限公司),eNOS及β肌动蛋白(β-actin)一抗(美国,Abcam公司),二抗(美国,Santa Cruz Biotechnology lnc公司),无创血压计—鼠仪(BP2010AUL,北京软隆科技有限责任公司)
脂肪乳剂:脂肪乳剂制备参考文献[7],取猪油25 g放于200 ml烧杯内,置磁力搅拌器上加热至100℃,加胆固醇10 g,溶化, 再加丙基硫氧嘧啶1 g,然后加25 g吐温80,充分搅匀制成油相。于另一200 ml烧杯中加蒸馏水30 ml、丙二醇20 ml,加热至60 ℃,然后加脱氧胆酸钠2 g,充分搅拌至完全溶解,制成水相。将水相加入油相,充分混匀,即成脂肪乳剂。
1.2测量指标
①心肌病理形态观察:取心肌标本固定,脱水,包埋,切片,苏木精伊红(HE)染色,观察心肌病理形态改变。②静脉全血血红蛋白浓度测定:使用血细胞分析仪检测静脉全血血红蛋白浓度。③血浆丙二醛含量和超氧化物歧化酶活力测定:将抗凝血离心(3000 r/min)10 min,分离血浆,用TBA比色法测定MDA含量[8],WST-1法测定SOD活力[9]。④血脂水平检测:采用终点法检测血浆总胆固醇(TCH)及甘油三酯(TG)含量,直接测定法检测血浆高密度脂蛋白(HDL)和低密度脂蛋白(LDL)含量[10]。⑤心肌硝酸盐/亚硝酸盐(NOX)水平检测:采用硝酸还原酶法检测心肌NOX水平[11],间接反映心肌NO含量。⑥心肌eNOS mRNA水平检测:用离心柱法提取总RNA,按照TaKaRa FastQuant RT Kit说明逆转录合成cDNA,引物序列为eNOS[12]上游:5'-CTACCGGGACGAGGTACTGG-3',下游:5'-GGAAAAGGCGGTGAGGACTT-3',β-actin[13]上游:5'-AGTGTGACGTTGACATCCGT-3',下游:5'-GACTCATCGTACTCCTGCTT-3'。 ⑦ Realtime PCR反应体系(20 μl):灭菌双蒸水7.2 μl,2×SYBR Select Master Mix 10 μl,上、下游引物各0.4 μl,cDNA 2 μl。于PCR仪中进行,每样品设3个重复孔,目的基因和内参基因的PCR反应条件一致,Holding stage:50℃ 2 min,95℃ 2 min;Cyclingstage:95℃ 15 s,60℃ 1 min,40个循环。用ABI Prism 7500软件采集并分析数据,采用2-△△Ct法计算。⑧心肌eNOS蛋白水平检测:将心肌组织切成小块,加入蛋白裂解液裂解组织、匀浆、离心,取上清液,用BCA蛋白分析试剂盒检测样品总蛋白浓度[14]。提取蛋白用5×蛋白上样缓冲液于100℃变性5 min。用12%SDS-PAGE电泳分离蛋白,每泳道上样蛋白量为80 μg。用半干转印槽(BioRad,USA)转印蛋白至PVDF膜上,之后用5%脱脂奶粉室温下封闭2 h,分别加入兔抗eNOS(1:250),兔抗β-actin(1:1000),于4℃孵育过夜。洗膜后加入经辣根过氧化物酶标记的羊抗兔二抗(1:6000),室温孵育2 h,之后使用ECL液发光显影,扫描胶片后,采用Image J软件对凝胶图像蛋白表达条带积分光密度值进行分析,并计算eNOS与β-actin条带积分光密度值的相对比值。
1.3统计学处理
采用SPSS 17.0软件进行统计分析。数据用均数±标准差表示。多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
心肌病理形态变化:常氧组心肌结构正常,心肌细胞平行排列,核位于中央,胞内可见清楚的横纹; 低氧组心肌细胞增大,横纹结构不明显,胞浆疏松,有空泡,细胞间隙增宽,间质大量充血,内皮细胞肿胀;低氧联合高脂饮食组心肌细胞排列紊乱,横纹结构不清,胞浆疏松,局部细胞出现自溶现象,心肌细胞内及肌束间出现大小不一中等量空泡,间质充血。图1

图1 心肌病理形态变化
静脉血红蛋白浓度测定:全自动血细胞分析仪测定大鼠静脉血红蛋白浓度,结果显示低氧组组与低氧联合高脂饮食组大鼠静脉血红蛋白浓度[(225.88±45.26) g/L,(196.88±34.11) g/L]明 显 高于常氧组 (144.63±13.13) g/L,差异有统计学意义(P<0.01),说明低压氧舱模拟海拔5000米建造慢性重度低氧大鼠模型成功,模型可用于实验研究。
血脂水平检测:血脂检测结果显示低氧联合高脂饮食组TC、LDL含量[(2.36±0.22) mmol/L,(0.91±0.04)mmol/L]明显高于常氧组[(1.56±0.10)mmol/L,(0.25±0.03) mmol/L]与低氧组[(1.55±0.10)mmol/L,(0.26±0.03) mmol/L],差异有统计学意义(P<0.01)。低氧组与低氧联合高脂饮食组的HDL含量[(0.37±0.05) mmol/L,(0.36±0.04) mmol/L]明显低于常氧组[(0.65±0.07) mmol/L],差异有统计学意义(P<0.01);三组间TG水平[常氧组(0.61±0.07)mmol/L,低氧组(0.54±0.06) mmol/L,低氧联合高脂饮食组(0.54±0.08) mmol/L] 差异无统计学意义。图2
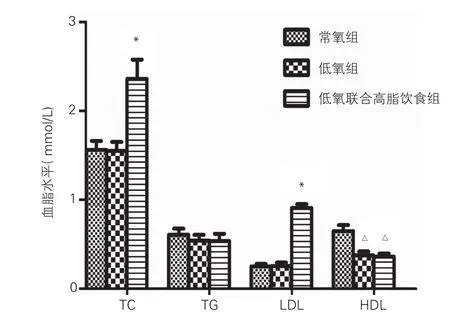
图2 三组大鼠的血脂水平变化
心率、血压测定:心率检测结果显示低氧联合高脂饮食组大鼠心率[(325.25±57.04)次/min]明显低于常氧组[(479.35±25.35)次/min]与低氧组[(465.69±22.95) 次/min,P<0.01];常氧组与低氧组大鼠心率无明显差异。血压检测结果显示各组大鼠收缩压/舒张压[常氧组、低氧组及低氧联合高脂饮食组的收缩压/舒张压分别为(120.56±13.44)/(93.63±11.84) mmHg,(122.13±5.08)/(95.06±5.41)mmHg,(114.63±15.63)/(89.38±16.47)mmHg,1 mmHg=0.133 kPa]差异均无统计学意义。
血浆丙二醛水平、超氧化物歧化酶活力的测定:MDA含量检测结果显示,低氧组大鼠静脉血MDA含量[(6.49±0.87) nmol/ml]明显高于常氧组[(4.39±0.7 )nmol/ml]与低氧联合高脂饮食组[(4.31±1.73) nmol/ml],差异有统计学意义(P<0.01);常氧组与低氧联合高脂饮食组MDA含量无明显差别。三组大鼠血浆SOD活力测定结果显示,与常氧组[(167.02±8.38) U/ml]比较,低氧组[(178.79±16.85) U/ml]与低氧联合高脂饮食组[(163.89±8.16) U/ml]的SOD活力无明显变化,而与低氧组比较,低氧联合高脂饮食组的SOD活力明显降低(P<0.05),差异有统计学意义。
心肌NOx水平测定:三组大鼠心肌NOx含量检测结果显示,低氧组[(4.63±1.15)μmol/gprot]与低氧联合高脂饮食组[(1.19±0.57)μmol/gprot]大鼠NOx含量明显低于常氧组[(19.00±1.95)μmol/gprot],低氧联合高脂饮食组NOx含量明显低于低氧组(P<0.05),差异有统计学意义。
心肌一氧化氮合酶mRNA水平测定:荧光实时定量检测eNOS mRNA表达水平,采用2-△△Ct法计算, 低氧组(1.79±0.31)与低氧联合高脂饮食组(2.33±0.80)eNOS mRNA表达水平明显高于常氧组(1.04±0.32),差异有统计学意义(P<0.05)。而与低氧组比较,低氧联合高脂饮食组eNOS mRNA表达水平无明显变化。
心肌一氧化氮合酶蛋白表达水平测定:三组大鼠心肌eNOS 蛋白表达水平检测结果显示,低氧组与低氧联合高脂饮食组eNOS 蛋白表达水平(0.78±0.08,0.74±0.07)明显高于常氧组(0.52±0.11),差异有统计学意义(P<0.05),而低氧组与低氧联合高脂饮食组eNOS 蛋白表达水平无明显变化。图3

图3 蛋白印迹法测定三组大鼠心肌一氧化氮合酶蛋白表达水平
3 讨论
本研究通过检测心肌eNOS mRNA与蛋白表达及NOx含量(间接反映NO含量),探讨低氧联合高脂饮食对SD大鼠心肌eNOS/NO的影响及其机制。结果显示,相对于常氧组,低氧组与低氧联合高脂饮食组心肌eNOS mRNA及蛋白表达水平明显升高,但二者间无显著差别;相对于低氧组,低氧联合高脂饮食组心肌NOx含量明显降低,血浆TC及LDL明显升高,血浆膜脂质过氧化产物MDA和SOD活力降低,表明高脂饮食加重了低氧环境大鼠心肌损伤。
低氧组大鼠心肌NOx含量明显低于常氧组,表明慢性重度低氧(于低压氧舱模拟海拔5 000米)降低心肌NOx含量,该结果与以往研究一致[15]。一氧化氮是高原适应与习服的重要指标[3],高原世居藏族循环血中NO代谢产物高于低海拔人群的水平,可增加血流灌注及氧传递,以抵消低氧影响[4]。而NOx含量降低加重内环境低氧,因心肌NOx含量降低影响血管内皮细胞功能,使其释放的缩血管物质增多,扩血管物质减少,血管收缩及舒张功能障碍,心肌舒张异常,使心肌供血减少,引起心脏结构和功能损伤[16]。低氧联合高脂饮食组心肌NOx含量明显低于低氧组,联合因素致使NO含量进一步降低,减弱其对心血管的保护作用,加重低氧对心血管损伤。提示对于身处慢性重度低氧环境或患低氧性疾病人群,高脂血症可能是其心肌损伤加重的独立危险因素,应予以预防和治疗。
本实验中低氧联合高脂饮食组大鼠血浆TCH及LDL明显高于低氧组,血浆TCH及LDL浓度升高可诱导小窝蛋白,降低eNOS从质膜上解离,从而降低eNOS酶活性[17],即eNOS蛋白及mRNA表达不降低而NO产生减少的原因之一。另外,血脂异常可引起机体抗氧化能力降低,即反映抗氧化作用的指标SOD活力降低。SOD可清除机体代谢过程中产生的超氧阴离子等过氧化物。超氧阴离子等可引起eNOS脱偶联。eNOS脱偶联即eNOS不再是同源二聚体结构,而是单体结构,使其不再产生NO,而生成的超氧阴离子可氧化NO为过氧亚硝基阴离子,后者氧化性更强,可氧化eNOS辅因子使其数量减少或功能障碍,导致更多的eNOS脱偶联,进而降低NO的生成[18]。此外,超氧阴离子可与NO反应,直接清除NO,降低NO水平与生物利用度。SOD可清除过氧化物而保持NO的含量及作用。本研究中低氧组大鼠血浆氧化压力指标MDA含量升高,即单纯低氧可通过氧化压力升高降低NO含量[15];低氧联合高脂饮食组大鼠血浆MDA含量未高于常氧组,即复合因素并未引起氧化压力的叠加,而血浆SOD活力明显降低,减弱了其对心血管有益因子NO的保护,这可能是高脂饮食加重低氧环境大鼠心肌NO损伤的原因。既往研究也证实血脂异常引起抗氧化能力降低,引起内皮损伤,导致心血管疾病[19];内源性产生或外源性补充SOD可降低内皮氧化应激损伤,改善血管内皮功能及心肌结构[20,21]。
低氧联合高脂饮食组大鼠心肌NO降低的同时,心率明显降低,与既往研究结果一致,即内源性NO含量与心率呈正相关[22]。本研究中,低氧联合高脂饮食组大鼠血压与其他两组比较无明显变化,心率的降低可能引起该组大鼠心肌灌注减少,加重心肌缺氧。
综上所述,本研究结果显示相对于单纯低氧,联合高脂饮食大鼠抗氧化能力降低,心肌NOx损伤加重,提示长期高脂饮食可能是慢性重度低氧环境下心肌损伤加重的独立危险因素,抗氧化能力降低可能是其主要原因,应积极干预和治疗。在本研究中由于NO半衰期短和实验条件限制,采用目前常用的研究方法,即测定NOx间接反映NO含量,但NOx不能区分被过氧化物清除的NO(硝酸盐与亚硝酸盐)与有生物活性的NO;另外,大鼠与人体之间存在一定差异,所以本研究结果不能完全反映慢性重度低氧联合高脂饮食对人心肌的影响,这些不足之处有待在进一步的研究中完善解决。
[1] Vanhoutte PM. How we learned to say NO. Arterioscler Thromb Vasc Biol, 2009, 29: 1156-1160.
[2] Rastaldo R, Pagliaro P, Cappello S, et al. Nitric oxide and cardiac function. Life Sci, 2007, 81: 779-793.
[3] Janocha AJ, Koch CD, Tiso M, et al. Nitric oxide during altitude acclimatization. N Engl J Med, 2011, 365: 1942-1944.
[4] Erzurum SC, Ghosh S, Janocha AJ, et al. Higher blood flow and circulating NO products offset high-altitude hypoxia among Tibetans. Proc Natl Acad Sci USA, 2007, 104: 17593-17598.
[5] 孔宏亮, 齐国先, 姚宇, 等. 低高密度脂蛋白胆固醇血症患者血浆一氧化氮合酶和一氧化氨水平相关性研究. 中国循环杂志, 2006, 21: 198-201.
[6] Savransky V, Jun J, Li J, et al. Dyslipidemia and atherosclerosis induced by chronic intermittent hypoxia are attenuated by deficiency of stearoyl coenzyme A desaturase. Circ Res, 2008, 103: 1173-1180.
[7] Zhao LY, Huang W, Yuan QX, et al. Hypolipidaemic effects and mechanisms of the main component of Opuntia dillenii Haw. polysaccharides in high-fat emulsion-induced hyperlipidaemic rats. Food Chem, 2012, 134: 964-971.
[8] Schmedes A, Hølmer G. A new thiobarbituric acid (TBA) method for determining free malondialdehyde (MDA) and hydroperoxides selectively as a measure of lipid peroxidation. J Am Oil Chem Soc, 1989, 66: 813-817.
[9] Peskin AV, Winterbourn CC. A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1). Clin Chim Acta, 2000, 293: 157-166.
[10] 刘永英, 王多宁, 刘渊声, 等. 花椒籽仁油对实验性高脂血症大鼠的防治作用. 第四军医大学学报, 2007, 28, 411-413.
[11] Miranda KM, Espey MG, Wink DA. A rapid, simple spectrophotometric method for simultaneous detection of nitrate and nitrite. Nitric oxide, 2001, 5: 62-71.
[12] Simic B, Hermann M, Shaw SG, et al. Torcetrapib impairs endothelial function in hypertension. Eur Heart J, 2012, 33: 1615-1624.
[13] Majhi CR, Khan S, Leo MDM, et al. Effects of acetaminophen on reactive oxygen species and nitric oxide redox signaling in kidney of arsenic-exposed rats. Food Chem Toxicol, 2011, 49: 974-982.
[14] Walker JM. The bicinchoninic acid (BCA) assay for protein quantitation//The Protein Protocols Handbook. Humana Press, 2009, 11-15.
[15] Singh M, Padhy G, Vats P, et al. Hypobaric hypoxia induced arginase expression limits nitric oxide availability and signalling in rodent heart. Biochim Biophys Acta, 2014, 1840: 1817-1824.
[16] Husain K, Hazelrigg SR. Oxidative injury due to chronic nitric oxide synthase inhibition in rat: effect of regular exercise on the heart. Biochim Biophys Acta, 2002, 1587: 75-82.
[17] Grayson TH, Chadha PS, Bertrand PP, et al. Increased caveolae density and caveolin-1 expression accompany impaired NO-mediated vasorelaxation in diet-induced obesity. Histochem Cell Biol, 2013, 139: 309-321.
[18] 曹路, 黄体钢, 杨万松, 等. 对内皮细胞产生超氧阴离子作用的研究. 中国循环杂志, 2009: 137-140.
[19] Cai H, Harrison DG. Endothelial dysfunction in cardiovascular diseases: the role of oxidant stress. Circ Res, 2000, 87: 840-844.
[20] Mugge A, Elwell JH, Peterson TE, Hofmeyer, et al. Chronic treatment with polyethylene-glycolated superoxide dismutase partially restores endothelium-dependent vascular relaxations in cholesterol-fed rabbits. Circ. Res, 1991, 69: 1293-1300.
[21] Carillon J, Rugale C, Rouanet JM, et al. Endogenous antioxidant defense induction by melon superoxide dismutase reduces cardiac hypertrophy in spontaneously hypertensive rats. Int J Food Sci Nutr, 2014: 65: 602-608.
[22] Pagliaro P, Valle RD, Gattullo D, et al. The heart rate after inhibition of nitric oxide release in the anaesthetized dog. Gen Pharmacol, 1996, 27: 695-699.
Effect of Combined Hypoxia and High Fat Diet on eNOS/NO of Myocardium in Experimental Rats
ZHAO Yan-xia, LI Yu-hong, WANG Ya-ping, YANG Ying-zhong, MA Lan, GE Ri-li.
Medical College of Qinghai University, Xining (810001), Qinghai, China
GE Ri-li, Email: geriligao@hotmail.com
Objective: To investigate the effect of combined hypoxia and high fat diet (HFD) on endothelial nitric oxide synthase (eNOS)/nitric oxide (NO) of myocardium in experimental rats with its possible mechanisms.Methods: A total of 60 male SD rats were randomly divided into 3 groups, n=20 in each group. Control group, the rats were fed by normal diet with normal oxygen condition. Hypoxia group, the rats were fed by normal diet with simulated 5000m altitude oxygen condition. Combined hypoxia and HFD (H+HFD) group, the rats were fed by HFD and simulated 5000m altitude oxygen condition. All animals were treated for 4 weeks and peripheral blood and myocardium specimen were collected. Hemoglobin was examined by automatic blood cell analyzer, plasma malondialdehyde (MDA) was measured by TBA method, superoxide dismutase (SOD) activity was detected by WST-1 method, mRNA and protein expressions of eNOS were examined by real time PCR and Western blot analysis respectively, the myocardium nitrates and nitrites (NOx) was measured by nitrate reductase method.Results: Compared with Control group, Hypoxia group and H+HFD group had increased mRNA and protein expressions of eNOS, H+HFD group had lower NOx levels than the other 2 groups P<0.05. Compared with Hypoxia group, H+HFD group showed obviously increased total cholesterol, LDL-cholesterol and decreased SOD activity, diseased MDA level P<0.05.Conclusion: Upon hypoxia alone, H+HFD may further reduce NOx level of myocardium, it implies aggravated chronichypoxia impairment, which might be related to dyslipidemia and lack of anti-oxidative ability in experimental rats.
Hypoxia; High fat diet; Endothelial nitric oxide synthase; Nitric oxide
2014-03-28)
(助理编辑:许菁)
国家自然科学基金资助项目(31160219);国家国际合作项目(2011DFA32720);国家973 计划项目(2012CB518200)
810001 青海省西宁市 青海大学医学院
赵艳霞 讲师 硕士 主要从事心血管病基础研究 Email: zhaoyanxia--03@163.com 通讯作者:格日力 Email: geriligao@hotmail.com
R363.16
A
1000-3614(2014)09-0723-05
10.3969/j.issn.1000-3614.2014.09.017
方法:雄性SD大鼠60只随机分为三组,常氧组(南京,海拔10米)、低氧组(低压氧舱,模拟海拔5000米)、低氧联合高脂饮食组(低压氧舱,模拟海拔5000米),经普通饮食或高脂饮食4周后,留取外周血和心肌标本,用全自动血细胞分析仪检测静脉血血红蛋白浓度,TBA比色法检测血浆丙二醛含量,WST-1法检测超氧化物歧化酶活力,直接检测法和终点法检测血脂含量,荧光实时定量聚合酶链反应(PCR)检测心肌eNOS mRNA水平,蛋白印迹(Western blot)法检测心肌eNOS 蛋白水平,硝酸还原酶法检测心肌NO代谢产物硝酸盐/亚硝酸盐(NOX)水平。
结果:低氧组及低氧联合高脂饮食组心肌eNOS mRNA及蛋白水平明显高于常氧组(P<0.05),低氧联合高脂饮食组心肌NOx水平明显低于其他两组(P<0.05);与低氧组比较,低氧联合高脂饮食组血浆总胆固醇及低密度脂蛋白水平明显升高(P<0.05),血浆超氧化物歧化酶活力及丙二醛含量明显降低(P<0.05),差异有统计学意义。
结论:相对于单纯低氧,联合高脂饮食进一步降低大鼠心肌NOx水平,提示高脂饮食加重慢性重度低氧对心肌的损伤,其机制可能与血脂异常及抗氧化能力不足有关。

