瑞舒伐他汀对糖尿病合并轻度肾功能不全患者介入诊治术后尿蛋白的影响
李晶,韩雅玲,陈绍良,曾秋棠,马业新,江洪,王效增,李毅,徐凯
他汀类药物抗炎、抗氧化、保护内皮功能的作用在心血管及肾脏疾病的治疗中已得到广泛应用[1]。2010年欧洲血运重建指南将他汀类药物推荐为慢性肾脏病(chronic kidney disease,CKD)患者对比剂诱导的急性肾损伤(contrast-induced acute kidney injury,CIAKI)的预防用药(ⅠA类)[2]。但近期一些研究对他汀能否预防CIAKI的发生上仍存在较大争议[3-8],且有研究认为,他汀可能通过抑制受体介导的胞吞作用来阻碍近端肾小管对蛋白的重吸收作用,导致蛋白尿的发生[9]。因此,本研究纳入2型糖尿病(T2DM)合并CKD 2期[估算肾小球滤过率(estimated glomerular filtration rate,eGFR)60~89ml/(min·1.73m2)的患者],选取目前市场上调脂作用最强的他汀类药物瑞舒伐他汀[10]进行围术期干预治疗,通过监测围术期血清肌酐值(Scr)、尿肌酐、尿微量白蛋白值的变化,探讨介入诊治围术期短期应用瑞舒伐他汀是否增加患者蛋白尿发生的风险,进一步认识他汀药物在肾脏疾病中应用的安全性,客观评估其对肾脏损害的可能性。
1 资料与方法
1.1 研究类型 瑞舒伐他汀预防T2DM合并轻中度肾功能不全患者急性肾功能损害的前瞻性、多中心、随机对照临床研究(rosuvastatin prevent contrastinduced acute kidney injury in patients with diabetes concomitant with mild to moderate renal insufficiency,TRACK-D)[11][美国国立健康研究所(NIH)研究注册号:NCT00786136],由沈阳军区总医院心血管内科韩雅玲教授设计并牵头,于2008年12月-2011年10月入选国内53家中心行冠脉造影或外周血管造影以及介入治疗的T2DM合并轻度中度肾功能不全患者2998例[12]。本研究为TRACK-D研究的子课题。
1.2 研究对象 本研究选取TRACK-D研究中的T2DM合并CKD 2期患者2360例,其中瑞舒伐他汀组1185例,对照组1175例。入选标准:①年龄18~75岁;②拟行冠脉或外周血管介入诊治[包括冠脉造影、左心室造影或外周血管造影,或经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)和外周血管介入治疗];③T2DM;④CKD 2期[eGFR:60~89ml/(min.1.73m2)];⑤至少14d内未用他汀类药物、氨茶碱、前列腺素E1、冠心苏合丸等药物;⑥所有患者接受介入诊治术前48h停用二甲双胍,术中均选用等诊对比剂(contrast media,CM);⑦入选后如行择期二次PCI需等待1周以上者。排除标准:①有他汀类药物或对比剂过敏史;②1型糖尿病;③酮症酸中毒;④乳酸酸中毒;⑤CKD 1期或4期以上[eGFR≥90ml/(min·1.73m2)或eGFR<30ml/(min·1.73m2)];⑥急性ST段抬高型心肌梗死;⑦纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅳ级,不能平卧24h以上;⑧入选前14d内接受过CT血管造影(CTA)、MRI造影等应用对比剂的相关检查;LDL-C<1.82mmol/L(70mg/dl);肝功能异常,ALT>正常值上限3倍;甲状腺功能明显异常;单侧肾动脉狭窄>70%,双侧肾动脉狭窄>50%。
1.3 研究方案及实施 TRACK-D研究经沈阳军区总医院伦理委员会批准,是一项前瞻性、随机、对照、多中心协作的临床试验。遵循GCP标准,所有患者参与研究前均签署书面知情同意书。本子课题为开放性研究,未设盲。瑞舒伐他汀组患者入选开始每晚顿服瑞舒伐他汀10mg(商品名:可定,阿斯利康制药有限公司),术前至少服用2剂,术后3剂,连续应用5剂以上;对照组术前至术后72h内不服用任何他汀类药物。72h后,两组均可使用他汀类药物且种类不限。诊断性造影及介入治疗均按标准方法进行,对术式及手术时间不做限制。所有患者行诊断性造影及介入治疗术中,CM均选用碘克沙醇(商品名:威视派克,100ml/瓶,通用电气药业上海有限公司,2007年ACC/AHA/SCAI及2009年ACC/AHA联合更新PCI指南对CKD患者作为ⅠA类推荐)。临床医生根据患者病情进行评估,由临床医生自行决定患者是否进行水化,如实施水化,则按下列方案进行:术前3~12h至术后6~24h以1.0~1.5ml/(kg·h)的速度经静脉给予生理盐水。
1.4 观察指标 本子课题主要观察定量指标尿微量白蛋白、尿白蛋白排泄率(rate of concentrations of albumin to creatinine,ACR),同时检测入选时及术后72h血清肌酐(Scr)、eGFR、总胆固醇(TC)、LDL-C,并同时观察大课题CIAKI的发生率。
1.5 研究中的相关定义 ①eGFR:应用改良后适合中国人的肾脏病饮食修正公式,成年男性eGFR[ml/(min.1.73m2)]=175×Scr(mg/d l)-1.234×年龄-0.179;成年女性e G F R[m l/(min.1.73m2)]=175×Scr(mg/dl)-1.234×年龄-0.179×0.79(Scr 1mg/dl=88.4μmol/L)。②CIAKI:将血管内注射CM后72h内Scr较基线值升高44.2μmol/L(0.5mg/dl)或比基础值升高25%作为临床诊断标准。③急性肾衰竭(ARF):定义为肾功能急剧恶化,Scr升高>176.8μmol/L(2mg/dl)[13]。④T2DM诊断标准[14]:有T2DM症状,如多饮、多食、多尿和体重减轻和任意时间血糖≥11.1mmol/L,或空腹血糖≥7.0mmol/L,或糖耐量2h血糖≥11.1mmol/L(需重复确认一次);无T2DM上述症状者需在另一天复查一次血糖达到上述标准(2次均达标方可确诊)。⑤CKD分期定义:1期,eGFR正常,eGFR≥90ml/(min·1.73m2);2期,eGFR轻度降低,60ml/(min·1.73m2)≤eGFR≤89ml/(min·1.73m2);3期,eGFR中度降低,30ml/(min·1.73m2)≤eGFR≤59ml/(min·1.73m2);4期,eGFR重度降低,15ml/(min·1.73m2)≤eGFR≤29ml/(min·1.73m2);5期,终末期肾脏病,eGFR<15ml/(min·1.73m2)。⑥贫血:是指人体外周血红细胞容量减少,低于正常范围下限的一种常见的临床症状。由于红细胞容量测定较复杂,临床上常以血红蛋白(Hb)浓度来代替。成年男性Hb<120g/L,成年女性(非妊娠)Hb<110g/L。
1.6 资料收集与随访 由负责入选的医生填写病例报告表,记录患者一般临床资料及介入治疗资料。由专人在介入诊治术后1个月通过电话、门诊或再住院对患者病情进行临床随访,随访内容为术后1个月NYHA心功能分级,全因死亡及药物不良反应。完成1个月的临床随访后,将病例报告表填写完整,由中国临床研究基金会(CCRF,临床研究协调和数据监管机构)进行原始资料的收集、核查,并录入数据库。研究入选结束后,对发生终点事件的病例,再由CCRF通过组织独立的临床事件评审委员会进行临床事件评审核定,以便进一步确定其真实性。
1.7 统计学处理 采用SPSS 20.0统计软件进行分析。计量资料以x±s表示,组间比较采用t检验;计数资料采用百分比(%)表示,组间比较采用χ2检验或Fisher精确概率法。所有统计分析采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 临床基线资料 瑞舒伐他汀组及对照组患者在年龄、性别、危险因素、住院期间合并用药等方面基本相似(表1)。大课题及本研究的患者纳入流程见图1。
2.2 介入诊治前后的肾功能及血脂变化 两组患者基线及术后Scr、eGFR值差异无统计学意义。两组血清LDL-C基线水平相似,但瑞舒伐他汀组术后72h时LDL-C较对照组明显降低(P<0.01,表2)。
2.3 尿微量白蛋白 两组患者基线尿微量白蛋白水平相似(P=0.27),术后两组患者尿微量白蛋白差异也无统计学意义(P=0.08,表3)。
2.4 CIAKI的发生率 瑞舒伐他汀组中,18例患者PCI术后72h内Scr≥44.2μmol/L(≥0.5mg/dl)或较基线升高≥25%,CIAKI的发生率为1.5%;对照组有40例患者发生CIAKI,发生率为3.4%,明显高于瑞舒伐他汀组,差异有统计学意义(P<0.01)。
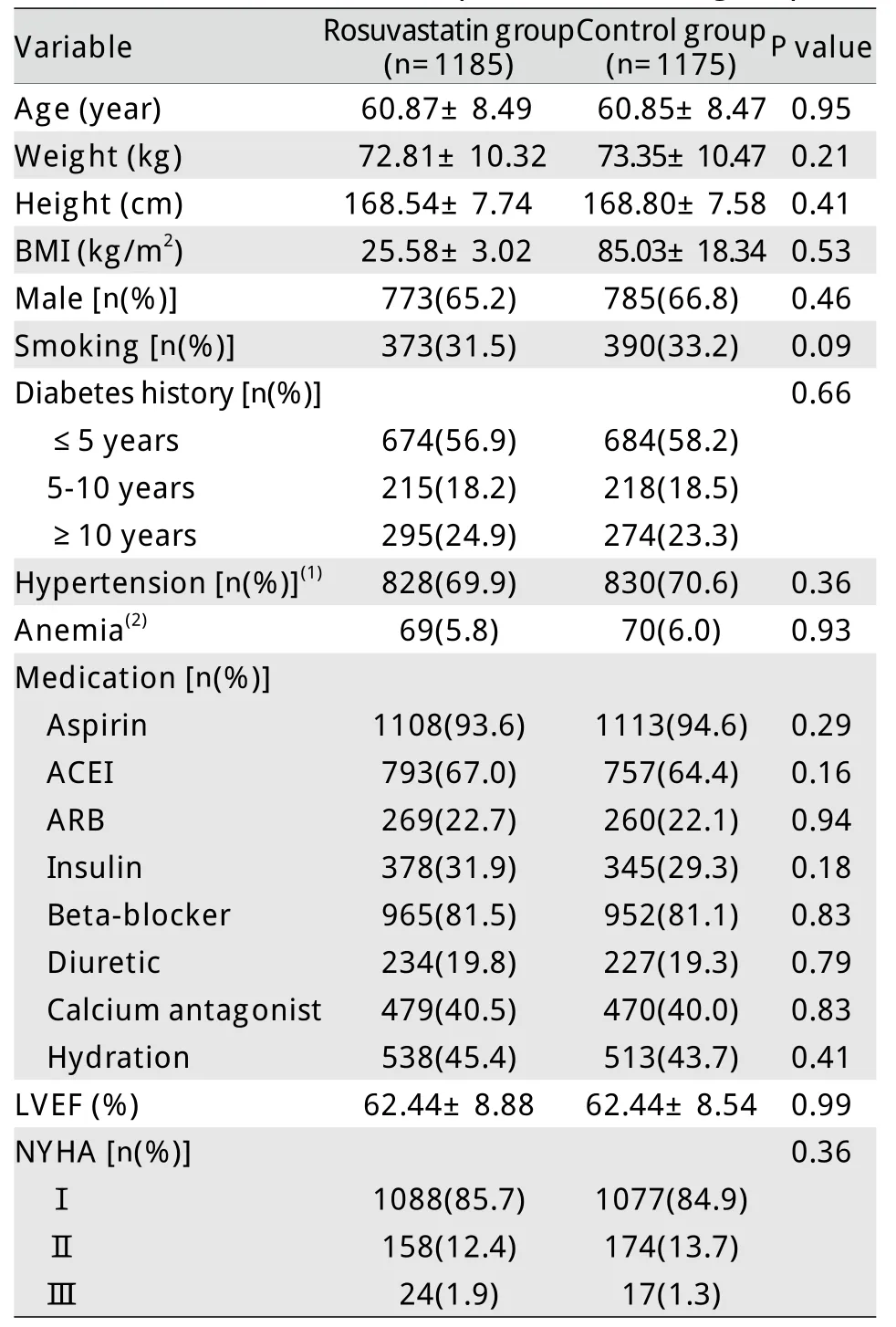
表1 两组患者的临床基线情况Tab.1Baseline data of patients in two groups
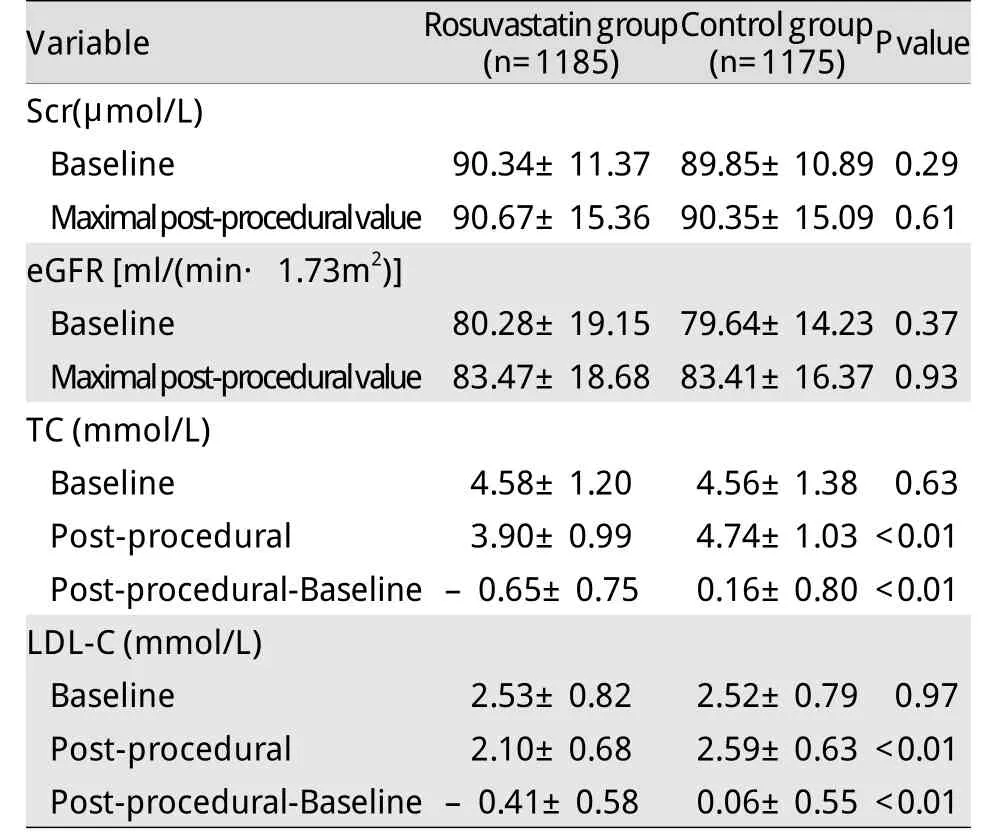
表2 介入诊治前后的肾功能及血脂变化(x±s)Tab.2Renal function and serum lipoproteins before and after interventional treatment (x±s)

表3 患者介入诊治术后尿蛋白变化情况(x±s)Tab.3Urinary protein changes after interventional treatment(x±s)
2.5 临床随访 介入诊治术后30d随访发现,心功能恶化1级以上及全因死亡两组有明显差异(P<0.05,表4)。
2.6 药物不良反应 瑞舒伐他汀组有13例发生药物不良反应(发生率1.0%),包括:术后转氨酶增高10例,皮疹3例,胃肠道反应1例;对照组有15例发生药物不良反应(发生率1.3%),包括术后转氨酶增高12例,皮疹3例,下肢浮肿1例。两组患者不良事件的发生率差异无统计学意义(P=0.71)。
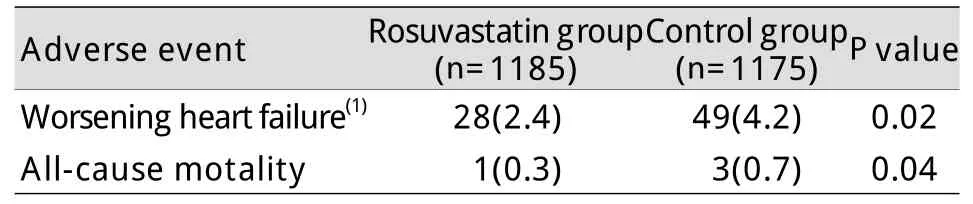
表4 两组患者30天临床随访不良事件评定[n(%)]Tab.4Adverse events occurred during a 30-day clinical follow-up [n(%)]
3 讨 论
目前,药物诱导的蛋白尿备受临床关注,特别是他汀所致的持续性蛋白尿给临床医生带来很大困惑。本研究主要采用目前国内市场上降低LDL-C作用最强的瑞舒伐他汀,观察他汀类药物对T2DM合并轻中度肾功能不全患者尿蛋白的影响。入选患者均为T2DM合并CKD 2期患者。该人群的选择主要考虑中国人群中约9.7%的人群患有T2DM[15]。既往研究表明T2DM是CIAKI的独立预测因子[16-17],肾功能不全是介入诊治术后预后不良的重要预测因素[18]。在T2DM基础上再次合并肾功能损害时CIAKI的危险性倍增[19],在此类CIAKI发病的高危人群中观察围术期尿蛋白的变化情况,可为临床医生在应用他汀中存在的迷惑指明方向。
本研究结果显示,两组患者尿微量白蛋白基线相似,瑞舒伐他汀组围术期应用瑞舒伐他汀10mg/d,连续服用5d,在介入诊治术后尿微量白蛋白未见增加,相反呈明显下降趋势。本研究结果还提示,围术期应用瑞舒伐他汀可显著降低CIAKI的发生率(P<0.01)。分析其原因,瑞舒伐他汀除具有调节血脂作用外,还具有重要的非依赖调脂的肾保护作用。其作用机制主要有:①通过阻断细胞内甲羟戊酸(MVA)的代谢途径,竞争性抑制胆固醇的生物合成,使细胞内胆固醇减少,从而反馈上调细胞表面低密度脂蛋白(LDL)受体表达,促进血浆中LDL清除,降低LDL水平,减少肾脏系膜区和小管间质中脂蛋白的沉积,同时降低肾小球毛细血管袢内压,改善肾脏局部异常的血液流变学指标。因此,瑞舒伐他汀可通过调节血脂水平间接地对肾脏产生多方面保护作用[20]。②通过抑制MVA代谢途径中间产物(特别是非甾醇类异戊二烯)的合成,通过细胞内信号传导途径抑制细胞增殖,诱导细胞凋亡,抑制细胞外基质合成和分泌并促进降解。MVA及其衍生物葡萄糖-6-磷酸去氢鹍(GGPD)是细胞由G1-S期转化完成DNA合成所必需的[21]。瑞舒伐他汀可阻断MVA合成途径的起点,通过上调细胞周期蛋白依赖性激酶(CDK)抑制剂-P21蛋白的表达而使细胞周期停滞在G1期,从而达到抑制肾小管上皮细胞、系膜细胞和血管平滑肌细胞的增生,起到预防肾小球硬化,保护肾功能的目的。③瑞舒伐他汀还可通过减少氧化应激,刺激上调一氧化氮合酶,增加一氧化氮生物利用度,从而改善内皮功能。
综上所述,本研究通过在T2DM合并轻度肾功能不全患者中围术期应用瑞舒伐他汀,结果证实,瑞舒伐他汀可降低血脂水平,降低此类患者CIAKI的发生,并且未增加尿蛋白的风险。但该研究也存在一定的局限性:未进行双盲及安慰剂对照,可能会造成一定的偏倚。
[1]Sun X, Tong H, Zhang M, et al. The comparative study of Rosuvastatin and Simvastatin on carotid intima-media thickness in patients with coronary heart disease[J]. Chin J Pract Inter Med, 2012, 32(6): 452-454. [孙晓, 佟浩, 张曼, 等. 瑞舒伐他汀和辛伐他汀对急性冠脉综合征颈动脉内中膜厚度影响对比研究[J]. 中国实用内科杂志, 2012, 32(6): 452-454.]
[2]Poldermans D, Bax JJ, Boersma E, et al. Guidelines for preoperative cardiac risk assessment and perioperative cardiac management in non-cardiacsurgery: the Task Force for Preoperative Cardiac Risk Assessment and Perioperative Cardiac Management inNon-cardiac Surgery of the European Society of Cardiology (ESC) and endorsed by the European Society of Anaesthesiology (ESA)[J]. Eur J Anaesthesiol, 2010, 27(2): 92-137.
[3]Khanal S, Attallah N, Smith DE, et al. Statin therapy reduces contrast-induced nephropathy: an analysis of contemporary percutaneous interventions[J]. Am J Med, 2005, 118(8): 843-849.
[4]Pappy R, Stavrakis S, Hennebry TA, et al. Effect of statin therapy on contrast-induced nephropathy after coronary angiography: a meta-analysis [J]. Int J Cardiol, 2011, 151(3): 348-353.
[5]Toso A, Maioli M, Leoncini M, et al. Usefulness of atorvastatin(80mg) in prevention of contrast-induced nephropathy in patients with chronic renal disease[J]. Am J Cardiol, 2010,105(3): 288-292.
[6]Patti G, Ricottini E, Nusca A, et al. Short-term, high-dose Atorvastatin pretreatment to prevent contrast-induced nephropathy in patients with acute coronary syndromes undergoing percutaneous coronary intervention (from the ARMYDA-CIN [atorvastatin for reduction of myocardial damage during angioplasty--contrast-induced nephropathy]trial[J]. Am J Cardiol, 2011, 108(1): 1-7.
[7]Jo SH, Koo BK, Park JS, et al. Prevention of radiocontrast medium-induced nephropathy using short-term high-dose simvastatin in patients with renal insufficiency undergoing coronary angiography (PROMISS) trial--a randomized controlled study[J]. Am Heart J, 2008, 155(3): 499. e1-e8.
[8]Zhang L, Zhang L, Lu Y, et al. Efficacy of statin pretreatment for the prevention of contrast-induced nephropathy: a meta-analysis of randomised controlled trials[J]. Int J Clin Pract, 2011, 65(5):624-630.
[9]Tiwari A. An overview of statin-associated proteinuria[J]. Drug Discov Today, 2006, 11(9-10): 458-464.
[10]Jones PH, Davidson MH, Stein EA, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin,simvastatin, and pravastatin across doses (STELLAR* Trial)[J].Am J Cardiol, 2003, 92(2): 152-160.
[11]Han Y, Zhu G, Han L, et al. Short-term rosuvastatin therapy for prevention of contrast-induced acute kidney injury in patients with diabetes and chronic kidney disease[J]. J Am Coll Cardiol,2014, 63(1): 62-70.
[12]Han YL. To attach the importance to contrast-induced acute kidney injury[J]. Med J Chin PLA, 2014, 39(4): 255-258. [韩雅玲. 重视对比剂诱导的急性肾损伤[J]. 解放军医学杂志,2014, 39(4): 255-258.]
[13]Teng X, Liu LM. Effects of combined lipid-lowering therapy on type 2diabetes with hypertriglyceridemia after intervention treatment[J]. Chin J Pract Inter Med, 2013, 33(4): 313-315. [滕旭,刘丽敏. 联合调脂治疗对介入治疗术后2型糖尿病伴高三酰甘油血症影响研究[J]. 中国实用内科杂志, 2013, 33(4):313-315.]
[14]Patti G, Nusca A, Chello M, et al. Usefulness of statin pretreatment to prevent contrast-induced nephropathy and to improve long-term outcome in patients undergoing percutaneous coronary intervention[J]. Am J Cardiol, 2008, 101(3): 279-285.
[15]American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2012, 35(Suppl 1):S64-S71.
[16]Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-1101.
[17]Laskey WK, Jenkins C, Selzer F, et al. Volume-to-creatinine clearance ratio: a pharmacokinetically based risk factor for prediction of early creatinine increase after percutaneous coronary intervention[J]. J Am Coll Cardiol, 2007, 50(7): 584-590.
[18]Kushner FG, Hand M, Smith SC Jr, et al. 2009focused updates:ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction (updating the 2004guideline and 2007focused update) and ACC/AHA/SCAI guidelines on percutaneous coronary intervention (updating the 2005guideline and 2007focused update) a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2009,54(23): 2205-2241.
[19]Mueller C, Neumann FJ, Perruchoud AP, et al. Renal function and long term mortality after unstable angina/non-ST segment elevation myocardial infarction treated very early and predominantly with percutaneous coronary intervention[J].Heart, 2004, 90(8): 902-907.
[20]Li X, Li DT, Zhang BR. Risk factors of contrast-induced acute kidney injury and mortality[J]. Chin J Pract Inter Med, 2013,33(1): 42-45. [李雪, 李德天, 张蓓茹. 造影剂引起急性肾损伤及死亡危险因素分析[J]. 中国实用内科杂志, 2013, 33(1):42-45.]
[21]Abe M, Maruyama N, Yoshida Y, et al. Efficacy analysis of the lipid-lowering and renoprotective effects of rosuvastatin in patients with chronic kidney disease[J]. Endocr J, 2011, 58(8):663-674.
[22]Tian D, Qin YF, Ying R, et al. Effect of simvastatin on antioxidation and anti-inflammation properties of HDL in apoE-/-mice[J]. Med J Chin PLA, 2013, 38(3): 195-200. [田迪, 秦亚飞, 应如, 等. 辛伐他汀对apoE-/-小鼠HDL抗炎抗氧化功能的影响[J]. 解放军医学杂志, 2013, 38(3): 195-200.]

