两种火炭母基因组DNA提取方法的对比研究
刘静华
两种火炭母基因组DNA提取方法的对比研究
刘静华
(韶关学院英东生命科学学院,广东韶关512005)
火炭母富含有多酚、多糖等次生代谢产物.这些次生代谢产物对火炭母基因组DNA提取的质量与产量有较大影响.以火炭母的成熟叶片,幼嫩叶片、幼嫩茎尖为实验材料,采用改良SDS法和CTAB法,对火炭母进行基因组DNA提取,并通过琼脂糖凝胶电泳检测其完整性,紫外分光光度计法测定其浓度和纯度,对提取效果进行比较,以期得到提取火炭母基因组DNA的最佳方法.
火炭母;基因组DNA;提取
火炭母为蓼科(Polygonaceae)蓼属(Polygonum)植物火炭母草(Polygonum chinense Linn.).别名火炭藤、火炭毛等.性味寒、微酸、涩.具有清热祛湿、凉血解毒、明目、止痒等功效.用于痢疾、咽喉肿痛、流行性腮腺炎、扁桃腺炎、肝炎等疾病的治疗.火炭母对于金黄葡萄球菌、绿脓杆菌、大肠埃氏菌、痢疾杆菌、枯草杆菌等具有一定的抑菌活性,有较好的药用价值.而要对火炭母进行分子生物学的研究,首要条件是提取到质量好、产量高的基因组DNA.虽然目前植物DNA的提取纯化方法比较成熟,但对不同的植物而言,提取效果相差很大.火炭母全草含多种多酚类物质[1],如蒽醌、黄酮苷、β-谷甾醇、山奈酚、槲皮素、鞣花酸、3-O-甲基鞣花酸、逆没食子酸、没食子酸、山奈酚-7-葡萄糖苷等;多糖类物质如L-肌醇、D-半乳糖醛酸、D-半乳糖、麦芽糖、L-鼠李糖、棕榈酸、硬脂酸、亚油酸等;非皂化部分含β-谷甾醇等;根和根茎含多种氨基酸.这些多酚类与多糖类物质加大了提取火炭母基因组DNA的难度.本文选择了改良SDS法[2]和CTAB法[3],以火炭母的成熟叶片、幼嫩叶片、幼嫩茎尖为实验材料,进行基因组DNA提取,并通过琼脂糖凝胶电泳检测其完整性,紫外分光光度计法测定其浓度和纯度,对提取效果进行比较,以期得到提取火炭母基因组DNA的最佳方法.
1 材料与方法
1.1材料与试剂
野外采集到生长良好、无表观病变的火炭母全株,保留根部土壤,移至室内培养数天.选取其成熟叶片、幼嫩叶片、幼嫩茎尖作为实验原材料.
CTAB、SDS、PVP、β-巯基乙醇、Tris·HCl、EDTA、核酸染料购自北京鼎国公司,氯仿、异戊醇、无水乙醇、氯化钠、醋酸钠、醋酸钾均为市售分析纯.配制用水为去离子水并经高压灭菌.
1.2仪器设备
高速冷冻离心机(上海安亭TGL-16G),电泳仪(北京六一仪器厂DYY-11型),电泳槽(北京六一DYC-33A型),紫外可见分光光度计(光谱仪器公司752型),紫外分析仪(北京六一仪器厂WD-9403型),高压灭菌锅(上海申安医疗器械厂ZDX-35BI型),恒温干燥箱(上海申光仪器仪表有限公司200AB-2型),电子分析天平(上海恒平JA5003型)等.
1.3基因组DNA提取方法
实验采用改良SDS法、CTAB法提取火炭母基因组DNA.每种方法每种样品进行3次重复.
预处理:将新鲜的火炭母幼嫩叶片、成熟叶片、幼嫩茎尖分别用液氮加PVP干粉研磨成粉末,每种样品均采用改良SDS法、CTAB法提取其基因组DNA.
CTAB法:准确称取100 mg植物组织干粉于1.5 ml离心管中,加入500μL 65℃的CTAB提取液(2% CTAB,3%可溶性PVP,2%β-巯基乙醇,100 mmol·L-1Tris·HCl pH8.0,25 mmol·L-1EDTA pH8.0)充分混匀,65℃保温30 min,降至室温后加入等体积氯仿/异戊醇(24∶1),温和颠倒混匀,4℃,12 000 rpm离心15 min,取上清于另一离心管,加入两倍体积的无水乙醇,轻混匀,静置10 min,有白色絮状沉淀出现,4℃,10 000 rpm离心5 min,弃上清,70%乙醇洗涤沉淀2次,乙醇彻底干燥后沉淀溶于50μLTE缓冲液中,4℃保存.
改良SDS法:准确称取100 mg植物组织干粉于1.5 mL离心管中,加入500μL预冷的提取液(3%可溶性PVP,2%β-巯基乙醇,50 mmol·L-1Tris·HCl pH8.0,50 mmol·L-1EDTA pH8.0)充分混匀,冰上放置10 min后,4℃,6 000 rpm离心5 min,弃上清.再次加入500μL上述提取液重悬沉底,离心后弃上清,沉淀中加入500μl 65℃预热的裂解缓冲液(15%SDS,100 mmol·L-1Tris·HCl pH8.0,20 mmol·L-1EDTA pH8.0,500 mmol·L-1NaCl)颠倒混匀,65℃保温45 min,期间不时颠倒混匀,降至室温后加入等体积氯仿/异戊醇(24: 1),颠倒混匀.4℃,10 000 rpm离心10 min,取上清,加入0.1(v/v)5 mol·L-1KAc(pH4.8),加入等体积-20℃预冷的异丙醇.-20℃静置30 min后,4℃,12 000 rpm离心20 min,70%乙醇洗涤2次,乙醇彻底干燥后沉淀溶于50μlTE缓冲液中,4℃保存.
1.4DNA完整性检测
取5μL DNA样品按6×loadingbuffer的比例混合,点入含0.5μg·mL-1核酸染料的1.0%琼脂糖凝胶中,1×TBE中5 v/cm稳压电泳50 min后,在紫外检测仪上观察.
1.5DNA纯度和浓度检测[4]
吸取5μL DNA样品,加TE缓冲液至1 mL混匀,测定OD260 nm和OD280 nm,取得紫外线吸收值的比值(OD260/OD280);DNA浓度的计算公式:双链DNA浓度(μg·μL-1)=OD260×样品稀释倍数×50/1 000.
2 结果与分析
2.1电泳实验
用2种方法提取幼嫩叶片、成熟叶片、幼嫩茎尖的DNA琼脂糖凝胶电泳检测,电泳结果如图1.

图1 2种提取方法的DNA电泳图
如图1所示,6个DNA条带均较明亮、整齐,无明显拖尾现象,说明6个样品液中的DNA片段比较完整,多酚类次生代谢产物去除得比较干净,并且无RNA残留.但样品1、2、3的点样孔附近有微弱的亮带,说明此3种样品液中残留少量蛋白质;样品4、5、6点样孔附近无明显亮带出现,说明此3种样品液中蛋白质去除干净.另外,CTAB法的DNA条带更粗更亮,说明样品液中DNA含量更高.SDS法的DNA泳道有隐约的拖尾现象,可能是由于SDS十二烷基硫酸钠(sodium dodecylsulfate)作为离子型表面活性剂,在55℃~65℃条件下,能够溶解细胞膜及核膜蛋白,使核蛋白解聚,从而使染色体DNA离析.但此过程反应比较剧烈,可能会使大分子DNA发生断裂,因此提取物中含少量小片段DNA;或者可能是由于操作过程中核酸酶未彻底清除.而CTAB作为一种阳离子去污剂,能与核酸形成复合物,在低盐溶液(NaCl浓度<0.3 mol·L-1)中,此复合物会因溶解度的降低而沉淀,而在高盐浓度(NaCl浓度<0.7 mol·L-1)中会解离,从而使DNA分子与蛋白质和多糖分开.在经酚、氯仿、异戊醇抽提去除蛋白质,最后用乙醇沉淀DNA.由于CTAB-核酸复合物的形成能较好地保护大分子DNA,所以CTAB法的DNA泳道没有拖尾现象.
电泳结果反映CTAB法提取的火炭母叶片基因组DNA的纯度和含量都高于改良SDS法.
2.2紫外分光光度计检测
紫外分光光度计检测吸光度及相应处理结果如表1所示.
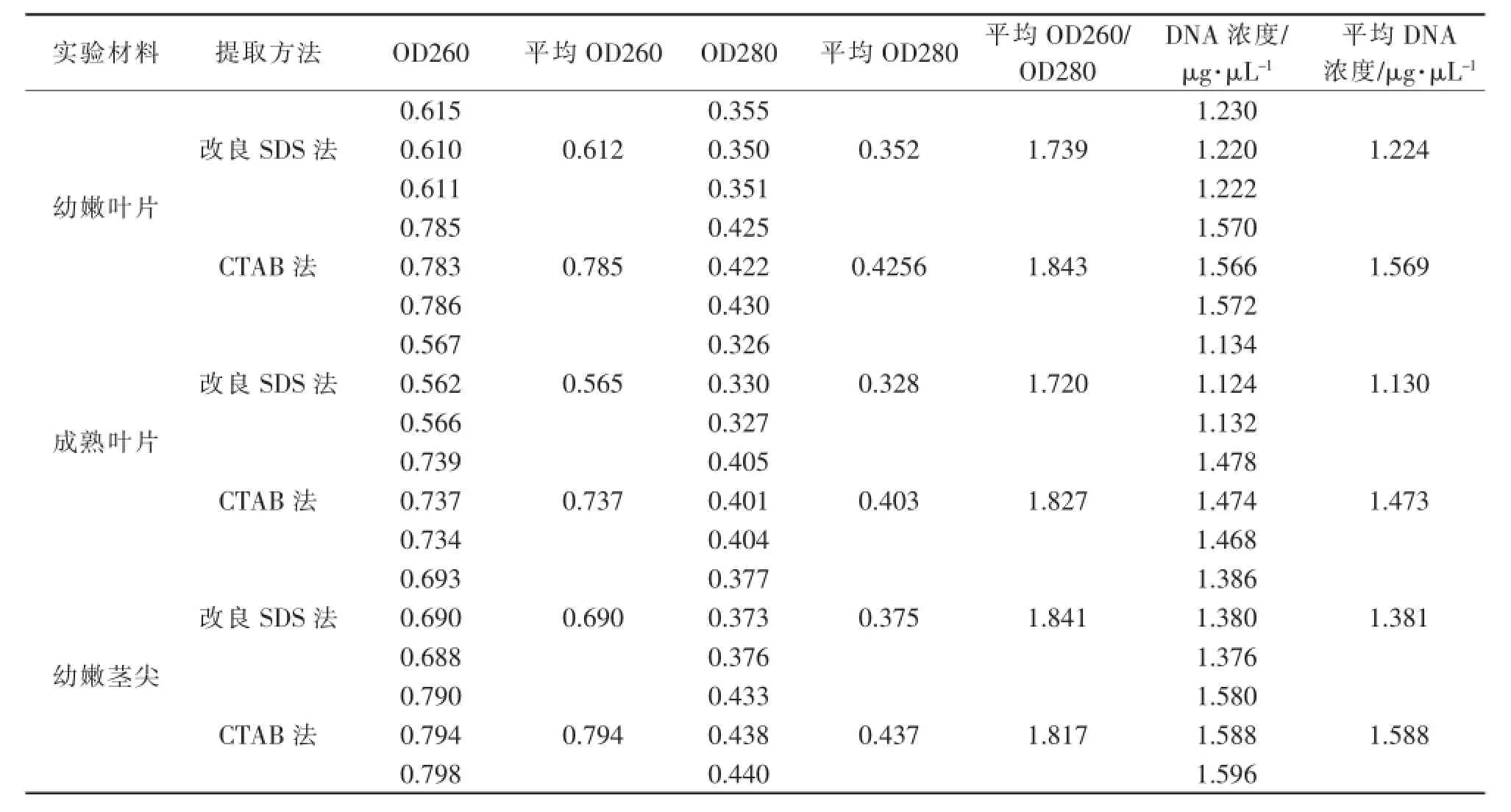
表1 2种提取方法的DNA吸光度检测结果
由于核酸分子含有的嘌呤环及嘧啶环的共价双键,在260 nm波长有特异的吸收峰,其吸光度与核酸的浓度成正比.OD260相当于dsDNA 50μg·mL-1,ssDNA 33μg·mL-1和ssRNA 40μg·mL-1.可以此来计算核酸样品的浓度.紫外分光光度法不但能确定核酸的浓度,还可通过测定260 nm和280 nm的紫外线吸收值的比值(OD260/OD280)估计核酸的纯度,纯的DNA制品的比值为1.8,RNA的比值为2.0,若DNA高于1.8,则可能有RNA污染,低于1.8则有蛋白质和酚污染.
如表1所示,改良SDS法提取火炭母幼嫩叶片DNA的平均OD260/OD280比值为1.739,成熟叶片为1.720均低于1.8,说明有酚类和蛋白质的污染,可能由于火炭母叶片的成熟程度影响了DNA提取的质量.新生组织的次生代谢产物比较少,成熟叶片的酚类、多糖等次生产物含量较高.但幼嫩茎尖DNA比值为1.841接近1.8,说明纯度较好,可能是由于茎尖的次生代谢产物含量较少,正处于细胞分裂旺盛的幼嫩茎尖DNA含量更高.而CTAB法提取火炭母幼嫩叶片DNA的平均OD260/OD280比值为1.843,成熟叶片的为1.827,幼嫩茎尖的为1.817,接近1.8,表示DNA污染少,纯度高,说明CTAB法提取火炭母DNA时去除蛋白质、次生代谢产物的效果优于改良SDS法.
根据OD260nm计算DNA浓度,改良SDS法提取火炭母幼嫩叶片DNA平均浓度为1.224μg·μL-1,成熟叶片的为1.130μg·μL-1,幼嫩茎尖的为1.381μg·μL-1.CTAB法提取火炭母幼嫩叶片DNA平均浓度为1.569μg·μL-1,成熟叶片的为1.473μg·μL-1,幼嫩茎尖的为1.588μg·μL-1.说明CTAB法提取火炭母DNA的效率高于改良SDS法.
3 结论
植物DNA提取方法很多,不同植物,甚至是同一类植物,但组织材料的来源、部位、形态等外在性质的不同以及化学成分、次生产物,组织结构等内在特点的差异,在提取基因组DNA时选用的方法都有不同.本文的实验表明火炭母基因组DNA提取用CTAB法优于改良SDS法.
火炭母叶片富含酚类及多糖等次生代谢产物.幼嫩茎尖不仅细胞分裂旺盛、DNA含量高,而且酚类和多糖含量较少,提取DNA效果较好,但由于茎尖数量少取材较难.幼嫩叶片数量较多,次生产物也较少,是提取火炭母DNA的理想材料.DNA提取过程操作的关键:使用的研钵、枪头、药勺、离心管要经过严格的灭菌.操作要在低温环境中进行,尽量防止内源Dnase和外界杂质的干扰.操作要温和,研磨时要快速且用力适当,避免破坏DNA分子.
两种提取DNA的方法在液氮研磨及提取缓冲液中都加入了PVP(聚乙烯吡咯烷酮),PVP能与多酚类结合成复合物,防止多酚氧化褐变,并能去除多糖;而β-巯基乙醇作为强还原剂能打断多酚氧化酶的二硫键而使之失活,以防止多酚的氧化.二者同用,有效地抑制多酚类物质对DNA的影响,提高提取DNA的纯度.对于如火炭母一类次生产物中酚类与多糖含量较高的植物,提取DNA时,可加入1%~6%的PVP,同时抽提液中使用巯基乙醇来抑制氧化作用.
[1]谢贤强,吴萍.火炭母化学成分的研究[J].热带亚热带植物学报,2007,15(5):450-454.
[2]丁芳林,彭书练.黄芩高质量DNA提取方法研究[J].湖南农业科学,2010(13):23-25.
[3]杨松杰.药用绞股蓝属植物基因组DNA提取方法比较[J].陕西农业科学,2013(1):87-89.
[4]高洪晓,杨凯.3种植物DNA提取法中多糖类物质去除效果的研究[J].北京农学院学报,2011,26(1):70-72.
Study on two DNA extraction methods of Polygonum chinense Linn
LIU Jing-hua
(Yingdong College of Bioscience,Shaoguan University,Shaoguan 512005,Guangdong,China)
Polygonum chinense Linn contains rich polyphenols polysaccharide secondary metabolites,which influences greatly the quality and quantity of its DNA extraction.Taking the mature leaves,the young leaves and young stem tip as the raw materials of the experiment,and adopting the method of improved SDS and CTAB,a better way is made to extract the DNA of Polygonum chinense Linn,whose complicity has been detected by agarose gel electrophoresis and density and purity by ultraviolet spectrophotometer method.
Polygonum chinense Linn;genome DNA;extraction
(责任编辑:邵晓军)
Q93-33
A
1007-5348(2014)04-0056-04
2014-01-18
刘静华(1980-),女,广东龙川人,韶关学院英东生命科学学院实验师,主要从事分子生物学、基因工程方面的研究.

