豆腐致腐细菌的分离鉴定及控制研究
杨 明,陈信宇,张 辉,2,*,冯凤琴,2,*(.浙江大学食品科学与营养学系,浙江杭州30058;2.浙江大学馥莉食品研究院,浙江杭州30058)
豆腐致腐细菌的分离鉴定及控制研究
杨 明1,陈信宇1,张 辉1,2,*,冯凤琴1,2,*
(1.浙江大学食品科学与营养学系,浙江杭州310058;2.浙江大学馥莉食品研究院,浙江杭州310058)
对散装老豆腐及盒装内酯豆腐中腐败细菌进行了分离鉴定,通过致腐细菌回接实验进一步探究了豆腐腐败现象与致腐细菌的关系,同时,测定了单月桂酸甘油酯(GML)、月桂酸蔗糖酯、δ-葡萄糖酸内酯、Nisin及其复合体系的最低抑制浓度和协同增效作用。结果表明,导致豆腐腐败的细菌主要为短芽孢杆菌属(Brevibacillus)、肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)和明串珠菌属(Leuconostoc);发酵乳杆菌、梨形肠杆菌及肠膜明串珠菌分别导致豆腐发粘、涨袋及质构变软;GML对上述4种致腐细菌的抑制效果最佳;GML与Nisin复配增效效果最明显,对类短短芽孢杆菌、发酵乳杆菌及肠膜明串珠菌均有协同增效作用。本文为研发添加于豆腐类产品的新型高效保鲜剂,延长其保质期奠定了基础。
豆腐,致腐细菌,腐败现象,单月桂酸甘油酯,最低抑菌浓度
豆腐起源于我国,是我国传统的大豆食品,在全世界消费的所有植物中最具食用价值。大豆营养丰富,其蛋白质含量高达35%~40%,不仅富含不饱和脂肪酸、卵磷脂、脑磷脂、膳食纤维、低聚糖、钙、磷、铁等无机盐及多种维生素,而且易消化,因而被誉为“植物肉”。经常食用豆腐,可降低血清总胆固醇,降血压,降血糖,减少动脉硬化,同时对预防骨质疏松、预防癌症及保护心血管健康也能起到良好的作用[1-3]。但是,大豆制品含有丰富的蛋白质和碳水化合物,水分活度较高且pH中性偏酸,为微生物提供了理想的生长繁殖环境,从而导致其保质期较短,影响了豆制品的品质和销售,也在一定程度上限制了豆制品行业的发展[4]。
豆腐腐败主要是由细菌引起的,虽然在加工过程中会受到各种细菌的污染,但最终只有部分细菌大量增殖,在腐败中占据主导地位[5]。国内外学者均报道过引起豆腐腐败变质的主要腐败菌种类,但目前还没有一致的结论。李博等[6]认为δ-葡萄糖酸内酯豆腐(GDL豆腐)的主要腐败菌为坚强芽孢杆菌及屎肠球菌;邓勇等[7]研究认为GDL豆腐中的主要腐败菌为75%枯草芽孢杆菌和15%凝结芽孢杆菌。Fouad等[8]研究表明2~3℃保存的真空包装豆腐中主要腐败菌为乳酸菌、肠道菌和假单胞菌属。Tuitemwong等[9]认为7℃保存的豆腐中腐败菌主要为链球菌属、发酵乳杆菌属、阴沟梨形肠杆菌等。柳玉等[10]研究证明芽孢杆菌是造成豆制品腐败的主要微生物。Dostson等[11]认为引起豆腐腐败变质的主要腐败菌为乳酸菌。
单月桂酸甘油酯(glycerol monolaurate,GML)天然存在于母乳和美洲蒲葵中,是一种亲酯性的非离子型表面活性剂,兼具优良的乳化及防腐性能。GML是一种安全、高效、广谱的抗菌剂,且其抑菌效果不受pH影响。有研究表明,GML能够抑制HIV病毒、细胞巨化病毒、包疹病毒、sna病毒以及大量的细菌及原生动物[12]。此外,已有实验证明,GML能有效抑制糯米糕团、低温肉糜制品、月饼、冷鲜肉类、牛肉制品及奶制品中的腐败微生物生长[13-16]。
本研究筛选并鉴定了散装老豆腐及盒装内酯豆腐中的主要腐败菌种,并通过致腐细菌回接实验探索了豆腐腐败现象与致腐细菌之间的关系,同时,选取单月桂酸甘油酯等几种有抑菌功能的食品添加剂对其进行体外抑菌研究,为研发添加于豆腐类产品的新型高效保鲜剂,延长其保质期奠定了基础。
1 材料和方法
1.1 材料与仪器
盒装内酯豆腐、散装老豆腐 市场购得,祖名豆制品股份有限公司;单月桂酸甘油酯(GML) 质量含量为80%,杭州康源食品科技有限公司;乳酸链球菌素 食品级,浙江新银象生物工程有限公司;δ-葡萄糖酸内酯 食品级,安徽兴宙医药食品有限公司;月桂酸蔗糖酯 食品级,日本三菱化学公司;其他试剂 均为国产分析纯。
pH计(PB-10)、电子天平 赛多利斯科学仪器有限公司;恒温摇床、恒温恒湿培养箱 上海智城分析仪器制造有限公司;超净工作台 上海博讯实业有限公司医疗设备厂;酶标仪 美国热电雷勃公司;立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.2 实验方法
1.2.1 菌种分离纯化 菌种分离纯化的方法参考张希等[17]采用的方法。
1.2.2 菌株鉴定 菌种鉴定采用Sherlock全自动细菌鉴定系统,通过对不同菌株的脂肪酸图谱进行分析,并与标准数据库进行比对,进行菌株鉴定。
1.2.3 豆腐致腐细菌回接实验 分别吸取1mL含菌量为104CFU/mL的四种致腐菌菌液,接种至装有20~ 25g已灭菌样品的真空塑封袋中,真空包装。接菌后的样品分别放置于室温和37℃恒温培养箱中,每个样品重复3次。连续观察样品腐败现象并记录,同时,测定总酸的含量。测定总酸的方法如下:
根据GB/T 12456-90《食品中总酸的测定方法》进行总酸的测定。按照下式计算总酸度。

其中:C—标准NaOH溶液的浓度,mol/L;V—滴定消耗标准NaOH溶液体积,mL;m—样品质量或体积,g或mL;V0—样品稀释总体积,mL;V1—滴定时吸取的样液体积,mL;K—换算为主要酸的系数,即1毫摩尔氢氧化钠相当于主要酸的克数。
1.2.4 抑菌剂最低抑制浓度(minimum inhibitory concentration,MIC)测定 先将菌种在37℃下培养1~ 2d,恢复菌种活力,再接种于胰蛋白胨大豆肉汤培养基(tryptic soy broth,TSB)中进行摇床培养,37℃下培养18~24h后,采用平板计数法确定菌液浓度。
选取GML、δ-葡萄糖酸内酯及月桂酸蔗糖酯这3种在豆制品中允许使用且有抑菌功能的食品添加剂作为抗菌实验的材料,并与天然强效抑菌剂Nisin作对比。为模拟豆制品中致腐菌的实际生长环境,将培养基pH调节至新鲜豆制品的pH,即6.25。
GML、δ-葡萄糖酸内酯、月桂酸蔗糖酯及Nisin的最低抑制浓度测定方法采用微量稀释比浊法[17-19]。抑菌剂的稀释采用两倍稀释法,其中Nisin先用0.01mol/L的HCl溶解,再用含HCl 0.0008mol/L的无菌TSB进行稀释。1.2.5 GML复合体系抑菌效果测定 取2MIC(最低抑制浓度的2倍)、MIC、1/2 MIC这3个浓度的GML,依次与浓度分别为2MIC、MIC、1/2 MIC的其余3种抑菌剂进行复配,比例为1∶1,用酶标比浊法测定GML复合体系的抑菌效果,具体方法参考宋飞[20]采用的方法。培养基pH为6.25。
1.2.6 抑菌剂复配增效效果判定 增效效果判定公式:
FICI=MIC(a/a+b)/MICa+MIC(b/a+b)/MICb
其中,FIC—Fractional inhibitory concentrations,部分抑制浓度;FICI—FIC Index,部分抑制浓度指数;MIC(a/a+b)—抑菌剂a与b的复配物完全抑制某种微生物时,复配物中a的抑制浓度;MIC(b/a+b)—抑菌剂a与b的复配物完全抑制某种微生物时,复配物中b的抑制浓度;MICa—抑菌剂a对某种微生物的最低抑制浓度;MICb—抑菌剂b对某种微生物的最低抑制浓度。
若FICI<1,则说明抑菌剂a与b复配后抑菌效果表现为协同增效作用;若FICI≥1,则说明抑菌剂a与b复配后抑菌效果表现为无协同增效作用(拮抗或叠加)[21]。
1.3 数据分析
采用单因素方差分析法对数据进行差异性比较(p<0.05)。
2 结果与分析
2.1 菌株的鉴定
分离纯化后得到的四种菌株,分别标记为菌株A、菌株B、菌株C和菌株D。鉴定结果如表1所示,菌株A属于短芽孢杆菌属(Brevibacillus);菌株B属于肠杆菌属(Enterobacter);菌株C属于乳杆菌属(Lactobacillus);菌株D属于明串珠菌属(Leuconostoc)。
2.2 豆腐腐败现象及总酸变化
为进一步确认分离纯化得到4种微生物是否为豆腐的致腐菌,进行回接实验,并初步探究致腐菌与豆腐腐败现象的关系。豆腐是极易腐败的食物,其腐败变质的主要现象为发酸、发粘、产气涨袋、质构变软、发臭等。
由表2可知,在37℃保存条件下,随着时间的变化,发酵乳杆菌的存在能导致老豆腐发粘,对内酯豆腐的影响则不明显,这是因为内酯豆腐的主要腐败现象并不是发粘;梨形肠杆菌产气能导致两种豆腐产生涨袋现象,且对老豆腐的影响更大,涨袋现象更加明显;两种豆腐质构变软均与肠膜明串珠菌的存在有一定关系;类短短芽孢杆菌对两种豆腐腐败变质的影响不明显,这可能是因为作为优势菌种的类短短芽孢菌抑制了其他菌种的生长繁殖,破坏了豆腐腐败的正常菌种环境,但会有一定的产气涨袋现象,并有绿色斑点出现,这可能是由于有霉菌产生。在室温保存条件下,两种豆腐的腐败趋势于37℃下一致,只是腐败过程较为缓慢。

表1 菌种A、B、C及D的Sherlock鉴定结果Table 1 Sherlock identification of A,B,C and D strains

表2 致腐菌接种豆腐的腐败现象(37℃)Table 2 The spoilage situation of pathogens inoculation experiment(37℃)
微生物在生长过程中会产生酸,使豆腐腐败变酸,通过测定豆腐总酸含量判断豆腐腐败情况,以及各种微生物产酸情况。由图1、图2可知,37℃,五种处理条件下,两种豆制品(老豆腐及内酯豆腐)的总酸含量随时间的变化呈现先升高后下降的趋势。总体而言,空白组豆腐的总酸含量显著大于分别添加类短短芽孢杆菌、肠膜明串珠菌、发酵乳杆菌及梨形肠杆菌的豆腐(p<0.05),这可能是因为在4个阳性处理组中4种致腐菌均为优势菌群,其他种类微生物生长缓慢且数量较少,破坏了豆腐的正常腐败环境,而单一存在的致腐菌不能使豆腐快速腐败变酸。与其他组相比,添加梨形肠杆菌的两种豆腐制品总酸含量与空白组最为接近,在贮藏后期,添加其他3种致腐菌的处理组的总酸含量均显著小于空白组,且这3个处理组间的总酸含量存在显著性差异。结果表明,梨形肠杆菌可能是导致两种豆腐变酸的主要菌种,其他3种致腐菌对老豆腐及内酯豆腐产酸现象没有明显影响。

图1 致腐菌回接实验总酸变化(老豆腐,37℃)Fig.1 Changes of total acid in pathogens inoculation experiment(firm tofu,37℃)
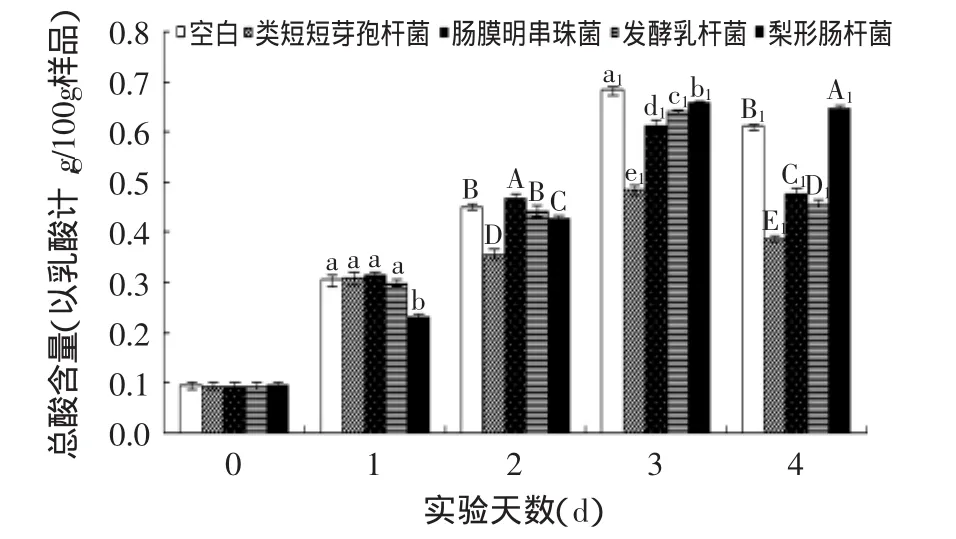
图2 致腐菌回接实验总酸变化(内酯豆腐,37℃)Fig.2 Changes of total acid in pathogens inoculation experiment(lactone tofu,37℃)
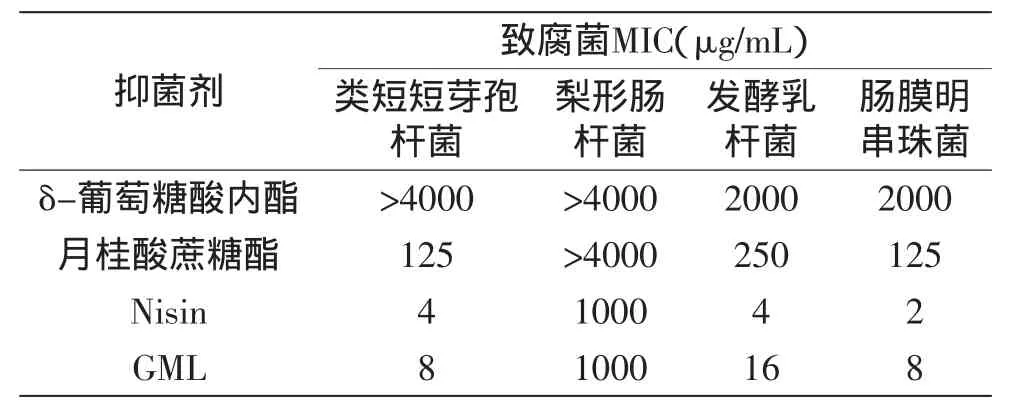
表3 常见抑菌剂对4种致腐菌的最低抑制浓度(pH=6.25)Table 3 MIC of common preservatives to four spoilage microorganisms(pH=6.25)
2.3 抑菌剂对四种致腐菌的最低抑制浓度
由表3可知,GML对4种致腐菌均有较强的抑制作用,尤其是类短短芽孢杆菌、发酵乳杆菌及肠膜明串珠菌。Cotton等[22]研究发现GML能有效抑制芽孢杆菌,GML对革兰氏阳性菌的抑制作用明显优于对革兰氏阴性菌。Nisin对4种致腐菌的抑制效果与GML十分类似,对类短短芽孢杆菌、发酵乳杆菌及肠膜明串珠菌的MIC值分别为4、4和2μg/mL,对梨形肠杆菌的MIC值为1000μg/mL。罗欣等[23]发现Nisin能抑制引起食品腐败的许多革兰氏阳性细菌,如肠膜明串珠菌、发酵乳杆菌、葡萄球菌和小球菌等。月桂酸蔗糖酯对除梨形肠杆菌外的3种致腐菌抑制效果较好,MIC值小于或等于250μg/mL。δ-葡萄糖酸内酯对发酵乳杆菌及肠膜明串珠菌有一定的抑制作用,最低抑制浓度为2000μg/mL。
2.4 GML复合体系对四种致腐菌的最低抑制浓度
以GML为主体复配其他抑菌剂,采用微量稀释比浊法,测定单月桂酸甘油酯复合体系对四种致腐菌的最低抑制浓度。
由表4可知,GML与Nisin复配后增效效果明显,GML与Nisin的浓度分别为各自最低抑制浓度的1/4和1/8或1/8和1/4时,对类短短芽孢杆菌、发酵乳杆菌及肠膜明串珠菌均有协同增效作用;GML与δ-葡萄糖酸内酯复配后,只对类短短芽孢杆菌有协同增效效果(FICI=0.625),即GML与δ-葡萄糖酸内酯的浓度分别为1/4 MIC和1/2 MIC或1/2 MIC和1/8 MIC;GML与月桂酸蔗糖酯复配后对类短短芽孢杆菌(FICI= 0.5)、发酵乳杆菌(FICI=0.375)有协同增效效果,但对肠膜明串珠菌和梨形肠杆菌没有表现出协同增效作用。结果表明,GML与Nisin复配后协同增效效果最好,对3种致腐菌起到协同抑制作用,其余复配方式只对其中1种或2种致腐菌起到协同增效作用。
3 结论
从腐败变质的豆腐中分离得到的发酵乳杆菌、梨形肠杆菌及肠膜明串珠菌能分别导致豆腐发生发粘、涨袋及质构变软等腐败现象。在单一种类抑菌剂抑菌实验中,GML的抑制效果与Nisin类似,对分离纯化得到的4种豆腐致腐细菌均表现出较强的抑制作用,且明显优于月桂酸蔗糖酯和δ-葡萄糖酸内酯;而GML与其余3种抑菌剂复配后均存在不同程度的协同增效作用,其中GML与Nisin复配后效果最佳。由本研究可知,GML作为一种安全高效的抑菌剂,可单独或与其他抑菌剂复配后应用于豆腐类产品的防腐保鲜。

表4 GML与其余常用抑菌剂的复配抗菌活性(pH=6.25)Table 4 The combined antibacterial ability of GML and other commonly used antibacterials(pH=6.25)
[1]James W Anderson,Belinda M Smith,Carla S Washnock.Cardiovascular and renal benefits of dry bean and soybean intake[J].American Journal of Clinical Nutrition,1999,70(3):464-474.
[2]王敏.非发酵性豆制品(豆腐丝)主要腐败细菌的分离鉴定及其防腐研究[D].保定:河北农业大学,2004.
[3]谷大海,常青,刘华.豆腐的研究概况与发展前景[J].农产品加工,2009(6):76-78.
[4]何丽华.豆制品防腐保鲜技术的研究进展[J].现代预防医学,2007,34(2):294-296.
[5]Thomas A,Meekin M,Thomas R.Shelf life prediction:status and future possibilities[J].International Journal of Food Microbiology,1996,33:65-83.
[6]李博.GDL豆腐中的主要腐败微生物的研究及HACCP的建立[D].北京:中国农业大学,2001.
[7]邓勇,腾刚,陈莲伊.盒装豆腐腐败菌的鉴定及其耐热性的研究[J].中国食品学报,1998(3):33-38.
[8]Fouad,K E.,Hegeman G D.Microbial spoilage of Tofu(soybean curd)[J].J Food Protect,1993,56(2):157-164.
[9]Tuitemwong K,Fung D Y C.Microbiological study of Tofu[J]. J Food Protect,1991,54(13):212-216.
[10]柳玉,郭顺堂.微生物在大豆籽粒中的分布及其对豆制品加工的影响[J].大豆科学,2007,26(4):578-579.
[11]Dostson C R,Frank H A,Cavaletto C C.Indirect methods as criteria of spoilage in tofu(soybean curd)[J].J Food Sci,1997,42:273-274.
[12]Hamosh M.Free fatty acids and monoglycerides:antiinfective agents produced during digestion of milk fat by the newborn,immunology of milk and the nonate[M].Mestecky,J.et al,eds,Plenum Press,NY,1991.
[13]冯凤琴,杜鹃,王小刘.食品防腐乳化剂月桂酸单甘油酯及其在食品中的应用[J].中国食品添加剂,2009(S1):173-177.
[14]宋飞,张希,李想,等.单甘油月桂酸酯及其复合保鲜剂对冷鲜肉保鲜效果的研究[J].食品工业科技,2012,33(15):341-344.
[15]Evelyne M,Mary B.Antilisterial effects of free fatty acids and monolaurin in beefemulsionsand hotdogs[J].Food Microbiology,2004(21):815-818.
[16]Maria B,Richard A H.Interaction of monolaurin,eugenol and sodium citrate on growth of common meat spoilage and pathogenic organisms[J].International Journal of Food Microbiology,1998,39:175-183.
[17]张希,何逸波,杜鹃,等.真空包装年糕保鲜剂研究[J].浙江大学学报:农业与生命科学版,2013,39(2):209-214.
[18]Zhang H,Zhang L,Peng L J,et al.Quantitative structureactivity relationship of antimicrobial fatty acids and derivatives against Staphylococcus aureus[J].Journal of Zhejiang University Science B,2012,13(2):83-93.
[19]Branenl J K,Davidson P M.Enhancement of Nisin,lysozyme,and monolaurin antimicrobial activities by ethylenediaminetetraacetic acid and lactoferrin[J].International Journal of Food Microbiology,2004,90:63-74.
[20]宋飞.单月桂酸甘油酯在冷鲜肉保鲜中的应用研究[D].济南:山东轻工业学院,2012.
[21]Parish M E,Davidson P M.Methods for evaluation Antimicrobials in Foods[M].NY:Marcel Dekker,1993:597-615.
[22]Cotton L N,Marshall D L.Monolaurin preparation method affects activity against vegetative cells of Bacillus cereus[J]. LWT-Food Science and Technology,1997,30(8):830-833.
[23]罗欣,朱燕.Nisin在牛肉冷却肉保鲜中的应用研究[J].食品科学,2000,21(3):53-57.
Separation,identification and control of spoilage bacteria in tofu
YANG Ming1,CHEN Xin-yu1,ZHANG Hui1,2,*,FENG Feng-qin1,2,*
(1.School of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China;2.Fuli Institute of Food Science,Zhejiang University,Hangzhou 310058,China)
In this study,spoilage microorganisms were separated and characterized from firm tofu in bulk and boxed lactone tofu,the relationship between spoilage phenomena and putrefaction-making bacteria was preliminarily studied through pathogens inoculation experiments.Meanwhile,four food additives with bacteriostatic function were chosen to inhibit the spoilage microorganisms,including glycerol monolaurate(GML),sucrose monolaurate,glucono-δ-lactone and Nisin.The minimum inhibitory concentrations(MIC)of each antibacterial agent and synergistic effects between GML and other antimicrobial agents were measured.Result showed that there were four kinds of spoilage microorganisms which led to corruption of tofu:Brevibacillus,Enterobacter,Lactobacillus and Leuconostoc.The first three strains could cause clamminess,sack expanding and softening of tofu respectively.Antibacterial activities of GML or Nisin against each spoilage microorganism mentioned above were better than others.The synergistic effect of GML and Nisin was the best,especially for Brevibacillus,Lactobacillus and Leuconostoc.This paper would lay a foundation of future study on new and efficient preservative added to tofu to prolong the shelf life.
Tofu;spoilage microorganisms;spoilage phenomena;glycerol monolaurate(GML);minimum inhibitory concentration
TS201.1
A
1002-0306(2014)12-0218-05
10.13386/j.issn1002-0306.2014.12.039
2013-11-19 *通讯联系人
杨明(1990-),女,硕士研究生,研究方向:食品添加剂。
国家自然科学基金(31071501);植物食品加工技术科技创新团队(2010R50032)。

