虾有效致敏组分的提取及在sIgE检测中的初步应用*
任 杰 单立新 李韶深 陈 凯 侯丽英 李会强△
食物过敏已成为当今社会常见卫生问题之一,流行病学研究资料显示,成年人食物过敏性疾病患病率为1%~2%[1]。食物过敏性疾病主要通过病史、体内皮肤点刺试验和体外血清特异性IgE(specific IgE,sIgE)检测等方法来诊断。检测血清sIgE是确定过敏原的重要方法之一,已被临床广泛采用[2]。检测血清sIgE是基于抗原-抗体特异性结合的原理[3],即用食物提取蛋白溶液作为已知抗原包被在固相材料表面,以实现对未知抗体的检测。食物蛋白组分复杂,只有获取有效过敏原成分,才能提升血清sIgE检测结果的灵敏度。中华对虾是一种常见过敏性食物,研究表明原肌球蛋白虽然是虾肉中一种重要过敏原[4],但并不是唯一、特有的过敏原[5]。因此,若使用虾蛋白总提取物作为包被抗原,必定会影响检测敏感度;若使用单一组分作为包被抗原,很有可能因为过敏原的地域性差异而导致检验结果的假阴性。本课题组前期研究结果表明:与血清sIgE相结合的虾蛋白组分主要集中在分子质量大于70 ku的蛋白,并且有些条带反应较强[6]。本研究通过分离出虾中的大蛋白组分,并以此作为血清sIgE检测的包被(已知)抗原,观察能否有效提高虾类sIgE检测结果的敏感性。
1 材料与方法
1.1 材料
1.1.1 主要仪器 垂直板型电泳仪、凝胶成像系统、电转印槽(美国BIO-RAD公司);紫外分光光度计(美国Thermo sci⁃entific公司);EXL-800型酶标分析仪(Biotek公司)。
1.1.2 主要试剂 丙烯酰胺、甲叉双丙烯酰胺、甘氨酸、过硫酸铵、十二烷基磺酸钠(SDS)、四甲基乙二胺(TEMED)、吐温-20(Tween-20)均购自美国Sigma公司;蛋白分子质量标准SM0671(MBI Fermentas公司);聚偏二氟乙烯(PVDF)购自美国Millipore公司;马抗人IgE-HRP抗体(美国Southern Biotech公司);兔抗人IgE-AP抗体(美国Jackson Immunoresearch公司);96孔酶标反应板(美国Costar公司)。
1.1.3 阳性患者血清和阴性对照血清 血清标本均来自天津市北辰医院。虾过敏患者血清共14例,均采用德国Medi⁃wiss公司生产的Allergy Screen过敏原检测系统检测sIgE的含量。且患者皮肤点刺试验均出现了不同程度的阳性反应。阴性对照血清5例:来自健康体检者,无过敏家族史、无食物过敏史、血清总IgE水平在正常范围(20~200 IU/mL)。血清均保存于-20℃备用。
1.2 方法
1.2.1 酶联免疫印迹法分析与血清sIgE结合的虾蛋白组分 (1)提取虾蛋白溶液(命名为Native),经SDS-PAGE技术分析蛋白组分。样品蛋白浓度为14 g/L,蛋白样品与上样缓冲液1∶2混合,煮沸5 min,上样20 μg;分离胶12%,堆积胶5%。以65 V电压堆积样本,135 V电压分离样品1 h。(2)蛋白转印。采用湿转方式,250 mA恒流,湿转60 min,将蛋白条带湿转至PVDF膜上,后经5%脱脂牛奶4℃封闭过夜,风干后备用。(3)免疫印迹。将14例阳性和1例阴性血清1∶10稀释后,分别和PVDF膜孵育3 h;TBST洗膜5次后加入1∶250稀释的兔抗人IgE-AP抗体,室温孵育1 h;TBST洗膜5次;加入AP显色底物避光显色15 min;将膜取出用蒸馏水洗净,吹干后观察显色条带。
1.2.2 葡聚糖凝胶层析法分离虾有效致敏蛋白 采用Se⁃phrose 6B葡聚糖填充材料填充XK-50层析柱,用0.01 mol/L pH 7.4 PBS缓冲液平衡柱子,先将虾蛋白溶液经0.22 μm孔径大小的滤膜滤除杂质后上样。以1 mL/min的流速洗脱蛋白,每管收集量为1 mL,核酸/蛋白检测仪器检测280 nm处光吸收,后经SDS-PAGE观察层析效果。
1.2.3 两种已知抗原溶液用于sIgE检测的比较 分别采用酶斑点印迹法和间接酶联免疫吸附试验(间接ELISA法)对两种已知抗原进行评价,虾蛋白溶液经Sephrose 6B葡聚糖分离获得的第一个收集峰命名为peak1-6B,以下均以此命名。(1)酶斑点印迹法。将剪裁好的NC膜在TBS中浸泡10 min,取出用滤纸吸干,备用。将Native和peak1-6B分调至5 g/L(0.01 mol/L TBST),分别取2 μL点样于NC膜上,自然风干。将膜浸泡于5%的脱脂奶,37℃封闭30 min。0.01 mol/L TBST洗膜3次。将2 μL1∶5(TBST)稀释的5例不同sIgE效价(0.47、3.2、8.6、19、34 kU/L)虾过敏患者血清和1例阴性对照血清作为一抗,分别点样于包被好抗原的NC膜上,37℃反应1 h。TBST洗3遍后,加入2 μL 250倍稀释的兔抗人IgE-AP抗体,37℃温育30 min。洗膜后加入AP底物显色,观察结果。(2)间接ELISA法。将Native和peak1-6B分别调整至50 mg/L(稀释液0.1 mol/L pH7.4 PBS),每孔150 μL,37℃孵育2 h,4℃过夜,包被96孔微孔板。次日用洗液(0.01 mol/L pH7.4 TBST)洗涤5次。每孔加250 μL,2%PVA37℃温育2 h,4℃过夜封闭,次日洗涤5次。分别加入1∶10稀释(0.1 mol/L pH7.4PBS+2%Base)的阳性血清和阴性对照血清,37℃温育1 h。洗板后加入1∶300稀释的马抗人IgE-HRP抗体,37℃温育30 min后洗板。加入底物,避光显色15 min,最终使用Biotek EXL-800酶标仪测定450 nm处的吸光度值(A450)。
2 结果
2.1 Native中与虾过敏患者血清sIgE结合的组分 Native组分的SDS-PAGE分析结果如图1a所示,至少有15条可辨认的蛋白显色条带。Native免疫印迹结果可见阴性对照血清在33 ku处有较弱的显色条带,推测33 ku蛋白存在正常人的非特异性反应。14例虾过敏患者的血清sIgE主要和Native中大于55 ku的多种蛋白发生反应。该处的显色条带较多,且有些条带的颜色较深,见图1b。
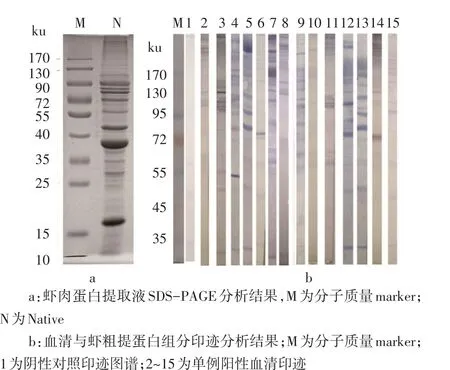
Figure 1 Results of components of Native protein and the effective sensitization component图1 Native中蛋白组分以及有效致敏反应组分分析结果
2.2 Sepharose 6B分离虾有效致敏成分结果 蛋白检测仪器检测280 nm处发光蛋白层析图谱,首先被洗脱的是大分子蛋白组分(peak1-6B),见图2a。收集该组分,进行peak1-6B的SDS-PAGE分析,结果显示,peak1-6B中的主要成分为55 ku以上的大蛋白组分,而分离前37 ku和20 ku处含量相对较高的小分子蛋白被去除,见图2b。

Figuer 2 Results of Atlas gel chromatography and the SDS-PAGE of peak1-6B图2 凝胶层析分离图谱(a)与peak1-6B的SDS-PAGE结果(b)
2.3 两种蛋白溶液作为已知抗原检测血清sIgE结果的比较 5例阳性患者和1例阴性对照血清的斑点印迹结果见图3a。Image J软件分析不同斑点的灰度值的点图见图3b。患者血清中sIgE含量较低时,有peak1-6B作为抗原的检测体系有较高的敏感度。间接ELISA法结果显示:14例虾过敏患者中,4号患者的Native作为包被抗原的A值高于peak1-6B组,其余13例患者血清以peak1-6B作为包被抗原的A值均高于Native组,见图4。
3 讨论
现今过敏原检测试剂盒的抗原成分多是从食物中提取的包含全部蛋白组分的粗制品,但并不是所有的蛋白组分都是引起患者过敏的有效致敏原,这就导致了诊断试验的假阴性结果[7]。虾过敏原研究具有明显的地域差异,2010年,Rahman研究小组使用质谱分析技术证明了原肌球蛋白是黑虎虾中的主要致敏蛋白[8]。天津食品生物技术重点实验室研究结果显示:凡纳滨对虾的主要过敏原为99、33、19、14 ku的蛋白质组分;刀额新对虾的主要过敏原为33 ku和24 ku的蛋白质组分[9]。本研究显示大于55 ku的虾蛋白组分是和患者血清反应的主要致敏成分,因此,提取与虾过敏患者血清结合较强,但相对含量低的蛋白组分,以此作为血清sIgE检测的已知抗原,必然会提高方法学的敏感度。本研究以55 ku为界,采用分子筛层析技术对虾蛋白提取液进行初步纯化,从SDS-PAGE结果可以看出,应用Sepha⁃rose 6B层析后,55 ku以上的大蛋白得到了初步的分离和浓缩,虽然没有获得纯品蛋白,但从免疫化学角度看,本研究已经获得与待检sIgE结合的大部分蛋白组分,可用于已知抗原检测血清sIgE。

Figure 3 Results of dot blot analysis of peak1-6B图3 peak1-6B斑点印迹分析结果
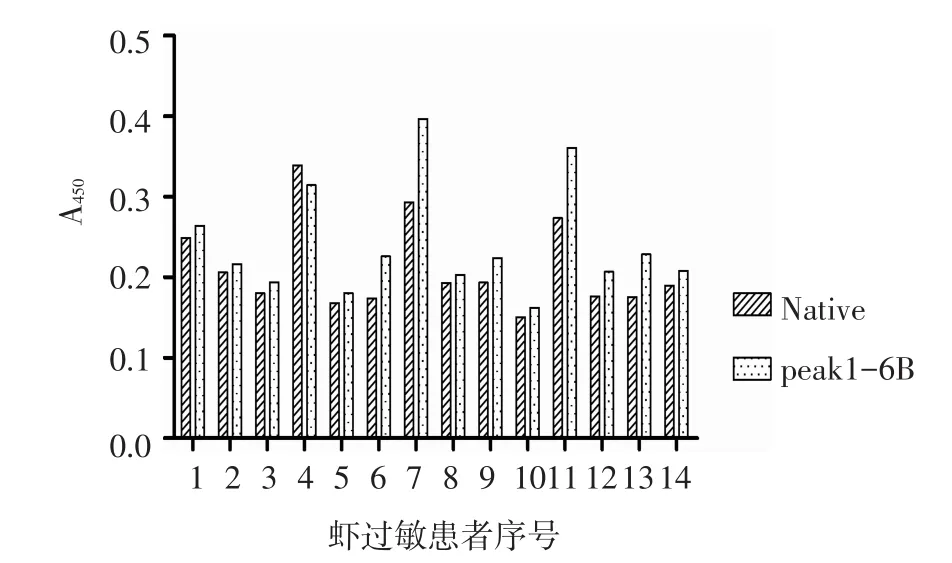
Figure 4 Comparison of the patient sIgE detected by indirect ELISA using two different antigens图4 两种抗原间接ELISA法检测患者sIgE的比较
本研究选取了IgE效价由低到高的5例患者及1例健康对照的血清,进行斑点印迹实验结果显示:当过敏患者血清效价较低时(2、3、4号)peak1-6B组分斑点的灰度值明显高于Native斑点的灰度值。而当抗体效价增高时,两种蛋白组分的灰度值差异减小。因此,笔者认为,提取的peak1-6B组分可以在患者血清中sIgE含量较低时有效提高检测敏感度。接下来,本研究使用间接ELISA法对14例虾过敏患者血清进行分析,结果4号患者的Native作为包被抗原的OD值高于peak1-6B作为检测抗原的OD值。根据4号患者的免疫印迹结果,笔者推测,由于4号患者和虾蛋白中小于55 ku的一些组分也有较强的反应,因此使用Native包板的结果高于使用peak1-6B包板的结果,但此现象不具有普遍性。本研究提示,大部分虾过敏患者血清sIgE结合的虾蛋白组分主要集中在分子质量较大的蛋白。虾有效致敏成分作为检测抗原能有效提高检测结果的信号值,这对提高过敏原检测的敏感度具有潜在意义。
[1] 廖泽芳,宁陵.中国对虾产业分析[J].海洋开发与管理,2009,26 (4):31-35.doi:10.3969/j.issn.1005-9857.2009.04.007.
[2]Wang J,Godbold JH,Sampson HA.Correlation of serum allergy (IgE)tests performed by different assay systems[J].J Allergy Clin Immunol, 2008, 121(5): 1219- 1224. doi: 10.1016/j.ja⁃ci.2007.12.1150.
[3]Siles RI,Hsieh FH.Allergy blood testing:A practical guide for clini⁃cians[J].Cleve Clin J Med,2011,78(9):585-592.doi:10.3949/ ccjm.78a.11023.
[4] Gámez C,Sánchez-García S,Ibáñez M D,et al.Tropomyosin IgE-positive results are a good predictor of shrimp allergy[J].Allergy, 2011,66(10):1375-1383.doi:10.1111/j.1398-9995.2011.02663.x. [5]Ayuso R,Grishina G,Sampson HA,et al.Sarcoplasmic calciumbinding protein is an EF-hand-type protein identified as a new shrimp allergen[J].J Allergy Clin Immunol,2009,124(1):114-120. doi:10.1016/j.jaci.2009.04.016.
[6] 单立新,任杰,李会强,等.中国对虾肉中与虾过敏患者血清特异性IgE结合的组分分析[J].中国食品卫生杂志,2013,25(6): 494-497.
[7] Sampson HA.Food allergy[J].J Allergy Clin Immunol,2003,111 (2):S540-S547.doi:10.1067/mai.2003.134
[8]Abdel Rahman AM,Kamath S,Lopata AL,et al.Analysis of the al⁃lergenic proteins in black tiger prawn(Penaeus monodon)and char⁃acterization of the major allergen tropomyosin using mass spectrom⁃etry[J].Rapid Commun Mass Spectrom,2010,24(16):2462-2470. doi:10.1002/rcm.4664.
[9]吴海明,胡志和,王超.免疫印迹法对4种海虾主要过敏原的鉴定[J].食品科学,2010,31(16):274-277.

