非小细胞肺癌患者手术前后血清EGFR水平变化在预后判断中的应用价值
王 勇,李俊杰,王小平
非小细胞肺癌患者手术前后血清EGFR水平变化在预后判断中的应用价值
王 勇,李俊杰,王小平
目的观察表皮生长因子受体(EGFR)在非小细胞肺癌(NSCLC)患者手术前后血清水平变化的情况。方法 采用酶联免疫吸附试验(ELISA)检测78例NSCLC、127例良性肺疾病患者和205例健康体检者血清中EGFR的含量,以ROC曲线分析确定血清EGFR的Cut-off值,探讨NSCLC术前EGFR含量与临床病理指标、生存情况的关系,并根据手术前后血清EGFR含量的变化情况分析其在预后判断中的应用价值。结果 NSCLC组术前血清中EGFR含量高于良性对照组组和健康对照组(P<0.05)。ROC曲线分析EGFR的Cut-off值为6.75μg/L。logistic回归分析显示,有吸烟史、较高的TNM分期和出现淋巴结转移是NSCLS患者术前血清EGFR升高的危险因素。生存分析表明术前EGFR高表达组和术后EGFR>6.75μg/L的患者生存时间显著缩短(P<0.05)。Cox比例风险回归模型分析表明术前较高的血清EGFR水平是影响患者生存时间的独立危险因素。结论 对于接受肺癌根治术治疗的患者,检测术后早期血清EGFR含量变化对于预后判断有较好的应用价值。
肺肿瘤;癌,非小细胞肺;受体,表皮生长因子;预后
肺癌是世界范围内发病率和病死率最高的恶性肿瘤之一。据统计,美国仅2013年就有228 190例新发肺癌病例,在所有恶性肿瘤中仅次于前列腺癌,发病率居第二位;死亡病例数为159 480例,病死率居第一位[1]。根据病理类型可分为非小细胞肺癌(non-small cell lung cancers,NSCLC)和小细胞肺癌(small cell lung cancers,SCLC),其中 NSCLC 约占80%[2]。随着外科技术的发展和分子靶向药物的出现,NSCLC的总体疗效有了较大的改善,但因基因和生理情况的不同,患者的预后有较大差异[3]。表皮生长因子受体(epidermal growth factor receptor,EGFR)是表达于细胞膜表面的糖蛋白受体,具有酪氨酸激酶活性,与EGF结合后可激活下游MAPK、PI3K/AKT和JAK/STAT等通路[4-7]。生理情况下,EGF/EGFR通路可发挥促细胞增殖、新生血管形成及抗凋亡等活性;而在肿瘤组织中,EGF/EGFR通路与肿瘤细胞的增殖、黏附、侵袭和转移密切相关,并介导肿瘤血管生成,与肿瘤的恶性生物学行为有直接关系。目前研究表明,EGFR在NSCLC患者的癌组织和血清中高表达[8-11]。但这些研究多集中在癌组织中EGFR表达与临床病理指标的关系,对于血清EGFR水平、特别是手术前后血清EGFR水平的变化在NSCLC患者预后判断中的应用价值,尚无相关报道。为此,本研究对比分析了78例NSCLC患者手术前后血清EGFR含量变化情况,并进行生存情况随访,初步明确了术后血清EGFR含量变化在NSCLC患者预后判断中的应用价值。
1 材料与方法
1.1 病例资料 收集2005年1月—2010年5月在陕西省安康市中心医院胸外科确诊并接受手术治疗的82例NSCLC患者的临床资料和手术标本。其中男45例(54.9%),女37例(45.1%);年龄31~77(62.7±14.5)岁,中位年龄62岁。所有患者均接受肺叶切除术或亚肺叶切除术,术中测肿瘤直径为(3.3±2.8)cm。术后病理学检查证实,鳞癌43例(52.4%),腺癌36例(43.9%),细支气管肺泡癌3例(3.7%);低分化 7例(8.5%),中分化32例(39.0%),高分化43例(52.4%)。临床分期采用2009年国际抗癌联盟(UICC)公布的第7版肺癌国际分期法,其中Ⅰ期19例(23.2%),Ⅱ期38例(46.3%),Ⅲ期25例(30.5%)。淋巴结转移者48例(58.5%),无远处转移病例。不吸烟者32例(39.0%),≤400支/年者 11例(13.4%),>400支/年者39例(47.6%)。所有患者术前未行放、化疗,术后恢复4~8周后行化给予铂类为基础的二联用药方案至少4个周期。同时,随机选择良性肺疾病127例作为良性对照组,其中男76例,女51例,年龄(58.3±15.9)岁;随机选择健康体检者205例作为健康对照组,其中男98例,女107例,年龄(62.1±18.3)岁。3组年龄、性别比较差异无统计学意义(P>0.05),具有可比性。
1.2 随访方法 以手术当天为随访开始时间,采取门诊复查或电话随访的方式进行术后随访。随访截止日期为2013-7-31。生存日期为自手术日至死亡日或至末次随访截止日期,以月为单位。随访周期为5~76(41.6±29.4)个月,中位时间为34个月。失访4例,其中男1例,女3例;鳞癌2例,腺癌2例。最终78例完成随访,进入研究。
1.3 血清标本的收集与保存 所有NSCLC患者均于术前1 d和术后4周,采用非抗凝管抽取早晨空腹外周静脉血4 ml,室温放置30 min后以4000 r/min离心10 min,留取血清,-80℃低温冰箱中保存备用。
1.4 血EGFR含量检测 采用ELISA法,试剂盒购自R&D公司,操作方法参照试剂盒说明书。过程如下:将不同浓度的标准品和待测血清样本加入微孔反应板中,100μl/孔;各孔加入生物素化抗体工作液50μl,振荡混匀后室温放置120 min;反应结束后,将各孔内液体吸干并反复洗涤5次;洗涤干燥后再加入酶结合物工作液100μl/孔;振荡混匀后室温放置30min;反应结束后,将各孔内液体吸干并反复洗涤5次;各孔再加入显色剂A、B各50μl,振荡混匀,37℃下避光反应显色10 min;显色结束后,加入终止液50μl,振荡混匀。最后,在490 nm的条件下以酶标仪检测标准品各孔的吸光度,绘制标准曲线后计算得到检测样品内EGFR含量。
1.5 统计学方法 采用SPSS 14.0统计软件进行统计分析,计量资料均用均数±标准差(±s)表示,两样本均数的比较采用Student's t检验,多样本均数的比较采用方差分析,组间比较采用LSD-t检验。计数资料以率(%)表示,采用χ2检验或Fisher精确概率法。多因素分析采用非条件Logistic回归分析。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,以约登指数(Youden index)分析EGFR的阳性判断值(Cut-off值)。Kaplan-Meier法进行生存分析,组间比较采用Log-rank检验,生存变量的多因素分析采用多元逐步Cox比例风险回归模型,α=0.05为检验水准。
2 结果
2.1 血清中EGFR含量 NSCLC组、良性对照组和健康对照组术前血清EGFR含量分别为(14.31±4.04)、(4.72±2.15)和(3.53±2.29)μg/L,NSCLC组术前血清EGFR含量显著高于其他两组(t=2.626,P=0.009;t=2.383,P=0.017)。
2.2 ROC曲线分析结果与血清EGFR的Cut-off值NSCLS组术前血清、良性对照组和健康对照组血清EGFR数值绘制ROC曲线(图1),其曲线下面积(area under the curve,AUC)为 0.909(95%CI:0.866,0.951)。最大约登指数(灵敏度+特异度-1)为0.706,此时灵敏度为0.792,特异度为0.914,EGFR的Cut-off值为6.75μg/L。

图1 非小细胞肺癌术前血清表皮生长因子受体水平的ROC曲线
2.3 NSCLS组术前EGFR含量与临床病理指标的关系 以6.75μg/L为标准,按照术前EGFR血清含量检测结果,将78例NSCLS组分为低表达组(≤6.75μg/L)27例和高表达组(>6.75 μg/L)51例。单因素统计分析表明,血清EGFR表达水平与吸烟、肿瘤大小、淋巴结转移和TNM分期有关。吸烟>400支/年、肿瘤直径>3.0 cm、有淋巴结转移和较高的TNM分期的患者,其术前血清EGFR的含量显著升高;而患者的性别、年龄,肿瘤的组织学类型和分化程度等因素与血清EGFR的含量无关,见表1。将上述单因素分析的阳性指标进行非条件Logistic回归分析。Y=0为血清EGFR低表达,Y=1为血清EGFR高表达。变量赋值如下:无吸烟史=0,吸烟≤400支/年为1,吸烟 >400支/年为2;肿瘤大小:肿瘤直径 <3.0 cm 为1,≥3.0 cm 为2;TNM I期为1,Ⅱ期为2,Ⅲ期为3;淋巴结转移:无=0,有=1。Logistic回归分析结果表明,有吸烟史、较高的TNM分期和出现淋巴结转移是NSCLS患者术前血清EGFR含量升高的危险因素,见表2。

表1 非小细胞肺癌血清表皮生长因子受体含量与临床病理指标的关系[例(%)]
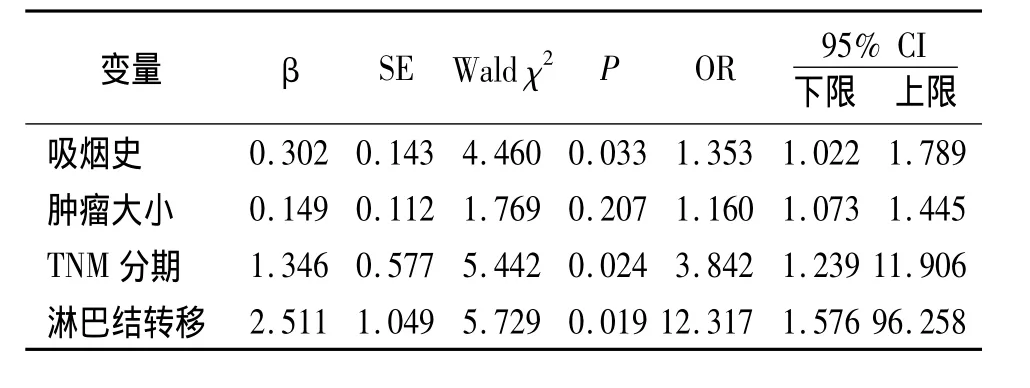
表2 影响非小细胞肺癌血清表皮生长因子受体含量危险因素非条件Logistic回归分析
2.4 NSCLS组术前血清EGFR含量与生存情况的关系 Kaplan-Meier生存分析表明,EGFR高表达组和低表达组3年生存率分别为64.7%和81.5%,5年生存率分别为41.2%和55.6%。高、低表达组的中位生存时间分别为32、52个月。高表达组生存时间短于低表达组,差异有统计学意义(χ2=10.549,P=0.001),见图2。
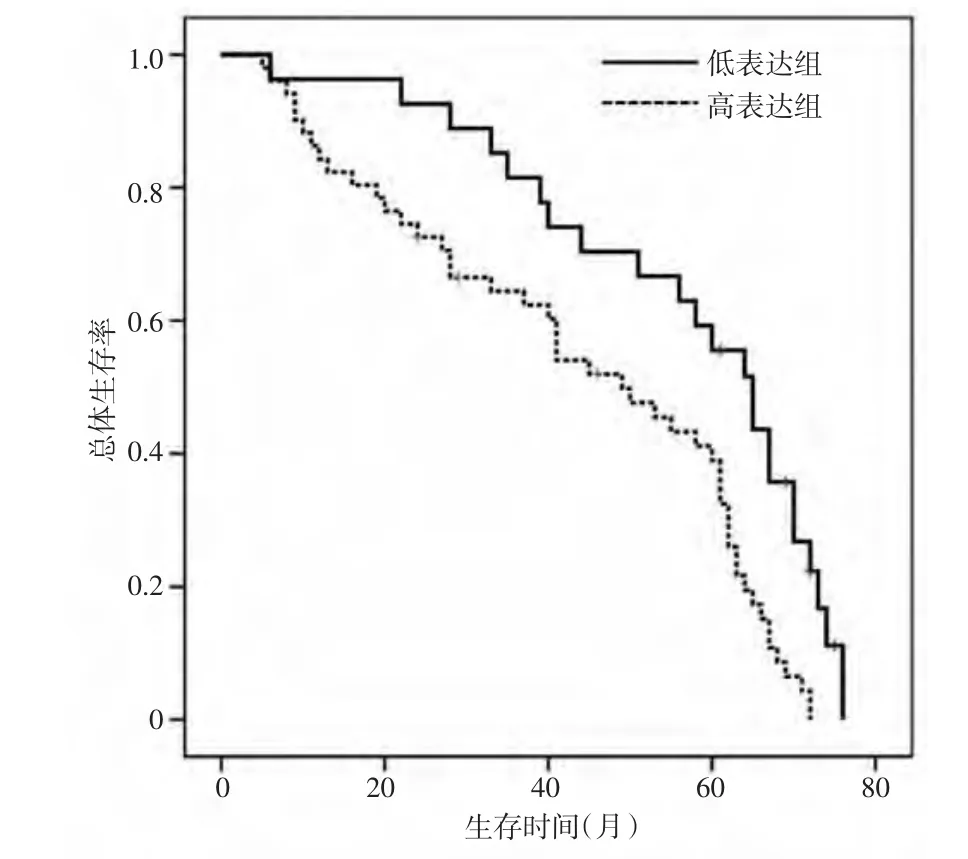
图2 非小细胞肺癌术前血清表皮生长因子受体高、低含量生存曲线
2.5 NSCLS手术前后血清EGFR含量变化与生存情况的关系 根据手术前后血清EGFR含量的变化,将78例NSCLS患者分为3组:①术前后EGFR≤6.75μg/L,记为 N组 27例;②术前 EGFR>6.75μg/L,但术后≤6.75μg/L,记为D组33例;③术后EGFR>6.75μg/L,记为I组18例。Kaplan-Meier生存分析表明,N组3、5年生存率分别为81.5%和55.6%;D组为84.8%和51.5%;I组分别为27.8%和22.2%。N、D、I组中位生存时间分别为61、49、20个月。与N组比较,D和I组生存率显著降低(χ2=5.292,P=0.021;χ2=16.529,P <0.001);与D组比较,I组的生存率显著降低(χ2=8.838,P=0.003),见图3。
2.6 影响NSCLS患者生存率的危险因素筛选 采用多元逐步Cox比例风险回归模型对影响NSCLS患者生存率的危险因素进行筛选。变量赋值见表3。结果表明,有吸烟史、较高的TNM分期、较低的分化程度、出现淋巴结转移和术前较高的血清EGFR水平是影响患者生存时间的独立危险因素;而性别、年龄、肿瘤大小和组织学类型与患者生存时间无相关性,见表4。

图3 非小细胞肺癌术前、后血清表皮生长因子受体含量生存曲线

表3非小细胞肺癌组生存率影响因素与变量赋值

表4 多元逐步Cox比例风险回归模型筛选与生存率相关的影响因素
3 讨论
EGFR在NSCLC患者中的表达规律已较明确。Ruschoff等[11]采用免疫组化染色法(immunohistochemistry,IHC)对30例NSCLC肿瘤组织内EGFR蛋白表达情况进行检测,发现阳性率为33.3%,可疑阳性为30.0%。赖繁彩等[12]应用FISH法检测64例NSCLC患者癌组织中EGFR基因扩增情况,阳性率为 56.3%。Jiang等[13]收集了 399例 NSCLC患者的癌组织,IHC检测结果表明,EGFR蛋白阳性表达率为63.9%。Kappers等[14]对采用酶联免疫吸附法(ELISA)对102例进展期NSCLC患者的血清EGFR含量进行检测,结果表明其含量为48~72μg/L,平均含量为55.9 μg/L;且组织恶性程度越高,EGFR含量越高(鳞癌>腺癌>未分化癌)。近期,Kalogeraki等[15]研究显示,IHC 检测 EGFR 在NSCLC肿瘤组织中的阳性表达率为22.2%,且多集中在女性腺癌患者中。由于样本和检测方法的不同,各研究报道的EGFR阳性率及血清含量有所差异,但在NSCLC患者体内EGFR的表达呈升高趋势是较一致的结论。本研究的结果也与此相似,与健康对照组和良性对照组相比,NSCLC组患者术前血清EGFR含量显著升高。由于血清学检测是一种创伤小且采样方便的检测方法,因此外周血EGFR检测具有较好的临床筛查价值。另外,采用多因素Logistic回归分析,本研究进一步确定吸烟史、TNM分期和淋巴结转移是影响NSCLC患者血清中EGFR含量的危险因素。这提示外周血EGFR蛋白的表达水平升高可作为淋巴结转移的判断依据,对早期判断是否发生转移具有一定的参考价值。
虽然EGFR在NSCLC中的分布和表达情况已较为明确,但其在预后判断中的应用价值目前还有较大争议。Ko等[16]对来自6个医学中心的NSCLC进行高通量的微列阵芯片分析,发现患者年龄、性别、临床分期、吸烟史、Myc和EGFR/KRAS/ALK水平是影响预后的独立危险因素。Gately等[17]在184例NSCLC患者的肿瘤组织标本中检测到EGFR的阳性表达率为53.8%,显著高于癌旁组织;且EGFR与胰岛素样生长因子1受体(insulin-like growth factor receptor 1,IGF1R)呈现共表达趋势,EGFR和IGF1R双阳性患者的生存情况较差。而Ciledag等[18]进行了一项包括43例NSCLC患者的回顾性分析研究,却发现血清EGFR与临床分期、组织学类型等临床病理指标以及生存时间比较无统计学差异。这些研究大多讨论了癌组织中EGFR表达与临床病理指标的关系,而对于血清EGFR水平,特别是手术前后血清EGFR水平的变化在预后判断中的应用价值,未作研究。针对此问题,本研究首先分析了术前血清EGFR与生存情况的关系,发现术前EGFR高表达组的生存时间较低表达组显著缩短;而多因素的Cox比例风险回归模型分析也表明,术前较高的EGFR是影响生存时间的独立危险因素,进而联合术后血清EGFR变化情况,将患者进一步细分为术前、术后均正常,术前升高、术后正常,以及术后升高3种情况,对比分析发现术后EGFR水平在正常参考值范围内的患者生存情况显著优于水平升高者。提示在NSCLC患者接受手术治疗后,其血清EGFR含量可作为判断预后的重要参考指标。对于术后EGFR含量依然升高的患者,应考虑联合应用其他治疗手段,如分子靶向药物、中医药等,以改善预后、延长患者生存时间。
总之,NSCLC患者血清EGFR含量与患者生存时间有较密切的相关性。综合手术治疗前后EGFR水平的变化,可初步判定患者的预后情况,为下一步治疗的开展提供有价值的参考依据。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer JClin,2013,63(1):11-30.
[2] TravisW D,Brambilla E,Noguchi M,et al.Diagnosis of lung cancer in small biopsies and cytology:implications of the2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society Classification[J].Arch Pathol Lab Med,2013,137(5):668-684.
[3] Scheff R J,Schneider B J.Non-small-cell lung cancer:treatment of late stage disease:chemotherapeutics and new frontiers[J].Semin Intervent Radiol,2013,30(2):191-198.
[4] Dahabreh I J,Linardou H,Siannis F,et al.Somatic EGFRmutation and gene copy gain as predictive biomarkers for response to tyrosine kinase inhibitors in nonsmall cell lung cancer[J].Clin Cancer Res,2010,16(1):291-303.
[5] Cagle P T,Allen TC,Olsen R J.Lung cancer biomarkers:present status and future developments[J].Arch Pathol Lab Med,2013,137(9):1191-1198.
[6] Rosell R,Bivona TG,Karachaliou N.Genetics and biomarkers in personalisation of lung cancer treatment[J].Lancet,2013,382(9893):720-731.
[7] Chong C R,Janne PA.The quest to overcome resistance to EGFR-targeted therapies in cancer[J].Nat Med,2013,19(11):1389-1400.
[8] Pirker R,Pereira JR,von Pawel J,et al.EGFR expression as a predictor of survival for first-line chemotherapy plus cetuximab in patients with advanced non-small-cell lung cancer:analysis of data from the phase3 FLEX study[J].Lancet Oncol,2012,13(1):33-42.
[9] Pirker R,Pereira J R,Szczesna A,et al. Prognostic factors in patients with advanced non-small cell lung cancer:data from the phase III FLEX study[J]. Lung Cancer,2012, 77( 2) : 376-382.
[10] O'Byrne K J,Gatzemeier U,Bondarenko I,et al. Molecular biomarkers in non-small-cell lung cancer: a retrospective analysis of data from the phase 3 FLEX study [J]. Lancet Oncol,2011, 12( 8) : 795-805.
[11] Rüschoff J,Kerr K M,Grote H J,et al. Reproducibility of immunohistochemical scoring for epidermal growth factor receptor expression in non-small cell lung cancer: round robin test[J]. Arch Pathol Lab Med,2013,137 ( 9) : 1255-1261.
[12] 赖繁彩,陈龙,王斌. 非小细胞肺癌EGFR 基因突变与扩增及下游信号传导蛋白磷酸化与临床病理特征的关系[J]. 肿瘤基础与临床, 2013, 26( 5) : 390-395.
[13] Jiang G,Fan C,Zhang X,et al. Ascertaining an appropriate diagnostic algorithm using EGFR mutation-specific antibodies to detect EGFR status in non-small-cell lung cancer[J]. PLoS One,2013,8( 3) : e59183.
[14] Kappers I,Vollebergh M A,van Tinteren H,et al. Soluble epidermal growth factor receptor ( sEGFR) and carcinoembryonic antigen ( CEA) concentration in patients with non-small cell lung cancer: correlation with survival after erlotinib and gefitinib treatment[J]. cancermedicalscience,2010,4 : 178.
[15] Kalogeraki A,Karvela-Kalogeraki I,Tamiolakis D,et al.ERCC1 expression correlated with EGFR and clinicopathological variables in patients with non-small cell lung cancer. An immunocytochemical study on fine-needle aspiration biopsies samples[J]. Rev Port Pneumol,2014 [Epub ahead of print].
[16] Ko J H,Gu W,Lim I,et al. Ion channel gene expression in lung adenocarcinoma: potential role in prognosis and diagnosis[J]. PLoS One,2014,9( 1) : e86569.
[17] Gately K,Forde L,Cuffe S,et al. High coexpression of both EGFR and IGF1R correlates with poor patient prognosis in resected non-small-cell lung cancer[J]. Clin Lung Cancer,2014, 15( 1) : 58-66.
[18] Ciledag A,Kaya A,Yetkin O,et al. The prognostic value of serum epidermal growth factor receptor level in patients with non-small cell lung cancer[J]. Tuberk Toraks,2008, 56( 4) : 390-395.
Value of Preoperative and Postoperative Changes of Serum EGFR Level in Prognosis of Patients with Nonsmall Cell Lung Cancer
WANG Yong1,2,LIJun-jie3,WANG Xiao-ping1(1.Department of Thoracic Surgery,Tangdu Hospital,Fourth Military Medical University of PLA,Xi'an 710038,China;2.Department of Thoracic Surgery,Central Hospital of Ankang City,Ankang,Shaanxi 725000,China;3.Emergency Department,Xijing Hospital,Fourth Military Medical University of PLA,Xi'an 710032,China)
ObjectiveTo observe the changes of serum epidermal growth factor receptor(EGFR)level in patientswith non-small cell lung cancer(NSCLC)before and after operation.MethodsSerum EGFR contentsof78 patientswith NSCLC(group A),127 patients with benign pulmonary disease(group B)and 205 healthy people taking medical examination(group C)were detected with enzyme linked immunosorbent assay(ELISA),and the Cut-off values of serum EGFR were analyzed with ROC curve.The relationships between preoperative EGFR levels with clinical pathological indexes and survival rate were investigated,and the value of the serum EGFR content in prognosiswas analyzed according to the changesbefore and after the operation.ResultsPreoperative serum EGFR content in group A was significantly increased compared with those in group B and C(P<0.05).The Cut-off value of EGFR analyzed with the ROC curvewas6.75 μg/L.Logistic regression analysis showed that the history of smoking,higher TNM stage and lymph nodemetastasiswere the risk factors of high serum EGFR level of NSCLSpatients.Survival analysis showed that survival time was significantly shortened in patientswith preoperative high EGFR expression and patientswith postoperative EGFR> 6.75μg/L(P<0.05).Cox proportional hazards regression models showed that the preoperative high serum EGFR levelwas an independent factor of influencing the survival time.ConclusionIt is valuable to detect postoperative early changes of serum EGFR content for lung cancer patients undergoing radical resection.
Lung neoplasm;Carcinoma,non-small-cell lung;Receptor,epidermal growth factor;Prognosis
R734.2
A
2095-140X(2014)04-0055-05
10.3969/j.issn.2095-140X.2014.04.016
国家自然科学基金资助项目(81201926,81300361)
710038西安,第四军医大学唐都医院胸腔外科(王勇、王小平);725000陕西安康,陕西省安康市中心医院胸外科(王勇);710032西安,第四军医大学西京医院急诊科(李俊杰)
王小平,E-mail:wangxpfmmu@126.com
2013-12-02 修回时间: 2014-01-10)
·论著·

