经腹腔联合阿加曲班和依达拉奉对脑出血大鼠神经损伤的影响
周中和,杨 璐,李 巍,李凤鹏,曲 方,韩雅玲,陈会生
经腹腔联合阿加曲班和依达拉奉对脑出血大鼠神经损伤的影响
周中和,杨 璐,李 巍,李凤鹏,曲 方,韩雅玲,陈会生
目的探讨经腹腔联合应用阿加曲班和依达拉奉对脑出血大鼠神经损伤的影响。方法 建立大鼠自体血脑出血模型,随机分为脑出血组、阿加曲班组、依达拉奉组、阿加曲班联合依达拉奉组,每组18只。阿加曲班组术后即刻和12 h分别经腹腔给予阿加曲班干预1次;依达拉奉组术后经腹腔注入依达拉奉,12 h 1次,连用3 d;阿加曲班联合依达拉奉组术后即刻和12 h分别经腹腔给予阿加曲班干预1次,术后12 h经腹腔注入依达拉奉,12 h 1次,连用3 d;脑出血组术后经腹腔注入生理盐水,12 h 1次,连用3 d。造模后及处死前进行神经功能缺损评分(NDS),处死后检测4组TUNEL阳性细胞数、Caspase-3免疫反应细胞数及脑组织水含量、血肿周围脑组织中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。结果 阿加曲班组、依达拉奉组和阿加曲班联合依达拉奉组处死前NDS、TUNEL阳性细胞数、Caspase-3阳性细胞数、脑组织水含量、MDA含量均低于脑出血组,SOD活性高于脑出血组,且阿加曲班联合依达拉奉组上述指标改善情况优于阿加曲班组和依达拉奉组(P<0.05,P<0.01)。结论 经腹腔应用阿加曲班或依达拉奉均可有效地减轻脑出血后的脑水肿、细胞凋亡性损伤以及自由基损伤,二者联合应用效果更佳。
脑出血;阿加曲班;依达拉奉;大鼠,Wistar
脑出血是全球范围内威胁人类健康的严重疾病,目前尚缺乏有效的针对性治疗。近年研究发现,血凝块的毒性作用是脑出血后神经损伤的重要原因,其中凝血酶的神经毒性作用以及血红蛋白分解产物等诱发的自由基损伤是脑出血患者致残的主要机制[1]。有报道针对这两种神经损伤机制采用两种不同类型的药物联合治疗蛛网膜下腔出血效果良好[2],但对于治疗脑出血的效果尚未见相关报道。另有研究报道,单独应用凝血酶抑制剂(阿加曲班)或自由基清除剂(依达拉奉)可以减轻脑出血后的神经损伤[3-7]。本研究建立实验大鼠自体血脑出血模型,经腹腔单用或联合应用阿加曲班和依达拉奉,检测大鼠脑出血后神经功能缺损评分、脑组织水肿、细胞凋亡性损伤以及超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量变化,以期探索针对性的更有效的脑出血治疗手段。
1 材料与方法
1.1 器材与试剂 江湾Ⅱ型动物头颅立体定位仪(上海第二军医大学);50μl微量进样器(浙江省医用器材厂);图像分析系统(德国Leica-MD20);电子天平(上海TG332A型);721分光光度计(上海精密仪表有限公司);阿加曲班溶液(天津药物研究院,10 mg/20 ml);依达拉奉溶液(南京先声药业,30 mg/10 ml);SOD和MDA试剂盒(南京建成生物工程研究所);Caspase-3山羊抗鼠一抗(武汉Boster公司),TUNEL试剂盒(Roche)。
1.2 动物与分组 Wistar大鼠72只(沈阳军区总医院医学实验动物中心提供),雌雄不限,鼠龄10~12个月,体重250~300 g。随机分为脑出血组、阿加曲班组、依达拉奉组、阿加曲班联合依达拉奉组,每组18只,其中6只用于脑水肿检测,6只用于TUNEL以及Caspase-3免疫反应细胞检测,6只用于SOD活性以及MDA含量检测。
1.3 动物模型制备与给药方法 采用“二次注血二次退针法”[8],将50μl大鼠尾血注入大鼠右侧尾状核区建立脑出血模型。所有大鼠模型制备完成后予正常相同条件下饲养,模型制备72 h后处死。阿加曲班组术后(大鼠颅骨头皮缝合完毕)即刻经腹腔注入阿加曲班0.9 mg/kg,12 h后再次经腹腔注入相同剂量阿加曲班1次;依达拉奉组术后即刻经腹腔注入依达拉奉6 mg/kg,以后每12 h注入1次,连续3 d;阿加曲班联合依达拉奉组术后即刻和12 h经腹腔各给予阿加曲班0.9 mg/kg干预1次,同时经腹腔注入依达拉奉6 mg/kg,以后每12 h注入1次,连续3 d,3组阿加曲班和依达拉奉总注入量均为0.6 ml,不足部分均由生理盐水注射液补充;脑出血组术后即刻经腹腔注入0.6 ml生理盐水注射液,每12 h注入1次,连续3 d。
1.4 神经功能缺损评分(NDS)标准 参照Longa FZ 5级评分法[9]:在大鼠脑出血模型制备完成苏醒后以及在处死大鼠前进行NDS。0级:无体征,记0分;Ⅰ级:动物不能完全伸直其前肢,记1分;Ⅱ级:动物一侧肢体瘫痪,有追尾现象,记2分;Ⅲ级:动物不能站立或打滚,记3分;Ⅳ级:无自发性活动,有意识障碍,记4分。NDS在1~4分且处死大鼠取脑时可见脑内血肿形成,表明脑出血模型制备成功。
1.5 脑水肿测定 切取出血侧半球,测得湿重后,将标本放于95℃烤箱24 h后测干重。干湿重测定采用电子天平。脑组织水肿含量=(湿重-干重)/湿重×100%。
1.6 TUNEL阳性细胞检测 应用10%水合氯醛腹腔麻醉后开胸,经左心室插管至升主动脉,右心耳剪一小口为出口,应用生理盐水注射液250 ml灌注后,4%多聚甲醛快速推注,见大鼠肢体变硬变白后,迅速断头取脑,以注入点为中心前后各2 mm处,冠状切除大鼠脑额端及枕端,中间部分继续于4%多聚甲醛磷酸盐缓冲液中4℃固定4~6 h,标本于20%蔗糖多聚甲醛溶液中脱水过夜,再移至4%多聚甲醛溶液中4℃固定2 h,恒温冰冻切片机连续切片,片厚5μm,冷丙酮固定30 min,自然晾干。严格按Roche公司提供TUNEL染色操作规程进行,苏木素复染,胞核棕黄色为阳性细胞,在400倍视野下,观察目的区域3个不重复视野的TUNEL阳性细胞,取均值。
1.7 Caspase-3免疫反应阳性细胞检测 取材切片同TUNEL阳性细胞检测,采用免疫组化二步法对切片进行染色(Caspase-3山羊抗鼠一抗,按1∶50稀释;SABC兔抗山羊通用型二抗,1∶1)。光学显微镜下观察,以胞质呈棕黄色或褐色为Caspase-3 IR细胞。在200倍视野下,观察目的区域3个不重复视野的Caspase-3 IR细胞,取均值。
1.8 SOD和MDA测定 处死大鼠取脑,在冰盘上分离取右侧尾状核区血肿周围脑组织1块(约3 mm×3mm×3mm),称重,加冰生理盐水配成3%脑组织匀浆,将匀浆以4000 r/min离心10min,取上清液,采用黄嘌呤氧化酶法检测SOD活性,采用硫代巴比妥酸法检测MDA含量,分别用721分光光度计在波长550和532 nm处比色测定各管脑组织上清液吸光度值,然后根据试剂盒说明书计算组织中SOD活性和MDA含量。
1.9 统计学方法 采用SPSS 13.0软件进行数据分析。计量资料以均数±标准差(±s)表示,采用单因素方差分析,α=0.05为检验水准。
2 结果
2.1 NDS变化 4组大鼠造模后均出现不同程度的神经功能缺损症状,NDS比较差异无统计学意义(P>0.05)。处死前阿加曲班组、依达拉奉组和阿加曲班联合依达拉奉组NDS均低于脑出血组,且阿加曲班联合依达拉奉组低于阿加曲班组和依达拉奉组(P <0.05,P <0.01),见表 1。
2.2 脑水肿、Caspase-3 IR和TUNEL阳性细胞数脑组织水含量、Caspase-3 IR和TUNEL阳性细胞数阿加曲班组、依达拉奉组和阿加曲班联合依达拉奉组均低于脑出血组,且阿加曲班联合依达拉奉组低于阿加曲班组和依达拉奉组(P <0.05,P <0.01),见表2。
表1 4组脑出血大鼠神经功能缺损评分(±s,分)

表1 4组脑出血大鼠神经功能缺损评分(±s,分)
注:与脑出血组比较,a P <0.05,b P <0.01;与阿加曲班组比较,c P<0.05;与依达拉奉组比较,e P <0.05
组别 鼠数 造模后 处死前脑出血组18 2.89 ±0.75 2.78 ±0.65阿加曲班组 18 2.96 ±0.86 1.61 ±0.50a依达拉奉组 18 3.01 ±0.82 1.72 ±0.46a阿加曲班联合依达拉奉组18 2.90 ±0.73 0.94 ±0.54bce
表2 4组脑出血大鼠脑组织水含量和细胞凋亡性损伤情况(±s)
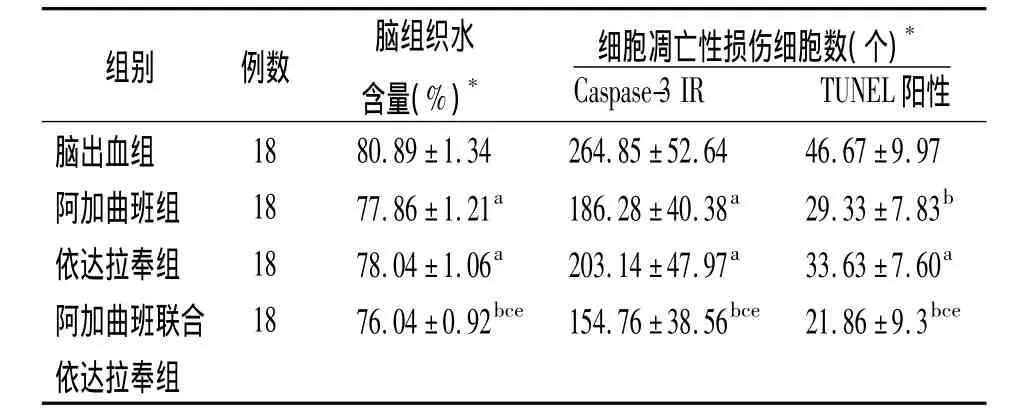
表2 4组脑出血大鼠脑组织水含量和细胞凋亡性损伤情况(±s)
注:*每组18只中6只用于脑水肿检测,6只用于TUNEL以及Caspase-3免疫反应细胞检测;与脑出血组比较,a P<0.05,b P <0.01;与阿加曲班组比较,c P <0.05;与依达拉奉组比较,e P <0.05
组别 例数脑组织水含量(%)*细胞凋亡性损伤细胞数(个)*Caspase-3 IR TUNEL 阳性脑出血组18 80.89±1.34 264.85±52.64 46.67±9.97阿加曲班组 18 77.86±1.21a 186.28±40.38a 29.33±7.83b依达拉奉组 18 78.04±1.06a 203.14±47.97a 33.63±7.60a阿加曲班联合 18 76.04±0.92bce 154.76±38.56bce 21.86±9.3bce依达拉奉组
2.3 SOD活性及MDA含量 与脑出血组比较,阿加曲班组、依达拉奉组和阿加曲班联合依达拉奉组SOD活性均升高,MDA含量均降低,且阿加曲班联合依达拉奉组SOD活性均高于阿加曲班组和依达拉奉组,MDA含量均低于阿加曲班组和依达拉奉组(P <0.05,P <0.01),见表3。
表3 4组大鼠脑血肿周围组织超氧化物歧化酶活性及丙二醛含量(±s)
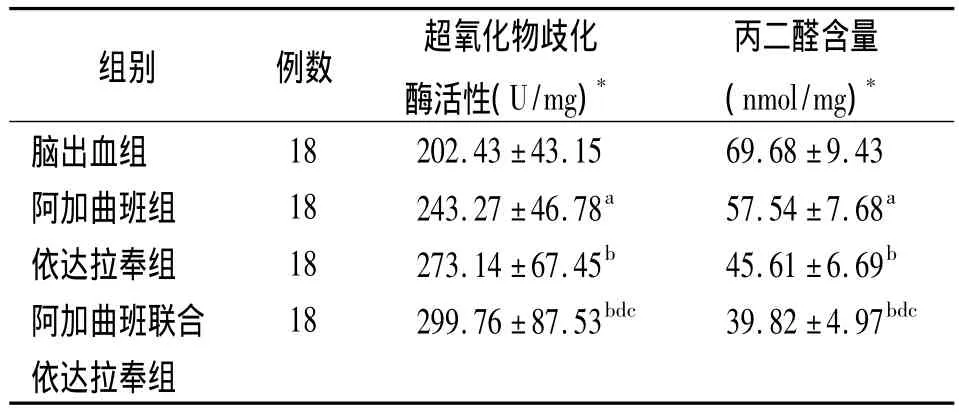
表3 4组大鼠脑血肿周围组织超氧化物歧化酶活性及丙二醛含量(±s)
注:*每组18只中6只用于超氧化物歧化酶活性以及丙二醛含量检测;与脑出血组比较,a P <0.05,b P <0.01;与阿加曲班组比较,d P <0.01;与依达拉奉组比较,c P <0.05
组别 例数 超氧化物歧化酶活性(U/mg)*丙二醛含量(nmol/mg)*脑出血组18 202.43 ±43.15 69.68 ±9.43阿加曲班组 18 243.27 ±46.78a 57.54 ±7.68a依达拉奉组 18 273.14 ±67.45b 45.61 ±6.69b阿加曲班联合 18 299.76 ±87.53bdc 39.82 ±4.97bdc依达拉奉组
3 讨论
脑出血后产生大量凝血酶缓慢释放到组织间隙,而其不仅与脑水肿、细胞凋亡性损伤有关,还能促进自由基的产生,对局部脑组织造成直接而严重的损伤[10];另外凝血酶还可刺激小胶质细胞的活化和增生,转变为吞噬细胞,释放肿瘤坏死因子-α、白介素-6(IL-6)、IL-12等炎性因子和一氧化氮(NO)[11],从而促进自由基产生。另外,凝血酶的神经毒性作用与凝血酶受体PAR-1的介导有关[12],脑出血后自由基损伤与血红蛋白分解产物及多种因素有关[1],但其确切的信号转导通路尚不清楚。阿加曲班具有以下优点:①能与凝血酶活性中心可逆性结合;②仅抑制凝血酶的催化位点;③分子量小,不仅抑制游离的凝血酶,还能有效抑制与血凝块结合的凝血酶,这种结合能力较水蛭素和低分子肝素高1000倍;④不影响纤溶酶活性,出血风险小[13]。动物实验研究提示,应用阿加曲班可减轻脑出血后的水肿及炎性损伤,而且没有增加血肿的容积[3,14]。依达拉奉是捕获自由基的活性抗氧化剂,有清除自由基、抑制脂质过氧化作用,抑制脑细胞、血管内皮细胞、神经细胞的过氧化,减轻组织损伤和脑水肿[13,15],可减轻脑出血后的自由基损害[5,7]。阿加曲班和抗自由基制剂联合应用可更有效地抑制蛛网膜下腔出血后脑血管痉挛[2]。本研究结果显示,脑出血模型制备成功后4组大鼠均出现神经功能缺损,NDS比较差异无统计学意义;单用阿加曲班、依达拉奉均可明显改善脑出血大鼠NDS,使脑组织水肿减轻,血肿周围组织TUNEL阳性细胞、Caspase-3 IR细胞数减少,SOD活性升高,MDA含量降低,与以往研究结果一致[3,7,14,10,16-18];阿加曲班与依达拉奉联合应用上述指标改善更明显,而且显著优于单用阿加曲班或依达拉奉组。提示单用抗凝血酶毒性或抗自由基治疗虽然有效,但不能达到最佳效果,二者联合应用不仅抑制了脑出血后的自由基损伤,还可以减轻脑组织水肿,抑制脑出血后的细胞凋亡性损伤,可能是更好的治疗脑出血的策略。
本研究尚存在一些不足,如反映脑出血神经损伤情况的指标很多,本研究仅选取了几个代表性的指标:NDS是反映神经功能受损的综合性指标;脑水肿、TUNEL阳性细胞、Caspase-3 IR细胞是反映脑出血继发神经损伤的主要指标;SOD是专门清除超氧阴离子()的特异性抗氧化酶,可有效阻断由过量所引起的一系列氧自由基病理性反应加剧;MDA是过氧化脂质氢键断裂后的产物,通过测量MDA含量可以间接反映氧自由基水平。
阿加曲班和依达拉奉的用法、用量参考了他人以及笔者前期的研究[5,14,18-19]。特别是阿加曲班仅在脑出血12 h内应用是因为已有研究证实>12 h即使加大阿加曲班的剂量也不能抑制脑出血神经损伤。理论上来说,作为抗凝剂,阿加曲班是否会导致脑出血血肿扩大是需要探讨的问题,由于我们前期及他人的研究已经证实,早期应用阿加曲班不会导致血肿扩大[14,19],故在本研究中未进行探讨。
[1] Hua Y,Keep R F,Hoff JT,et al.Brain injury after intracerebral hemorrhage:the role of thrombin and iron[J].Stroke,2007,38(2 Suppl):s759-s762.
[2] Kameda K,Kikkawa Y,Hirano M,et al.Combined argatroban and anti-oxidative agents prevents increased vascular contractility to thrombin and other ligands after subarachnoid haemorrhage[J].Br J Pharmacol,2012,165(1):106-119.
[3] Nagatsuna T,Nomura S,Suehiro E,et al.Systemic administration of argatroban reduces secondary brain damage in a ratmodel of intracerebral hemorrhage:histopathological assessment[J].Cerebrovasc Dis,2005,19(3):192-200.
[4] LiG,Fan R M,Chen JL,et al.Neuroprotective effects of Argatroban and C5a receptor antagonist(PMX53)following intracerebral hemorrhage[J].Clin Exp Immunol.2013[Epub ahead of print].
[5] Zhou F,Chen G,Zhang J.Edaravone reduces brain oedema and attenuates cell death after intracerebral haemorrhage in mice[J].Brain Inj,2009,23(4):353-357.
[6] Munakata A,Ohkuma H,Shimamura N.Effect of a free radical scavenger,edaravone,on free radical reactions:related signal transduction and cerebral vasospasm in the rabbit subarachnoid hemorrhage model[J].Acta Neurochir Suppl,2011,110(Pt2):17-22.
[7] Yang J,Liu M,Zhou J,et al.Edaravone for acute intracerebral haemorrhage[J].Brain Inj,2009,23(4):353-357.
[8] 周中和,曲方,何祥,等.一种改良大鼠自体血脑出血模型:二次注血/退针法[J].中国临床神经科学,2004,12(4):406-408.
[9] Longa E Z,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[10] Del Bigio M R,Yan H J,Buist R,et al.Experimental intracerebral hemorrhage in rats.Magnetic resonance imaging and histopathological correlates[J].Stroke,1996,27(12):2312-2319.
[11] Wang J,Tsirka SE.Contribution of extracellular proteolysis andmicroglia to intracerebral hemorrhage[J].Neurocrit Care,2005,3(1):77-85.
[12]Zhou Z H,Qu F,Zhang C D.Systemic administration of argatroban inhibits protease-activated receptor-1 expression in perihematomal tissue in rats with intracerebral hemorrhage[J].Brain Res Bull,2011,86(3-4):235-238.
[13] Matsuo T,Kario K,Kodama K,et al.Clinical application of the synthetic thrombin inhibitor,argatroban(MD-805)[J].Semin Thromb Hemost,1992,18(2):155-160.
[14]周中和,曲方,李晓秋,等.经腹腔应用阿加曲班对脑出血后凝血酶神经毒性的抑制作用[J].中国临床神经科学,2011,19(2):161-167.
[15] Yamamoto T,Yuki S,Watanabe T,et al.Delayed neuronal death prevented by inhibition of increased hydroxyl radical formation in a transient cerebral ischemia[J].Brain Res,1997,762(1-2):240-242.
[16]尚寒冰,胡彦兵,杨德华,等.依达拉奉激活Nrf2通路减轻脑出血后继发性损伤[J].中华神经外科疾病研究杂志,2013,12(1):48-51.
[17]崔洁,曹参祥,郑静,等.脑出血大鼠脑组织MDA、TNF-α仅含量变化及其依达拉奉干预效应的研究[J].第三军医大学学报,2007,29(11):1032-1035.
[18] Nakamura T,Kuroda Y,Yamashita S,et al.Edaravone attenuates brain edema and neurologic deficits in a rat model of acute intracerebral hemorrhage[J].Stroke,2008,39(2):463-469.
[19] Kitaoka T,Hua Y,Xi G,et al.Delayed argatroban treatment reduces edema in a ratmodel of intracerebral hemorrhage[J].Stroke,2002,33(12):3012-3018.
Effect of Intraperitoneal Combined Adm inistration of Argatroban and Edaravone on Neural Injuries in Ratswith Intracerebral Hemorrhage
ZHOU Zhong-hea,YANG Lua,LIWeia,LIFeng-penga,QU Fanga,HAN Ya-lingb,CHEN Hui-shenga(General Hospital of Shenyang Military Area Command,a.Department of Neurology,b.Department of Vasculocardiology,Shenyang 110840,China)
ObjectiveTo investigate the effect of intraperitoneal combined administration of Argatroban and Edaravone on neural injuries in ratswith intracerebralhemorrhage(ICH).MethodsRatmodelswere established by using autologous blood injection.Themodels were divided into ICH group,Argatroban group,Edaravone group and Argatroban combined with Edaravone group(n=18 each).In Argatroban group,Argatroban was administrated intraperitoneally at0 h and 12 h one time respectively after the operation;in Edaravone group,Edaravonewas intraperitoneally injected 1 time/12 h for3 daysafter the operation;in Argatroban combined with Edaravone group,Argatrobanwasadministrated intraperitoneally at0 h and 12 h one time respectively 12 h after the operation,and Edaravonewas injected intraperitoneally 1 time/12 h for 3 days;In ICH group,after the operation,physiological saline was injected intraperitoneally 1/12 h for 3 days.Neurological deficit scores(NDS)ofall ratswere detected after ICH modelswere established and before the rats were killed respectively.TUNEL positive cell numbers,Caspase-3 immunoreactivity(Caspase-3 IR)cell numbers,water content of brain tissues,superoxide dismutase(SOD)activity and malondialdehyde(MDA)content in perihematoma brain tissueswere detected.ResultsCompared with those in ICH group,in the other three groups before the ratswere killed,NDS,TUNEL positive cell numbers,Caspase-3 immunoreactivity cell numbers,water content of brain tissue and MDA contentwere significantly decreased,while the SOD activity was elevated.Preferable therapeutic effectwas achieved in Argatroban combined with Edravone group,compared with those in Argatroban and Edaravone groups(P <0.05,P <0.01).ConclusionBoth Argatroban and Edaravone intraperitoneal administration can effectively alleviate the secondary injuries such as brain edema,apoptosis and free radical damages in ICH ratmodels.Preferable therapeutic effect can be achieved by intraperitoneal combined administration of Argatroban and Edaravone.
Intracerebral hemorrhage;Argatroban;Edaravone;Rat,Wistar
R-332;R743.34
A
2095-140X(2014)04-0001-04
10.3969/j.issn.2095-140X.2014.04.001
辽宁省自然科学基金(2013020204);科技部重大新药创制创新药物研究开放技术平台建设(2012ZX0903016-002);沈阳军区总医院科研课题基金(08Y-Q08)
110840沈阳,沈阳军区总医院神经内科(周中和、杨璐、李巍、李凤鹏、曲方、陈会生),心血管内科(韩雅玲)
陈会生,E-mail:chszh@aliyun.com;韩雅玲,E-mail:hanyaling@263.net
2013-11-18 修回时间:2013-12-20)
·论著·

