鲜切紫薯中酵母菌和乳酸菌货架期模型的构建
夏天龙,姜 梅,王宏勋*,赵国娇
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
鲜切紫薯中酵母菌和乳酸菌货架期模型的构建
夏天龙,姜 梅,王宏勋*,赵国娇
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
用Gompertz模型对不同温度条件下真空包装鲜切紫薯中酵母菌和乳酸菌的生长曲线进行一级模型拟合,并通过计算准确因子(Af)和偏差因子(Bf)验证的生长模型的准确性;利用平方根模型和Arrhenius模型构建酵母菌和乳酸菌的二级模型,比较两种模型的优劣性;依据真空紫薯感官评价判定紫薯的腐败限控量,对其货架期预测模型进行构建和验证。结果表明,Gompertz模型能较好地拟合不同温度条件下2 种菌的生长情况(R2在0.9左右),数学检验参数Af、Bf接近1.0,均在接受范围;通过不同二级模型动力学参数的比较,2 种菌均为用平方根模型拟合二级模型较优;紫薯选用酵母菌作为指示菌预测货架期较好,其腐败限控量为6.64 (lg(CFU/g)),选定4 ℃条件构建并验证货架期预测模型可靠性,实测值为7.0 d,预测值为7.737 d,预测效果良好。
鲜切紫薯;酵母菌;乳酸菌;预测模型;货架期
鲜切蔬菜指经过精选、整理、清洗、切割、杀菌、包装等处理而制成直接烹饪或直接食用的成品蔬菜[1-2]。具有方便营养、安全卫生、风味纯正、提高蔬菜附加值、降低运输成本、减少城市垃圾等特点,鲜切蔬菜将逐渐成为蔬菜销售的重要形式。
紫薯的薯肉呈紫色至深紫色,故称黑紫薯,日本、德国、美国等种植较多,我国主要分布于东南沿海、长江流域和淮海平原[3]。紫薯是甘薯的一种优良新品种,具有着色、抗氧化和保健等作用[4-5]。鲜切蔬菜经加工、运输及销售到消费者餐桌,任何环节的污染可能影响产品的安全性,在加工中由于细胞组织受损,容易引起微生物的污染[6-7],且微生物的增殖是蔬菜品质下降的主要原因之一[8-12],欧美国家已有“毒黄瓜”[13]、“毒菠菜”[14]等相关报道。对鲜切蔬菜中微生物种类及数量实时监管
是产品质量安全控制的重要保障。由于检测技术不完善耗时长、结果波动大等特点,微生物生长模型预测可用于有效预测产品货架期及控制食品安全[15-19]。对于乳酸菌和酵母菌为紫薯中的主要腐败微生物已有报道[2]。因此,本实验应用微生物生长模型对紫薯中酵母菌和乳酸菌生长模型及货架期模型进行构建,为真空鲜切紫薯品质控制、货架期延长提供理论依据。
1 材料与方法
1.1 材料与试剂
真空包装鲜切紫薯购于武商量贩超市(常青花园店)。
培养基(PDA琼脂、MRS琼脂) 青岛海博有限公司;氯化钠(优级纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
TC-400B真空包装机 上海星贝包装机械有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;MIR-154型低温培养箱 三洋电机公司;DHP-9082型电热恒温培养箱、DHG-9123A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;DNP-9082型电热恒温培养箱 上海精宏试验设备有限公司;LRH-150-S恒温恒湿培养箱 广东省医疗器械厂;SK-1快速混匀器 金坛市科析仪器有限公司;HBM-400系列样品均质器 天津市恒奥科技有限公司;手提式蒸汽不锈钢消毒器(灭菌锅) 上海博讯医疗器械有限公司;CP214(C)型电子天平 奥豪斯仪器(上海)有限公司;全自动菌落分析仪 杭州迅数科技有限公司。
1.3 方法
1.3.1 不同温度条件下的生长曲线
监测0、5、10、15、20、25 ℃贮藏的紫薯中酵母菌和乳酸菌数量变化,方法参照GB 4789.2—2008《食品卫生微生物学检验:菌落总数测定》[20]。
1.3.2 酵母菌和乳酸菌生长预测模型构建
1.3.2.1 一级模型拟合
Gompertz模型[21-22]拟合其生长动态,表明时间与微生物生长的函数关系。Gompertz方程如下:
lgN(t)=N0+C×exp{-exp[-B(t-M)]} (1)
式(1)中:N0为初始菌数(lg(CFU/g));C为随时间无限延长时菌增量的对数值(lg(CFU/g));B为在时间为M时的相对最大比生长速率/d-1;M为达到相对最大生长速率所需要的时间/d。
得到上述参数后,通过公式求出最大比生长速率U、迟滞期LPD值。其中,U=BC/e,e=2.718 2;LPD=M-(1/B)。
1.3.2.2 一级模型验证
生长动力学模型求得的预测值与实验所得的数值代入式(2)和(3)即可求得准确因子(Af)和偏差因子(Bf)。

1.3.2.3 二级模型的构建
运用平方根模型[23]和Arrhenius模型[24]研究温度与微生物生长的影响。平方根模型关系式如下:
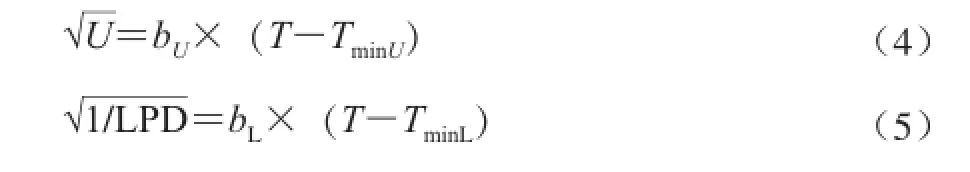
式(4)、(5)中:T是培养温度;TminU、TminL是最低生长温度;b是系数。
Arrhenius模型关系式见公式(6):

对式(6)取对数得:

式(6)、(7)中:k0为频率因子;Ea为活化能;T为绝对温度/K;R为气体常数(8.314 4 J/(mol·K))。
1.3.3 货架期预测模型构建与验证
1.3.3.1 腐败限控量确定
真空包装的鲜切紫薯,感官评价直接决定消费者购买选择。因此,为了精确预测产品货架期,需确定腐败菌的腐败限控量(Ns),即紫薯鲜度遭到感官拒绝时的特定腐败菌数量。
本实验选择5 人评定小组,1、7 ℃贮藏的真空包装紫薯的包装指标、色泽变化、气味指标和组织指标评定紫薯的腐败状况,各指标评判标准见表1。0 分为最好品质,4 分为商品界限,以上为不可接受。测定不同温度达到腐败临界值时优势腐败菌的数量。

表1 鲜切紫薯腐败感官指标Table 1 Criteria for sensory evaluation of fresh-cut purple sweet potato
1.3.3.2 货架期预测模型的建立与验证
比较酵母菌和乳酸菌预测模型及其腐败限控量,选择出合适菌种作为指示菌预测货架期。具体方法为:通过其初始菌数增加到腐败限控量所需要的增殖时间预测鲜切紫薯的货架期,如式(8)所示。式(8)是在式(1)的基础上推导出来,以计算货架期(shelf life,SL)。比较4℃贮藏鲜切紫薯实验得到的货架期与模型预测的货架
期,预测模型实际监控的适应性。
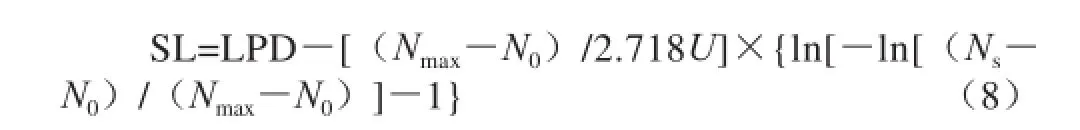
式(8)中:Nmax为增加到稳定期时最大的微生物数量;Ns为达到腐败限控量时的微生物数量。
2 结果与分析
2.1 酵母菌生长预测模型构建
2.1.1 一级生长预测模型构建
采用平板计数法测定0、5、10、15、20、25 ℃不同温度条件下,真空包装紫薯中酵母菌随贮藏时间微生物数量的变化,运用Gompertz模型拟合,构建酵母菌生长一级预测模型。
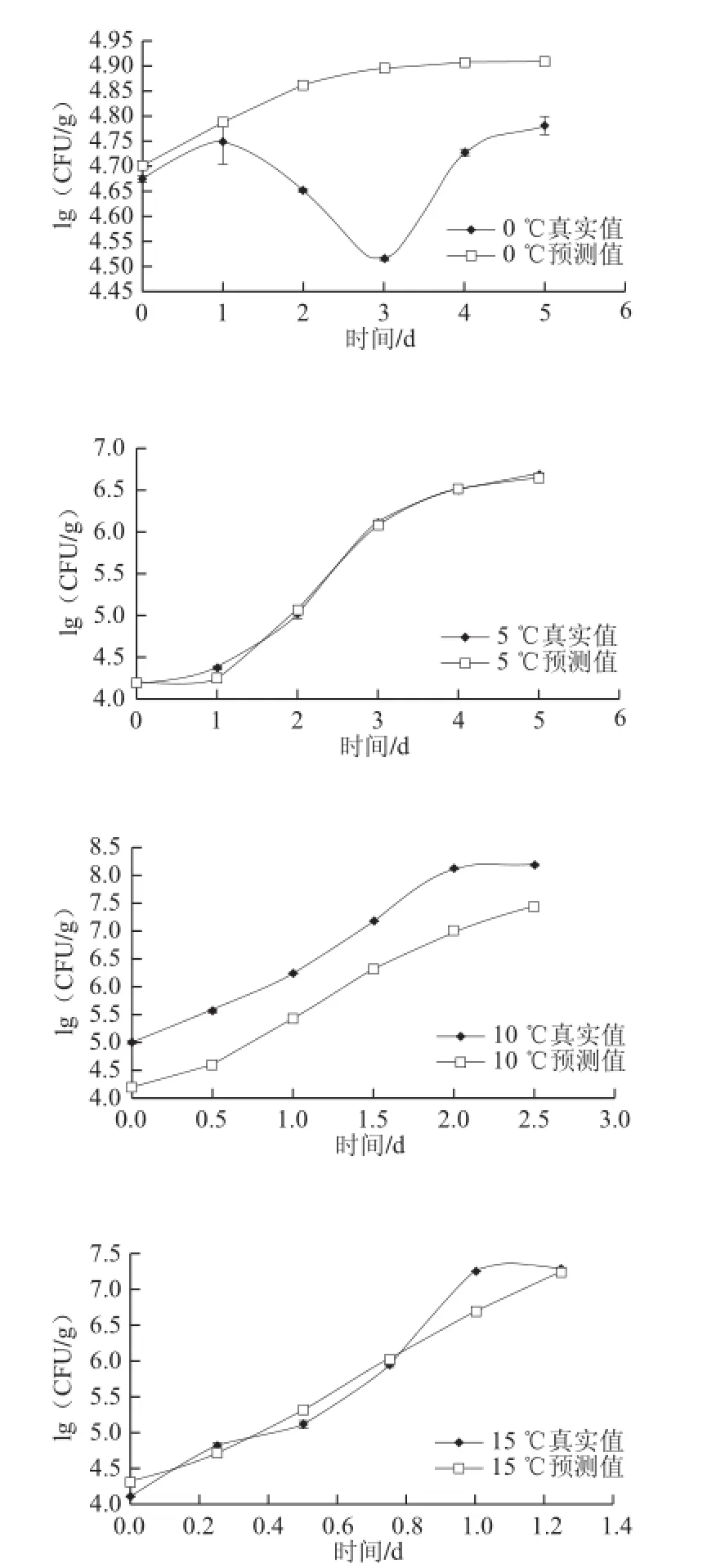
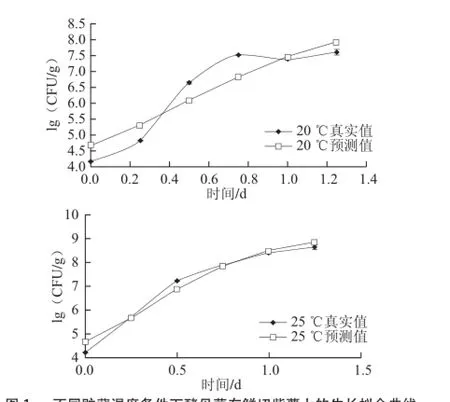
图1 不同贮藏温度条件下酵母菌在鲜切紫薯上的生长拟合曲线Fig.1 Fitted growth curves of yeast in fresh-cut purple sweet potato at different temperatures
由图1可知,0 ℃时微生物生长受到明显抑制,基本处于不生长状态,个别波动可能是初始菌有所差异;5 ℃呈现明显的延滞期,可能是酵母菌对低温有个适应过程,第2天后进入生长期,在第5天处于稳定期;10 ℃贮藏时,平缓进入生长期;15、20 ℃高温条件下,生长速率急剧增加,分别在第1、0.75天酵母菌数量达到7.5(lg(CFU/g));25 ℃时,第0.75天达到8.0(lg(CFU/g)),随着温度升高,稳定期微生物数量越大,表明温度对酵母菌生长有较大影响。
由Gompertz模型方程回归得到酵母菌的生长动力模型及验证,如表2所示。
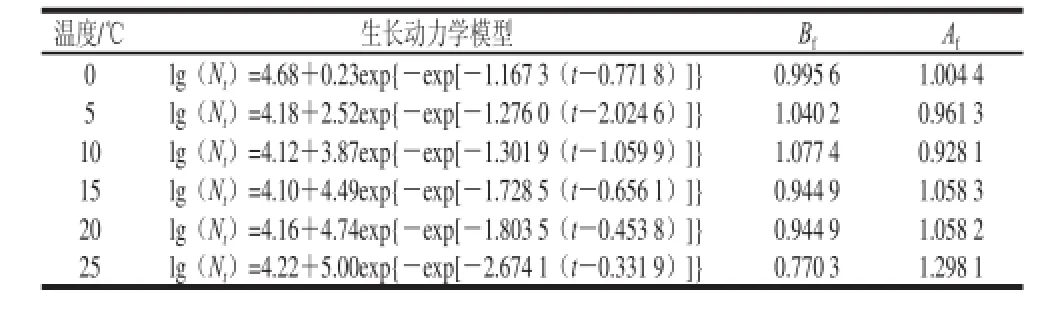
表2 酵母菌在鲜切紫薯上生长预测模型和预测值的偏差因子(Bf)和准确因子(Af)Table 2 Bias and accura growth models in fresh-cut purple sweet potato at different temperatures
由表2可知,运用Gompertz模型拟合得到酵母菌一级模型。随着温度升高最大比生长速率逐渐增加,酵母菌从0.098 8 d-1增加到4.918 9 d-1;延滞期逐渐缩短,酵母菌从2.456 0 d缩短到0.077 6 d,更直观反映温度对酵母菌生长的影响情况。
0、5、10、15、20 ℃ Af值0.928 1~1.058 3,表明实测值与预测值相差不大;Bf值为0.944 9~1.077 4,预测值与实测值的相对标准偏差较小,均在可接受范围内。但25 ℃的Af<0.85,Bf>1.15,说明模型拟合度不太好,可能是温度太高,延滞期太短,间隔的测定时间未能
表现延滞期,Gompertz模型拟合的延滞期不能反映真实情况。
2.1.2 二级生长预测模型的建立与验证
二级模型描述温度与微生物数量间的关系。依据一级模型拟合所得参数,比较平方根模型与Arrhenius模型拟合效果,如表3所示。
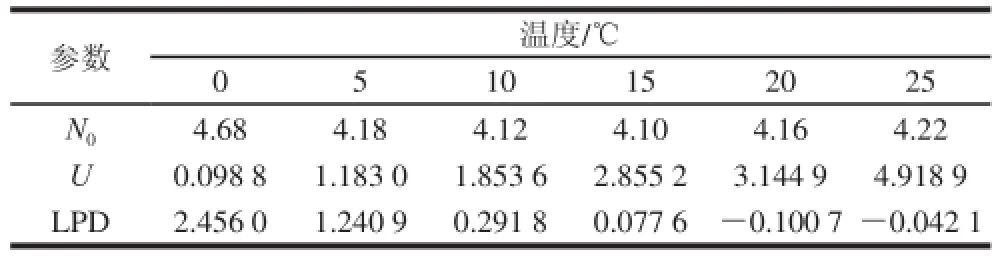
表3 酵母菌生长动力学参数Table 3 Kinetic parameters for yeast
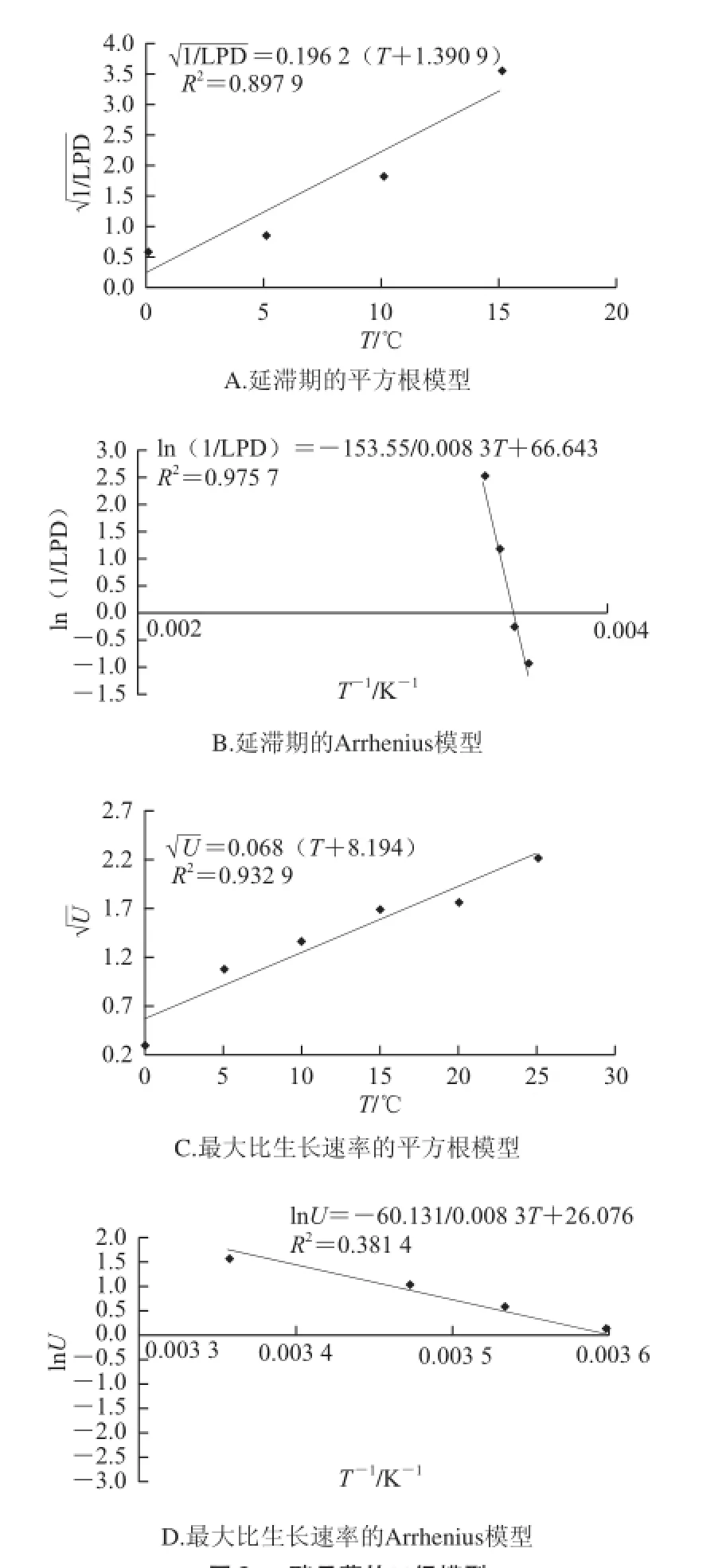
图2 酵母菌的二级模型Fig.2 Secondary models for yeast
由图2可知,平方根模型和Arrhenius模型对延滞期拟合较好,R2均为0.9左右;对于最大比生长速率,平方根模型拟合明显优于Arrhenius模型。酵母菌生长时,温度与U和LPD方程为:
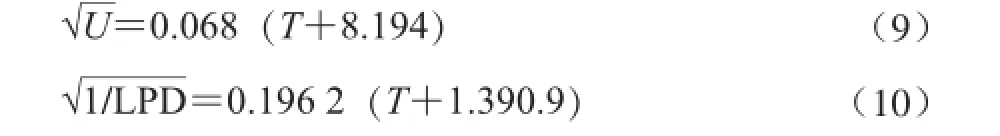
2.2 乳酸菌生长预测模型构建
2.2.1 一级生长预测模型构建
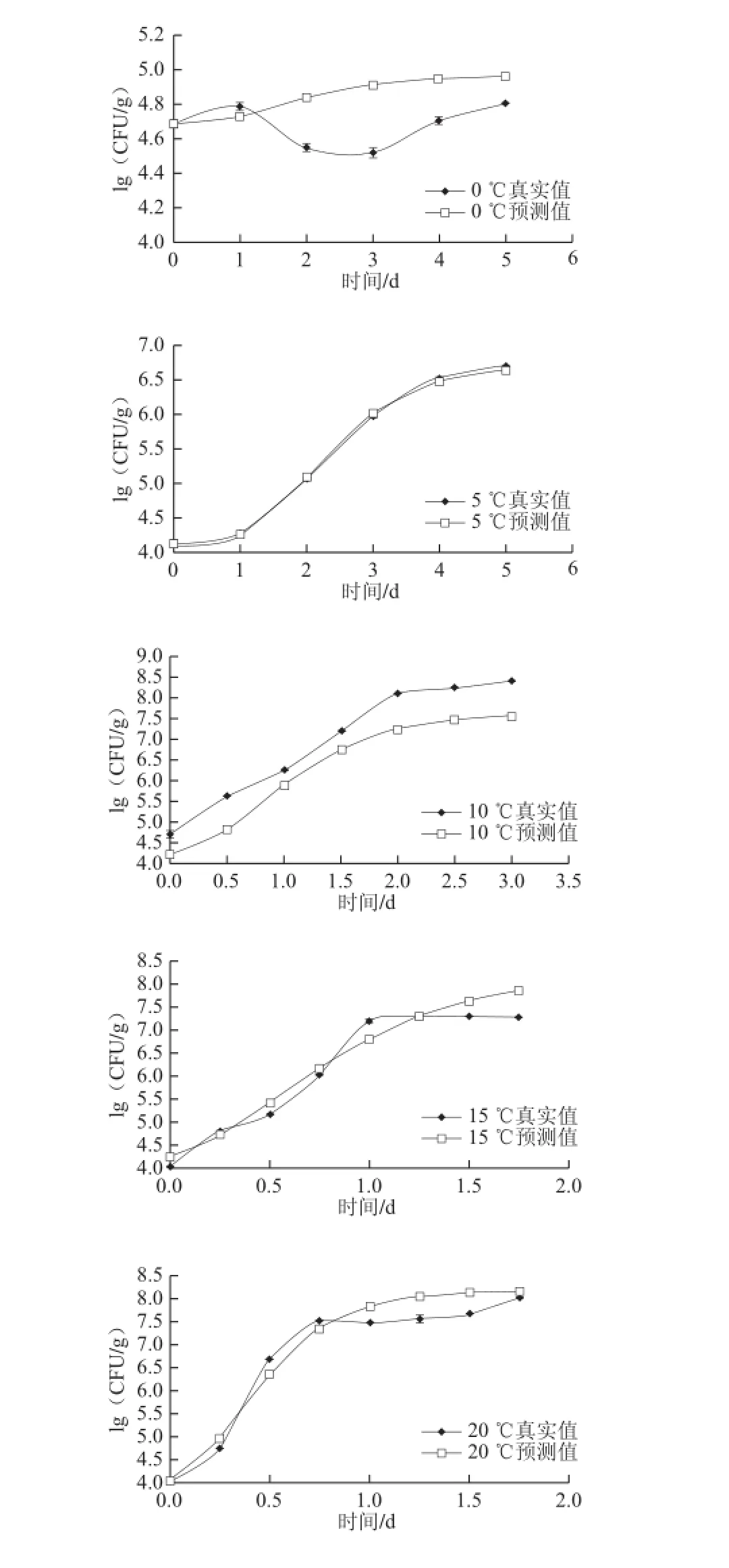
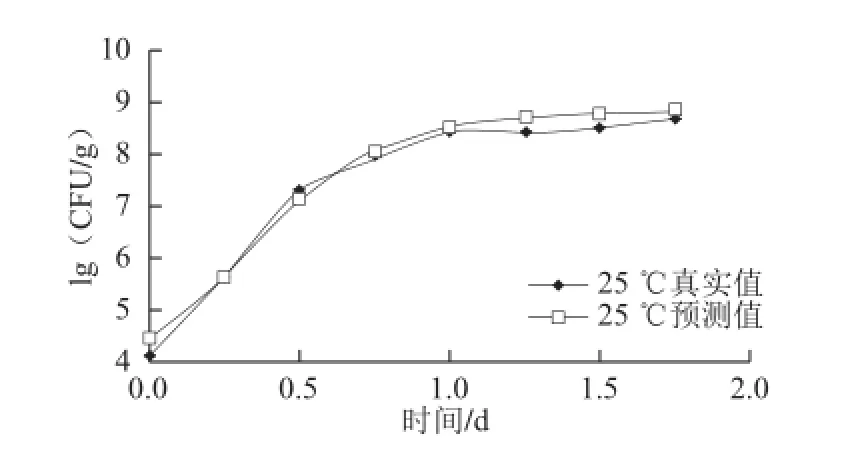
图3 不同贮藏温度条件下乳酸菌在鲜切紫薯上的生长拟合曲线Fig.3 Fitted growth curves of lactic acid bacteria in fresh-cut purple sweet potato at different temperatures
采用平板计数法测定0、5、10、15、20、25 ℃不同温度条件下,真空包装紫薯中随时间延长乳酸菌数量的变化,运用Gompertz模型拟合,建立乳酸菌生长一级预测模型。生长曲线见图3。
由图3可知,0 ℃时乳酸菌在第3天菌落数最低,生长受到明显抑制;5 ℃第1天生长较慢为延滞期,随后进入生长期,呈S型生长,典型的微生物生长趋势图;10 ℃贮藏时,未观察到明显延滞期,第2天达到稳定期;15、20、25 ℃高温条件下,生长速率急剧增加,分别在第1、0.75天和0.5天乳酸菌菌落数达到7.5(lg(CFU/g)),随着温度升高,稳定期微生物数量越大。
由Gompertz模型方程回归得到乳酸菌不同温度条件下生长动力模型及验证,如表4所示。
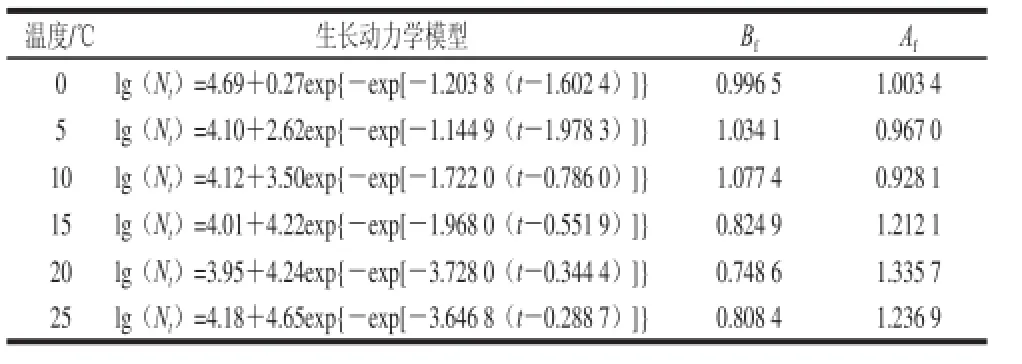
表4 乳酸菌在鲜切紫薯上生长预测模型和预测值Bf和AfTTaabbllee 44 BBiiaass aanndd aaccccuurraaccyy ffaaccttoorrss ooff pprreeddiicctteedd ggrroowwtthh vvaalluueess ooff llaaccttiicc acid bacteria and growth models in fresh-cut purple sweet potato at different temperatures
由表4可知,最大比生长速率逐渐升高,乳酸菌由0.119 6 d-1增加到6.238 5 d-1;延滞期逐渐缩短,乳酸菌从0.771 7 d缩短到0.014 5 d。0、5、10、15 ℃中低温度段Af值范围0.928 1~1.212 1,表明实测值与预测值相差不大;Bf值为0.824 9~1.077 4,预测值与实测值的相对标准偏差较小,均在可接受范围内。20 ℃和25 ℃时准确度Af和偏差度Bf表明模型拟合度不高,可能是高温段此模型的延滞期高于真实值,与测定值不符。
2.2.2 生长二级预测模型的建立与验证
表5为一级模型拟合的参数,比较平方根模型与Arrhenius模型拟合效果,表明温度对延滞期和最大比生长速率的影响。
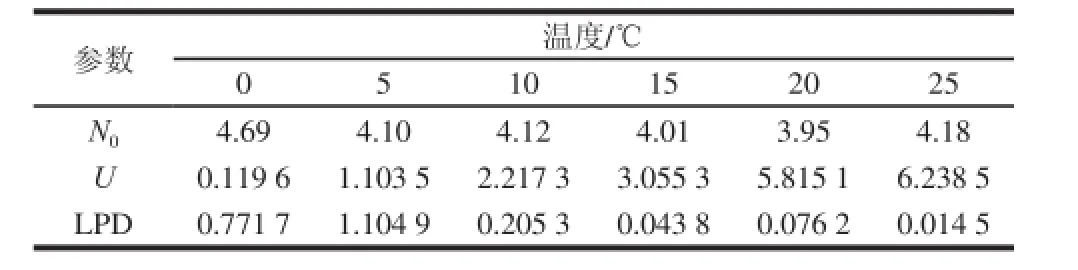
表5 乳酸菌生长动力学参数Table 5 Kinetic parameters for lactic acid bacteria
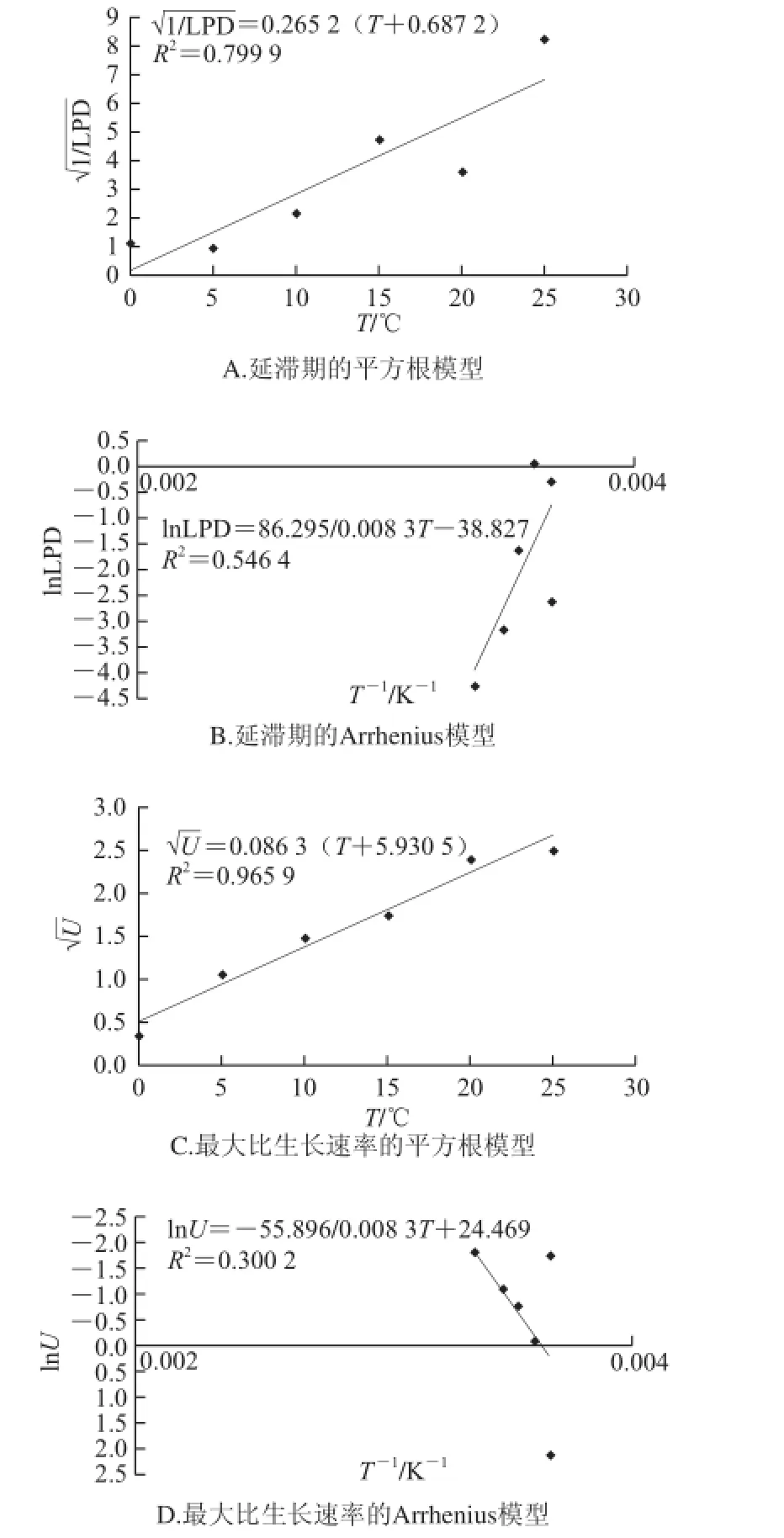
图4 乳酸菌的二级模型Fig.4 Secondary models for lactic acid bacteria
由图4可知,平方根模型对延滞期R2分别为0.8左右,均在可接受范围,平方根模型对最大比生长速率拟合较好R2为0.965 9。表明乳酸菌的二级模型平方根模型更为合适。乳酸菌生长时,温度与U和LPD方程为:
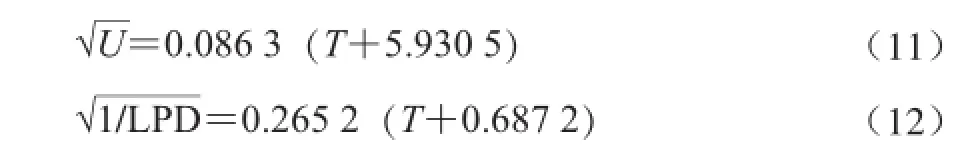
上述预测模型中,一级模型中酵母菌预测模型相
对于乳酸菌,模型准确度更高,偏差度更小;二级模型中酵母菌平方根模型的R2均高于乳酸菌的回归系数。因此,对鲜切紫薯的生长预测模型可选酵母菌为标示菌。
2.3 货架期预测模型建立与验证
2.3.1 腐败限控量确定

表6 1、7 ℃贮藏鲜切紫薯贮藏过程中各指标的变化Table 6 Changes in microbial parameters and sensory evaluation of fresh-cut purple sweet potato stored at 1 and 7 ℃
由表6可知,1、7 ℃贮藏的鲜切紫薯达到商品界限时,酵母菌、乳酸菌的腐败限控量差异不大。故可选定酵母菌预测货架期,腐败限控量为6.64(lg(CFU/g))。
2.3.2 货架期预测模型构建与验证
根据建立的酵母菌生长动力学模型、最大菌数和初始菌数增殖到腐败限控量所用的时间计算0~25 ℃贮藏鲜切紫薯的货架期。根据之前的实验结果,鲜切紫薯中酵母菌的腐败限控量为6.64(lg(CFU/g)),各温度条件下达到稳定期的最大菌数的平均值为8.46(lg(CFU/g))。将测得的初始菌数带入式(13),可计算出0~25 ℃贮藏鲜切紫薯的货架期。
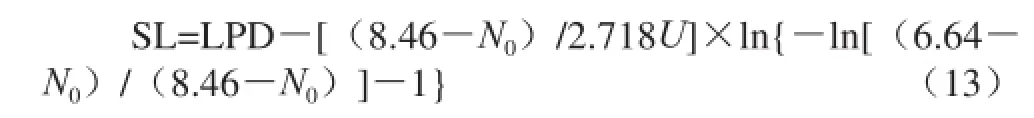
计算得4 ℃贮藏鲜切紫薯的货架期为7.737 d。如表7所示,实测值为7.0 d,酵母菌菌落数达到6.20(lg(CFU/g))。表明预测模型能够快速可靠地预测0~25 ℃贮藏鲜切紫薯的货架期。
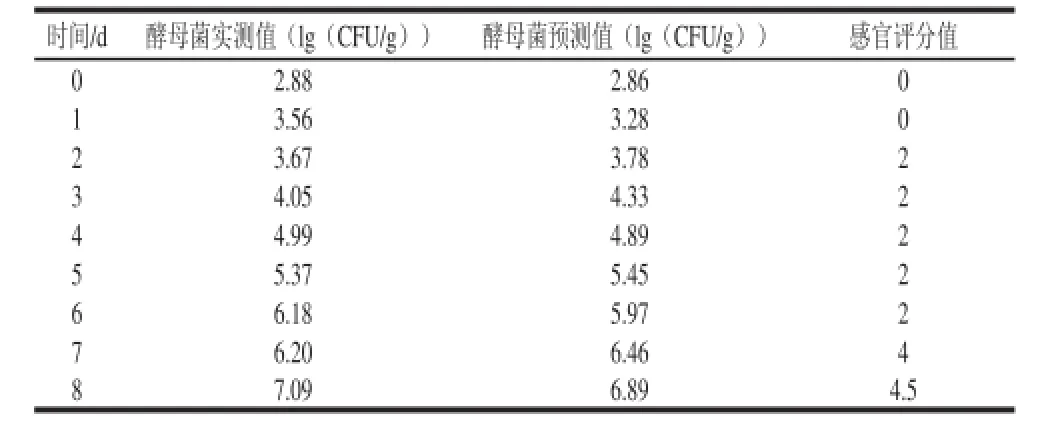
表7 4 ℃贮藏鲜切紫薯贮藏过程中各指标的变化Table 7 Changes in microbial parameters and sensory evaluation of fresh-cut purple sweet potato stored at 4 ℃
3 结 论
以自然状态的鲜切紫薯贮藏在不同温度条件下获得实验数据建立数学模型。运用Gompertz模型建立一级生长预测模型,说明一级模型能很好拟合酵母菌和乳酸菌的生长情况。随着温度升高最大比生长速率逐渐增加,酵母菌从0.098 8 d-1增加到4.918 9 d-1,乳酸菌从0.119 6 d-1增加到6.238 5 d-1;延滞期逐渐缩短,酵母菌从2.456 0 d缩短到0.077 6 d,乳酸菌从0.771 7 d缩短到0.014 5 d。其Af、Bf均接近1.0,说明模型准确度高、偏差小。
通过比较不同二级模型对温度与微生物生长情况影响,选择较优的生长预测模型。酵母菌二级模型:平方根模型和Arrhenius模型对延滞期拟合较好,R2均0.9左右;对于最大比生长速率,平方根模型拟合明显优于Arrhenius模型。乳酸菌二级模型:平方根模型线性关系较好,说明此能较好表达温度与微生物生长关系。鉴于此,对真空鲜切紫薯生长预测模型选用酵母菌更为合适。
依据真空紫薯胀袋程度和感官评价判定紫薯的腐败限控量为6.64(lg(CFU/g)),选定4 ℃贮藏真空紫薯验证货架期模型可靠性,实测值为7.0 d,预测值为7.737 d,表明货架期预测模型可真实反映鲜切紫薯品质变化情况。
[1] RICO D, MARTIN-DIANA A B, BARAT J M. Extending and measuring the quality of fresh-cut fruit and vegetables[J]. Trends in Food and Technology, 2007, 18(7): 373-386.
[2] 赵国娇, 王宏勋. 真空包装鲜切紫薯的菌相研究[J]. 食品科学, 2012, 33(13): 156-159.
[3] 唐君, 周志林, 张允刚, 等. 国内外甘薯种质资源研究进展[J]. 山西农业大学, 2009, 29(5): 479-481.
[4] FURUTA S, SUDA L, NISHIBA Y, et al. High tertbuthylperoxyl radical scavenging activities of potato cultirars with purple flesh[J]. Food Science Technol Int Tokyo, 1998, 4: 33-35.
[5] SUDA I, FURUTA S, NISBHIBA Y, et al. Reduction of liver inducted by carbin tetyachtoride in rats administered purple-colored sweet potato juice[J]. Nippon Shokuhin Kagaku Kaishi, 1977, 44: 315-318.
[6] 陈振青, 王尚玉, 王宏勋. 不同真空包装净菜菌相组成及生长趋势比较[J]. 食品工业科技, 2013, 34(4): 341-343.
[7] TOIVONEN P M A, BRUMMELL D A. Biochemical bases of appearance and texture changes in fresh-cut fruit and vegetables[J]. Postharvest Biology and Technology, 2008, 48: 1-14.
[8] LEHTO M, KUISMA R. Hygienic level and surface contamination in freshcut vegetable production plants[J]. Food Control, 2011, 22(3/4): 469-475.
[9] WATADA A F, KO N P, MINOTT D A. Factors affecting quality of fresh-cut horticultural products[J]. Postharvest Biology and Technology, 1996, 5(9): 115-125.
[10] PARISH M E, BEUCHAT L R, SUSLOW T V, et al. Method to reduce/ eliminate pathogens from fresh and fresh-cut produce[J]. Comprehensive Review in Food Science and Food Safety, 2003, 2: 161-173.
[11] MORIA M R, PONCE A, ANSORENA R. Effectiveness of edible coatings combined with mild heat shocks on microbial spoilage and sensory quality of fresh cut broccoli (Brasica oleracea)[M]. Food Science, 2011, 76(6): 367-374.
[12] ROSA M R M, JONATHAN M M, ROBERT S F. Control of pathogenic and spoilage microorganisms in fresh-cut fruits and fruits juice by traditional and alternative natural antimicrobials[J]. Comprehensive Reviews in Food Science and Food Safty, 2009, 8(3): 157-180.
[13] 谭敦民. 致命“毒黄瓜”背后潜藏着更大危机[J]. 科学养生, 2011(8): 4-5.
[14] 王志刚, 黄棋, 陈岳. 美国“毒菠菜”事件始末及其对中国食品安全的启示[J]. 世界农业, 2008(4): 25-28.
[15] JUNEJA V K, MARKS H, THIPPAREDDI H. Predictive model for growth of clostridium perfringens during cooling of cooked uncured beef[J]. Food Microbiology, 2008, 25: 42-55.
[16] GARCIA-GIMENO R M, BARCO E, RINCON F, et al. Response surface model for estimation for Escherichia coli O157:H7 growth under different experimental conditions[J]. Journal of Food Science, 2005, 70(1): 30-36.
[17] WHITING R C, BAGI L. Modeling the lag phase of Listeria monocytogenes[J]. International Journal of Food Microbiology, 2002, 73(2/3): 291-295.
[18] WILSON P D G, BROCKLEHURST T F, ARINO S, et al. Modeling microbial growth in structured foods: towards a unified approach[J]. International Journal of Food Microbiology, 2002, 73: 275-289.
[19] BARANYI J, PIN C, ROSS T. Validating and comparing predictive models[J]. International Journal of Food Microbiology, 1999, 48: 159-166.
[20] 国家质量技术监督局. GB 4789.2—2008 食品卫生微生物学检验:菌落总数测定[S]. 北京: 中国标准出版社, 2008.
[21] ZWIETERING M H, JONGENBURGER I, ROMBOUTS F M, et al. Modeling of the bacterial growth curve[J]. Journal of Application Environment Microbiology, 1990, 56(6): 1875-1881.
[22] BUCHANAN R L, WHITING R C, DAMERT W C. When is simple good enough: a comparison of the Gompertz, Baranyi, and Threephase linear models for fitting bacterial growth curves[J]. Food Microbiology, 1997, 14: 313-326.
[23] 董庆利, 屠康, 李保国, 等. 平方根模型在亚硝酸盐抑菌预测中的探讨研究[J]. 食品工业科技, 2009, 30(7): 161-164.
[24] 佟懿, 谢晶. 鲜带鱼不同贮藏温度的货架期预测模型[J]. 农业工程学报, 2009, 25(6): 301-304.
Shelf Life Establishment of Fresh-Cut Purple Sweet Potatoes by Use of Predictive Microbiological Models for Yeast and Lactic Acid Bacteria
XIA Tian-long, JIANG Mei, WANG Hong-xun*, ZHAO Guo-jiao
(College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Primary models (Gompertz) and secondary models (square root and Arrhenius) were built to describe the growth of yeast and lactic acid bacteria in vacuum-packed fresh-cut purple sweet potatoes at different temperatures. The accuracy of models was verified by accuracy factor (Af) and bias factor (Bf). The advantages of two secondary models were compared. According to sensory evaluation, the spoilage limit for purple sweet potatoes was determined. Then the predictive model for the shelf life of sweet potatoes was built and verified. The results showed that the growth of yeast and lactic acid bacteria could be well described by the Gompertz models, with correlation coefficients R2near 0.9; the mathematical parameters (Afand Bfnear 1.0) were both in acceptable range. For both microbial species, the square root models were better than the Arrhenius models in terms of mathematical parameters. Yeast was a better indicator of the shelf life of purple sweet potatoes than lactic acid bacteria. The spoilage limit of yeast was 6.64 (lg(CFU/g)). A predictive model for the growth of yeast at 4 ℃was established and validated. The measured shelf life of purple sweet potatoes at 4 ℃ was 7.0 d, while that obtained from the mode was 7.737 d. The good agreement indicated that this model is reliable.
fresh-cut purple sweet potato; yeast; lactic acid bacteria; predictive model; shelf life
TS201.3
A
1002-6630(2014)18-0252-06
10.7506/spkx1002-6630-201418048
2013-11-11
武汉轻工大学校级大学生创新创业训练计划项目(CXXL2013020)
夏天龙(1989—),男,硕士,研究方向为食品科学、食品质量与安全控制。E-mail:xiatianlong0714741@163.com
*通信作者:王宏勋(1977—),男,副教授,博士,研究方向为食品质量微生物安全风险评估与微生物食品加工。
E-mail:wanghongxunhust@163.com

