漂洗水中不同质量分数VB1对鲢鱼鱼糜冷藏品质的影响
陈秀华,李 松,李 冉,陈治光,陈 海,何 杰,李美良,李树红*
(四川农业大学食品学院,四川 雅安 625014)
漂洗水中不同质量分数VB1对鲢鱼鱼糜冷藏品质的影响
陈秀华,李 松,李 冉,陈治光,陈 海,何 杰,李美良,李树红*
(四川农业大学食品学院,四川 雅安 625014)
分析用含不同梯度水平(0.01%、0.05%、0.10%和0.20%)VB1的漂洗水处理鲢鱼鱼糜对其冷藏品质的影响。结果表明:漂洗后,除0.20%组外,其他各处理组的鱼糜pH值均在6.5~7.5的近中性范围,白度与不含VB1的对照组鱼糜差异不显著(P>0.05),且具有正常鱼肉气味,无苦味。漂洗后(冷藏0 d),各处理组鱼糜蛋白总巯基(the total sulfhydryl,TSH)和Ca2+-ATPase(CA)活性极显著(P<0.01)高于对照组;表面疏水性(protein surface hydrophobicity,PSH)则显著(0.05>P>0.01)或极显著(P<0.01)低于对照组。4 ℃冷藏期间,TSH和CA活性呈下降趋势,6 d时各处理组均显著(0.05>P>0.01)或极显著(P<0.01)高于对照组;PSH呈上升趋势,6 d时除0.01%组外,其余各处理组均极显著低于对照组(P<0.01)。鱼糜硫代巴比妥酸值冷藏4 d内无显著变化(P>0.05),6 d时显著上升(0.05>P>0.01),但各处理组均极显著低于对照组(P<0.01)。上述结果表明在漂洗和冷藏过程中,VB1可通过其抗氧化作用保护鱼糜蛋白免于氧化,延缓鱼糜冷藏品质下降,且综合各项指标,以含0.10% VB1的漂洗水处理鲢鱼鱼糜为佳。
VB1;鲢鱼鱼糜;漂洗;冷藏;抗氧化
鲢鱼(Hypophthalmichthys molitrix,silver carp)是我国主要的淡水养殖经济鱼种,2012年产量达368.78万 t,位居第二[1],但鲜销价格低廉。鲢鱼高蛋白,肉色洁白,是加工鱼糜及其制品的良好原料。另一方面,我国鱼糜制品2012年产量仅117万 t[1],尚不足水产品加工总量的十分之一。因此开发鲢鱼鱼糜是大量加工、充分利用其资源,提高产品附加值的有效途径,同时也具有广阔的发展空间。
淡水鱼鱼肉蛋白稳定性较差,在低温贮藏过程中易发生蛋白变性。特别在鱼糜加工(如漂洗、精滤等)及贮藏中存在的蛋白质氧化现象,同样会加速鱼糜蛋白变性,进一步地影响鱼糜制品的弹性品质[2-4]。此外,脂质氧化次级产物可引发蛋白氧化[3,5]。因此,如何在鱼糜加工过程及冷藏过程中保护鱼糜蛋白免受氧化,对保持鱼糜的新鲜度,以提供良好的鱼糜制品原料具有重要意义。
VB1又称硫胺素或抗神经炎素。VB1在动物体内清除氧自由基和过氧化氢的抗氧化特性已经被充分阐述[6-7]。而值得注意的是,近年来研究发现VB1在体外同样发挥了显著的抗氧化特性[8-9]。且也有研究表明VB1可防止其他维生素如VC的氧化[10],抗氧化作用不受过渡金属离子的影响[11]。另一方面,据报道具有抗氧化作用的VC和VE,可改善草鱼肉片贮藏品质[12],抑制鱼糜中脂质的氧化[13]。因此推测,VB1也可能通过其体外抗氧化作用保护蛋白质及脂质免受氧化,从而延缓鱼糜在冷藏过程中品质的下降。此外,VB1是人体必需的营养素,其以焦磷酸硫胺素(thiamine pyrophosphate,TPP)形式参与糖、脂肪的代谢[14-15],对维持神经系统的发育及功能具有重要作用[16-17]。VB1达到50 mg/kg高剂量时才会出现其抑制大鼠肝糖原的合成[18],且人大量或过量服用VB1仍可迅速通过尿液排出[19]。因此,在食品加工过程中,除可作为营养强化剂[20]外,VB1还很可能作为一种安全健康的抗氧化添加剂加以应用。为此,本实验就VB1漂洗水处理鲢鱼鱼糜对鱼糜漂洗后的pH值和感官评价及4 ℃冷藏过程中鱼糜蛋白氧化相关品质指标的影响进行了研究,以探索其作为潜在抗氧化剂在鱼糜漂洗和冷藏过程中应用的可行性。
1 材料与方法
1.1 材料与试剂
鲜活鲢鱼购自四川雅安农贸市场,约1.5 kg/尾,冰藏,15 min内运回实验室。
盐酸硫胺(食品级,白色,纯度≥99%,硫胺素90%) 郑州塔伯商贸有限公司。
1.2 仪器与设备
ServaII ST 16R离心机、Varioskan flash全波长荧光酶标仪 美国Thermo公司;TCP2全自动测色色差计 北京奥仪克光电仪器有限公司;V-1100D可见分光光度计 上海美谱达仪器有限公司;DY89-Ⅱ电动玻璃匀浆机 宁波新芝生物科技股份有限公司;HH-601超级恒温水浴锅 江苏金坛恒丰仪器制造有限公司;BCD-216TXN冰箱 山东海尔集团;CPA225D电子天平 德国Sartorius集团。
1.3 方法
1.3.1 鱼糜制备
采肉:健康鲢鱼去皮、去除红肉;采集背部的白肉,绞碎至3~6 mm3并混合均匀。
漂洗:将鱼肉糜平均分成5 组,各组分别加入5 倍体积4 ℃冷却的含不同VB1质量分数(对照组:不含VB1;处理组:分别含质量分数0.01%、0.05%、0.10%、0.20%的VB1)的漂洗水,缓慢搅拌10 min,静置5 min,倾去漂洗水,重复上述操作一次。最后用含有同上VB1的0.15%食盐水漂洗各组鱼糜一次。
以上采肉、漂洗操作均在4 ℃条件下进行。离心脱水:4 ℃、5 000×g离心15 min。将制备好的鱼糜分别用灭菌食品包装袋分装后,于4 ℃条件下冷藏。
1.3.2 鱼糜漂洗前后pH值测定
pH值的测定参考万建荣等[21]方法。取5 g鱼糜加入10 倍体积水匀浆,然后用酸度计测定pH值,重复3 次,取平均值。
1.3.3 鱼糜漂洗后白度测定
将鱼糜堆叠成10 mm×3 mm(直径×厚度)的柱状,用TCP2全自动测色色差机测定鱼糜的亮度(L*)、红度(a*)和黄度(b*)。重复测定5 次。白度(W)采用公式(1)计算[22]:
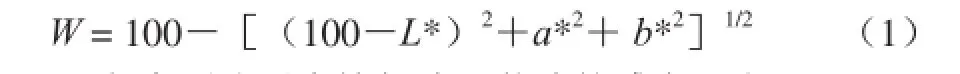
1.3.4 鱼糜漂洗后米糠气味及苦味的感官评定
参考曾少葵等[23]对腥味和苦味的评定方法,制定鱼糜漂洗后米糠气味和苦味的感官评定标准,见表1。组织10 名经培训的感官评价人员,对各组刚漂洗后的5 g生鲜鱼糜的米糠味和苦味进行评定,确定鱼糜米糠气味和苦味的轻重程度。

表1 感官评定标准Table 1 Criteria for sensory evaluation of surimi
1.3.5 鱼糜肌动球蛋白提取
各组分别取鱼糜4 g,参考Benjakul等[24]的方法提取肌动球蛋白。
1.3.6 肌动球蛋白稳定性测定
根据Benjakul等[25]的方法,测定肌动球蛋白总巯基含量(total sulfhydryl content,TSH)、Ca2+-ATPase活性(Ca2+-ATPase activity,CA)、表面疏水性(protein surface hydrophobicity,PSH),各指标均3 次重复。CA活力以在25 ℃时每毫克蛋白质在每分钟内所产生的无机磷的微摩尔数表示(μmol Pi/(mg pro·min))。PSH指数为测得的荧光强度对蛋白质量浓度绘制线性回归曲线的最初的曲线斜率值。TSH含量按公式(2)计算:
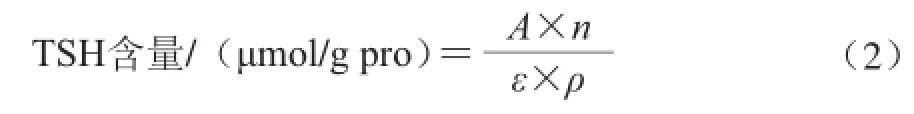
式中:A为412 nm波长处的吸光度;n为稀释倍数;ε为摩尔吸光系数13 600/(L/(mol·cm));ρ为蛋白质质量浓度。
1.3.7 硫代巴比妥酸(thiobarbituric acid,TBA)值测定
采用硫代巴比妥酸法[26]测定鱼糜中脂肪氧化产生丙二醛量,3 次重复。并用公式(3)计算:

式中:A为532 nm波长处与600 nm波长吸光度的差值;m为肉样质量。
1.4 数据处理与统计分析
数据用均值±标准偏差表示,利用SPSS 17.0软件分析数据差异的显著性,P>0.05表示差异不显著,0.05>P>0.01表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同质量分数VB1漂洗水处理鱼糜的pH值
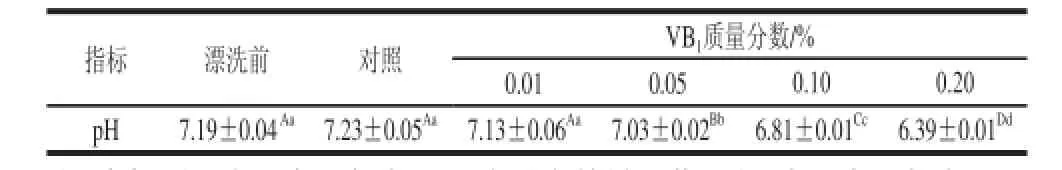
表2 鱼糜漂洗前后的pH值Table 2 The pH values of surimi before and after rinsing
由表2可知,对照 组鱼糜漂洗后的pH值,相对漂洗前有所上升,但差异不显著(P>0.05)。由于VB1为盐酸硫胺,导致除0.01%组外其他处理组鱼糜漂洗后的pH值相对漂洗前均极显著下降(P<0.01)。但除0.20%组外,其他各组鱼糜pH值基本都处于获得最佳鱼糜凝胶形成能的近中性pH值范围(pH 6.5~7.5)。
2.2 不同质量分数VB1漂洗水处理对鱼糜白度、米糠气味及苦味的影响
由图1可知,随着漂洗液中VB1含量的增加,鱼糜白度呈降低趋势,但除0.20%组与对照组差异显著外(0.05> P>0.01),其他各处理组均与对照组差异不显著(P>0.05);此外,盐酸硫胺本身具有微弱的类似米糠的气味和轻微的苦味,因此通过感官评价法分析了VB1漂洗水漂洗鱼糜,对鱼糜气味及滋味的影响。
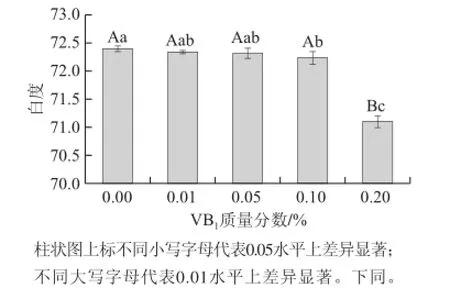
图1 不同质量分数VB1漂洗水对鲢鱼鱼糜白度影响Fig.1 Effect of different concentrations of VB1in rinsing water on the whiteness of silver carp surimi

表3 鱼糜米糠气味和苦味感官评价结果Table 3 The result of sensory evaluation on the unique odor from rice brain and bitterness of surim
由表3可知,除0.20%组有轻微米糠味外,其余处理组均具有正常的鱼肉味;而各处理组滋味与对照组相似,均无苦味。上述结果表明,漂洗水中VB1质量分数在0.10%以内,对鱼糜白度、气味及滋味均无影响,VB1质量分数在0.20%时对气味影响轻微。
2.3 冷藏过程中TSH含量的变化
鱼糜蛋白TSH含量与鱼糜凝胶强度呈显著正相关[3],因此TSH的含量可作为评定鱼糜贮藏品质的重要指标之一。此外许多学者研究发现在蛋白氧化过程中,巯基可氧化形成二硫键,导致巯基含量的下降[2,27-28]。因此巯基含量也可作为衡量蛋白氧化的重要指标之一。

图2 鲢鱼鱼糜在冷藏过程中TSH含量变化Fig.2 Change in TSH in silver carp surimi during refrigeration
将对照组及4 个处理组的样品于4 ℃冷藏,并在0、2、4、6 d时测定TSH含量,由图2可知,漂洗后冷藏0 d时,各处理组鱼糜TSH含量与漂洗水中VB1质量分数呈正比,且均极显著高于对照组(P<0.01)。在冷藏过程中,各组TSH含量呈明显下降趋势,其中对照组下降最快,贮藏结束时与0 d比降低了34.71%。冷藏6 d时,各VB1处理组的TSH含量仍极显著高于对照组(P<0.01),其中0.10%和0.20%组最高,但差异不显著(P>0.05)。尤其6 d时0.05%、0.10%、0.20%三组的TSH依旧明显高于0 d时的对照组。综上可知,VB1漂洗处理鲢鱼鱼糜,在漂洗及冷藏过程中均可延缓鱼糜蛋白中巯基含量的下降。这可能主要是因为VB1具有较强的抗氧化作用,同时能够与超氧阴离子自由基和羟自由基反应[8-9],因此,在漂洗及冷藏过程中可能通过降低蛋白氧化和巯基交连反应,保护鱼糜蛋白TSH。
2.4 冷藏过程中鱼糜的肌球蛋白CA活性变化
ATPase活性区域位于肌球蛋白重链头部。在该区域包含两个活性巯基(SH1和SH2),可影响CA[29]。当蛋白氧化时巯基氧化交联成二硫键,活性区域构象改变,是导致肌球蛋白CA改变的重要原因之一。另一方面,鱼肉蛋白在低温条件下不稳定,易变性,其变性程度可通过测定肌球蛋白CA予以反应[30]。因此肌球蛋白CA变化既能反应鱼糜蛋白的冷藏稳定性,也能反应出蛋白的氧化情况。
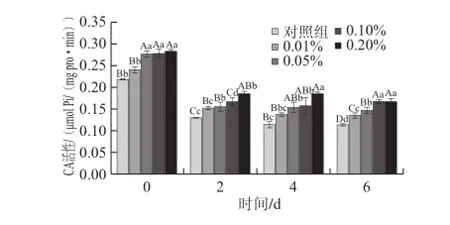
图3 鲢鱼鱼糜在冷藏过程中CA变化Fig.3 Change in CA in silver carp surimi during refrigeration
如图3所示,不同质量分数VB1漂洗后冷藏0 d时,除0.01%组外,对照组CA极显著低于各VB1处理组(P<0.01)。在冷藏期间,各组CA均呈下降趋势,2 d后各组下降均最显著(P<0.01)。这与草鱼[30]和罗非鱼[31]鱼片冷藏过程中的变化趋势基本相似。且相对于0 d,冷藏6 d后对照组CA共降低了48.05%,而各处理组分别下降43.31%、47.20%、40.07%、41.57%,其中0.10%和0.20%组CA仍最高,且二者差异不显著(P>0.05)。上述结果表明,在鱼糜漂洗过程中及冷藏过程中,VB1对保持鱼糜CA起到一定作用,说明其在保护冷藏期间鲢鱼鱼糜肌球蛋白的稳定性及抗氧化性方面可能都发挥了积极作用,这与VB1对冷藏期间鲢鱼鱼糜TSH的作用效果基本一致。
2.5 冷藏过程中鱼糜PSH的变化
PSH可反映蛋白分子的结构和构象变化,可作为评价蛋白变性的一个重要参数。此外,已有学者研究发现,随着蛋白的不断氧化,使得蛋白天然构象内部的疏水性氨基酸残基暴露,从而其PSH不断增加[3,32]。鲢鱼鱼糜冷藏过程中对照组及处理组PSH变化如图4所示,漂洗后冷藏0 d时,除0.01%组外,对照组值几乎均极显著高于其他各处理组,且处理组间PSH随着漂洗水中VB1质量分数的增加而减小,且除0.20%外,差异均不显著(P>0.05)。冷藏期间,各组鱼糜PSH都呈上升趋势,尤其冷藏4~6 d,各组鱼糜PSH都明显增加;冷藏6 d时,相对0 d,对照组和0.01%组的PSH分别增加了92.03、90.88 μmol/g,上升最快,而后3 个处理组则仍极显著低于前两组(P<0.01),其中0.20%组显著低于0.05%及0.10%组(0.01<P<0.05)。说明漂洗水中添加0.05%、0.10%和0.20%的VB1对鲢鱼鱼糜漂洗及冷藏6 d期间蛋白PSH的增加起到一定的延缓和抑制作用,且0.20%的效果较显著。这可能是因为VB1的抗氧化作用,能够抑制蛋白氧化,防止蛋白内部疏水性氨基酸残基暴露,从而延缓冷藏期间鱼糜PSH的增加。

图4 鲢鱼鱼糜在冷藏过程中PSH变化Fig.4 Change in PSH in silver carp surimi during refrigeration
2.6 冷藏过程中鱼糜的TBA值的变化
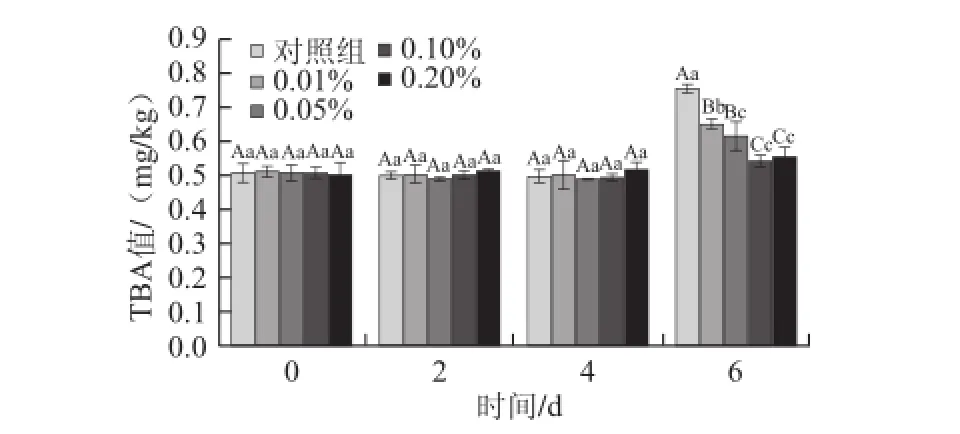
图5 鲢鱼鱼糜在冷藏过程中TBA值变化Fig.5 Change in TBA value in silver carp surimi during refrigeration
由图5可知,对照组及4 个处理组在0~4 d冷藏期内鱼糜TBA值无显著变化。而冷藏6 d时TBA值明显上升。对照组上升幅度最大,相对0 d时达到48.8%,极显著高于各处理组(P<0.01)。0.10%和0.20%两组TBA值差异不显著(P>0.05),但分别极显著(P<0.01)和显著
(0.05>P>0.01)低于0.01%组和0.05%组。特别是6 d的0.10%组和0.20%组的TBA值仅比0 d时的对照组高出8.6%左右。由于,TBA值反应了脂肪二级氧化产物即最终生成物的量,随着氧化程度的加深,次级产物不断增多,TBA值不断增大[33]。因此,VB1漂洗处理鲢鱼鱼糜对其冷藏过程中脂肪的氧化具有一定的抑制作用,且相对而言,0.10%和0.20%质量分数的VB1漂洗水处理后的抑制效果较好。
鱼糜蛋白中肌动球蛋白是形成鱼糜凝胶网状结构的重要蛋白,其凝胶化反应,主要是肌球蛋白通过二级结构α-螺旋解螺旋成无规则卷曲结构或β-螺旋,并通过二硫键等化学键架桥和疏水作用力使各蛋白分子之间发生交联,形成凝胶的三维网状结构[34]。脂肪氧化次级产物可引发肌原纤维蛋白或肌球蛋白的氧化,进而导致结构和功能改变[7,35],亦可能影响鱼糜蛋白的凝胶化反应。漂洗后少量残存的脂质在低温贮藏期间仍会缓慢发生氧化。因此抑制脂肪氧化,保护鱼糜蛋白,仍具有重要意义。脂肪的氧化过程是典型的自由基反应历程[36]。研究表明,VB1可直接作用于自由基,通过自身被氧化而产生抗氧化作用[15]。同样缺乏VB1的机体内,会出现脂质过氧化现象[8,37]。本实验中,VB1漂洗水处理鱼糜后,冷藏6 d内鱼糜TBA值得到显著抑制,同时结合TSH和CA和PSH的结果,推测,在鱼糜冷藏过程中,VB1也可能通过与脂质氧化产生的自由基反应,起到阻止自由基破坏鱼糜蛋白结构的作用。
3 结 论
本实验结果表明,漂洗水中添加0.01%~0.20%的VB1可不同程度保护鲢鱼鱼糜在漂洗和冷藏过程中的蛋白和脂肪氧化,对鱼糜蛋白TSH含量和CA活性的下降、脂质氧化指标TBA值的上升起到明显的抑制作用,其中以0.10%和0.20%质量分数的漂洗水效果最为显著。结合漂洗后鱼糜pH值、白度、米糠气味及苦味,以0.10%质量分数的VB1漂洗水处理漂洗鲢鱼鱼糜更为适宜。此外,VB1在发挥抗氧化作用的同时还具有其他优点,如,人体自身不能合成的必需维生素;安全性高,摄入的多余部分可随尿液排除;可同时防止其他维生素如VC的氧化,且抗氧化作用不受过渡金属离子的影响;热降解可产生芳香物质。因此,VB1作为潜在的抗氧化剂在鱼糜加工及贮藏中具有广阔的应用前景。
[1] 农业部渔业局. 2013年中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2013: 1-145.
[2] 李艳青, 孔保华, 夏秀芳, 等. 羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J]. 食品科学, 2012, 33(9): 31-35.
[3] MLYUKA E. 冷冻储藏与氧化对鲢鱼肌原纤维蛋白功能性质的影响[D]. 无锡: 江南大学, 2010.
[4] 刘泽龙. 蛋白质氧化对肉及肉制品持水与水合特性的影响机理研究[D]. 无锡: 江南大学, 2012.
[5] LI S J, KING A J. Structural changes of rabbit myosin subfragment 1 altered by malonaldehyde, a byproduct of lipid oxidation[J]. Journal of Agricultural and Food Chemmistry, 1999, 47(8): 3124-3129.
[6] SHARMA A, BIST R, BUBBER P. Thiamine deficiency induces oxidative stress in brain mitochondria of Mus musculus[J]. Journal of Physiology and Biochemisty, 2013, 69(3): 539-546.
[7] LANGLAIS P J, ANDERSON G, GU S X, et al. Increased cerebral free radical production during thiamine def i ciency[J]. Metabolic Brain Disease, 1997, 12(2): 137-143.
[8] LUKIENKO P I, MEL’NICHENKO N G, ZVERINSKII I V, et al. Antioxidant properties of thiamine[J]. Bulletin of Experimental Biology and Medicine, 2000, 130(9): 874-876.
[9] SHAPOVAL G S, BABII L V, KRUGLYAK O S, et al. Antioxidant activity of thiamine and its structural analogs in reactions with electrochemically generated hydroxyl radicals and hydrogen peroxide[J]. Theoretical and Experimental Chemistry, 2011, 47(1): 55-60.
[10] GERO E. Inhibitory action of vitamin B1on the oxidation of L-ascorbic acid. Ⅱ. Influence of pH and of the vitamin B1concentration; role of the various moieties of the vitamin B1molecule[J]. Bulletin de la Societe de Chimie Biologique (Paris), 1954, 36(9): 1335-1342.
[11] 万素英, 赵亚军, 李琳, 等. 食品抗氧化剂[M]. 北京: 中国轻工业出版社, 1998: 8-9.
[12] 杜欣, 熊善柏, 程薇, 等. 维生素C·E对草鱼片贮藏品质的影响[J].安徽农业科学, 2010, 38(34): 19548-19563.
[13] 何碧烟. 冷藏温度及抗氧化剂对鲢鱼糜脂质氧化的影响研究[J]. 集美大学学报, 2000, 5(3): 64-68.
[14] 陈宏. B族维生素影响皱纹盘鲍(Haliotis discus hannai Ino)主要营养物质代谢机理的研究[D]. 青岛: 中国海洋大学, 2004.
[15] 简林凡. 维生素B1缺乏与防治[J]. 井冈山医专学报, 2004, 11(3): 68-70.
[16] MARTIN P R, SINGLETON C K, HILLER-STURMHÖFEL S. The role of thiamine deficiency in alcoholic brain disease[J]. Alcohol Research & Health: the Journal of the National Institute on Alcohol Abuse and Alcoholism, 2003, 27(2): 134-142.
[17] ZHAO Na, ZHONG Chunjiu, WANG Yang, et al. Impaired hippocampal neurogenesis is involved in cognitive dysfunction induced by thiamine deficiency at early pre-pathological lesion stage[J]. Neurobiology of Disease, 2008, 29(2): 176-185.
[18] 李玉成. 维生素B1与胰岛素抵抗、糖耐量关系的研究[D]. 延吉: 延边大学, 2011.
[19] 孙路路, 张石革. 维生素B1(硫胺)缺乏症(脚气病)与补充维生素B1[J]. 中国药房, 2003, 14(6): 383-384.
[20] GB 14880—2012 食品营养强化剂使用标准[S].
[21] 万建荣, 洪玉清, 奚印慈, 等. 水产食品化学分析手册[M]. 上海: 上海科学技术出版社, 1993: 69-75.
[22] 林琳, 陆剑锋, 翁世兵, 等. 漂洗工艺对鲢鱼鱼糜凝胶强度和色泽的影响[J]. 食品研究与开发, 2012, 33(2): 8-12.
[23] 曾少葵, 杨萍, 陈秀红. 微生物发酵对罗非鱼下脚料蛋白酶解液脱腥去苦效果比较[J]. 南方水产, 2009, 5(4): 58-63.
[24] BENJAKUL S, THOMAS A, SEYMOUR, et al. Physicochemical changes in pacif i c whiting muscle proteins during iced cold storage[J]. Food Science, 1997, 62(4): 728-733.
[25] BENJAKUL S, WONNOP V, THONGKAEW C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International, 2003, 36: 787-795.
[26] 陈慧斌, 王梅英, 王则金, 等. 牡蛎冻藏期间脂肪氧化影响因素研究[J].西南大学学报, 2008, 30(8): 96-102.
[27] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere inf l uences protein oxidation and tenderness of porcine longissimus dorsi during chill storage[J]. Meat Science, 2007, 77(3): 295-303.
[28] ZAKRYS-WALIWANDERA P I, O’SULLIVANA M G, O’NEILLB E E, et al. The effects of high oxygen modif i ed atmosphere packaging on protein oxidation of bovine M. longissimus dorsi muscle during chilled storage[J]. Food Chemistry, 2012, 131(2): 527-532.
[29] WELLS J A, WERBER M M, YOUNT R G. Inactivation of myosin subfragment one by cobalt(Ⅱ)/cobalt(Ⅲ) phenanthroline complexes. 2. cobalt chelation of two critical SH groups[J]. Biochemistry, 1979, 18: 4800-4805.
[30] 林琳, 高艳艳, 吕顺, 等. 草鱼低温贮藏过程中的品质变化特性[J].食品科学, 2009, 30(24): 433-435.
[31] 李莎, 李来好, 杨贤庆, 等. 罗非鱼片在冷藏过程中的品质变化研究[J].食品科学, 2010, 31(20): 444-447.
[32] SUN Weizheng, ZHOU Feibai, SUN Dawen. Effect of oxidation on the emulsifying properties of myofibrillar proteins[J]. Food and Bioprocess Technology, 2012, 6(7): 1703-1712.
[33] YANAR Y, FENERCIOGLU H. The utilization of carp (Cyprinus caipio) fl esh as fi sh ball.Turltish[J]. Journal of Veterinary and Animal Science, 1998: 23: 361-365.
[34] 李杰, 汪之和, 施文正. 鱼糜凝胶形成过程中物理化学变化[J]. 食品科学, 2010, 31(17): 103-106.
[35] 章银良, 安巧云, 杨慧. 脂肪氧化对蛋白质结构的影响[J]. 食品科学, 2012, 33(1): 25-30.
[36] 张映, 刘桂林. 食品生物化学[M]. 太原: 山西高校联合出版社, 1995: 61-70.
[37] SHANGARI N, MEHTA R, O'BRIEN P J. Hepatocyte susceptibility to glyoxal is dependent on cell thiamin content[J]. Chemico-Biological Interactions, 2007, 165(2): 146-154.
Effect of Different Concentrations of Vitamin B1in Rinsing Water on the Quality of Silver Carp Surimi during Refrigeration
CHEN Xiu-hua, LI Song, LI Ran, CHEN Zhi-guang, CHEN Hai, HE Jie, LI Mei-liang, LI Shu-hong*
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
This study analyzed the effect of rinsing water with different concentrations (0.01%, 0.05%, 0.10%, and 0.20%) of VB1on the quality of silver carp surimi during refrigeration at 4 ℃. The results showed that after being rinsed, the pH values of surimi in all the other treatments except the 0.20% VB1group were between 6.5 and 7.5, the whiteness was significantly similar to that of the control group without VB1(P > 0.05), and all the three treatments had the nature odor of fish without bitterness. At the same time, the total sulfhydryl (TSH) content and Ca2+-ATPase (CA) activity of surimi protein in each treatment group were very significantly (P < 0.01) higher than those of the control group at 4 ℃ on day 0, and protein surface hydrophobicity (PSH) was significantly (0.05 > P > 0.01) or highly significantly (P < 0.01) lower than that of the control group. During refrigerated storage, TSH content and CA activity decreased gradually, and their levels in the treatment groups were significantly (0.05 > P > 0.01) or highly significantly (P < 0.01) higher than those observed for the control group on day 6. Additionally, PSH displayed an increasing tendency, and on day 6, the PSH values of the other treatment groups except the 0.01% VB1group were significantly lower than that of the control group (0.05 > P >0.01). Thiobarbituric acid (TBA) values in all groups were not significantly changed from day 0 to 4 during refrigeration (P > 0.05), but was increased significantly on day 6 (0.05 > P > 0.01), reaching a significantly higher level in the control group compared with the treatment groups (P < 0.01). These results suggested that VB1might protect surimi protein from being oxidized during rinsing and refrigeration and slow down the quality deterioration. Meantime, it was concluded that the ringing water containing 0.10% VB1is appropriate for washing silver carp suimi.
vitamin B1; silver carp surimi; rinsing; refrigeration; antioxidant
TS254.4
A
1002-6630(2014)18-0236-05
10.7506/spkx1002-6630-201418045
2013-11-08
四川省教育厅自然科学重点基金项目(10ZA052)
陈秀华(1988—),女,硕士研究生,研究方向为水产品加工理论与技术。E-mail:xinyulss@sina.com
*通信作者:李树红(1975—),女,副教授,博士,研究方向为水产品加工理论与技术。E-mail:xiaoshu928@126.com

