油橄榄酒的酿造及香气成分分析
马腾臻,李 颍,张 莉,张彦芳,盛文军,祝 霞,韩舜愈*
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070)
油橄榄酒的酿造及香气成分分析
马腾臻,李 颍,张 莉,张彦芳,盛文军,祝 霞,韩舜愈*
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070)
以制取橄榄油后的果汁为原料,通过调配、发酵等工艺制得油橄榄酒,进行理化指标及感官评价分析,并采用顶空固相微萃取结合气相色谱-质谱技术检测其香气成分,以期为油橄榄 的综合开发利用,进一步提高其附加值提供理论依据。结果表明:产品酒精体积分数(6.42%)、总糖含量(7.84 g/L)、挥发酸含量(1.04 g/L)、总二氧化硫含量(103.05 mg/L)及干浸出物含量(27.66 g/L)等理化指标与感官评价结果均符合GB 15037—2006《葡萄酒、果酒通用分析方法》规定;油橄榄酒中共鉴定出69 种香气成分,总含量约23.44 mg/L,包括12 种醇类、25 种酯类、6 种有机酸、8 种羰基类(醛和酮)、14 种萜烯类和4 种酚类,通过香气成分的气味活性值初步确定主要香气成分有香叶醇、苯甲酸乙酯、辛酸乙酯和愈创木酚。
油橄榄酒;香气成分;顶空固相微萃取;气相色谱-质谱法
油橄榄又称洋橄榄、齐敦果,是世界著名的油用和餐用果树,原产于地中海沿岸国家,目前已有4 000多年栽培历史。我国从1956年开始陆续引种油橄榄,现种植面积约3万公顷,主要集中在甘肃、四川等地,其中甘肃陇南地区被认为是中国最适合种植油橄榄的地区[1-2]。
油橄榄果实主要用于榨取橄榄油,榨油后产生的果渣及果汁中含有糖、脂肪酸、三萜、多酚、黄酮等诸多有效成分[3],处理不当既导致环境污染又造成资源浪费。长期以来,国内外学者研究了物理、化学、生物及多种方法相结合的废料处理工艺,其中成本低、污染小的生物法应用前景最广[4],如Luis等[5]研究了黑曲霉在废弃果汁中发酵生产脂肪酶的工艺;国内研究目前主要集中在果渣有效成分的提取上[2-3],果汁多作为废水排放,相关研究较少。
本实验以甘肃陇南地区经压榨制取橄榄油后的果汁为原料,通过调配及酒精发酵等工艺制得油橄榄果酒,并进行了理化指标、感官评价及香气成分分析,旨在为油橄榄果实的高效利用,进一步提高其附加值提供理论依据,促进我国油橄榄产业的发展。
1 材料与方法
1.1 材料与试剂
油橄榄果汁 陇南天然居油橄榄科技开发有限公司;正辛醇、芦丁(均为色谱纯) 美国Sigma公司;磷钼钨酸显色剂 北京华科盛精细化工产品贸易有限公司;无水乙醇、氯化钠、偏重亚硫酸钾、一水合没食子酸、盐酸、氢氧化钠、硫酸、无水葡萄糖等试剂均为国产分析纯;费林溶液、次甲基蓝指示液、酚酞指示液、碘标准滴定液、淀粉指示液等按照GB/T 603—2002《化学试剂:试验方法中所用制剂及制品的制备》配制。
1.2 仪器与设备
CP214电子天平 上海奥豪斯仪器有限公司;HH-S型恒温水浴锅 金坛市恒丰仪器制造有限公司;Genesis 10s紫外-可见分光光度计、265079气相色谱-质谱联用仪、TG-WAX色谱柱 美国Thermo Scientific公司;顶空固相微萃取装置、DVB/Carboxen/PDMS(50/30 μm)萃取器 美国Surpelco公司;GZX-GF101-Ⅱ电热恒温鼓风干燥箱 上海跃进医疗器械有限公司;18100摩尔超纯水机 重庆摩尔水处理设备有限公司;MSC-400磁力加热搅拌器 德国Wiggen Hauser公司;手持数显糖度计日本Atago公司;WKM-2-3三联微孔膜过滤器 烟台一州科美机械科技有限公司。
1.3 方法
1.3.1 油橄榄酒的生产工艺
油橄榄压榨汁→离心分离→果汁→糖酸调配→发酵→分离→澄清→膜过滤→装瓶 ↓ ↑ ↑
橄榄油 SO2酵母活化
操作要点:1)调配:果汁含糖量为75.7 g/L,按照17 g/L糖→体积分数1%酒精加白砂糖进行调配[6],使初始糖度为160 g/L,添加SO2抑制杂菌(120 mg/L偏重亚硫酸钾),并用柠檬酸调整果汁pH值至4~4.5;2)酵母活化:取适量果汁水浴加热至35 ℃后按推荐用量接入酵母,活化30 min,待果汁冷却至室温后加入发酵罐中;3)发酵:22 ℃发酵,每天测定发酵液温度及糖含量(手持数显糖度计测定),主发酵期结束后(糖度不再明显降低)按40 mg/L添加偏重亚硫酸钾终止发酵;4)分离澄清:在10~15 ℃的酒窖中贮存,通过定期倒罐去除酒泥,并用40 mg/L明胶对果酒进行澄清处理;5)过滤装瓶:按40 mg/L添加偏重亚硫酸钾,膜过滤机(滤膜孔径分别为1、0.45 μm和0.22 μm)过滤后装瓶贮存。
1.3.2 理化指标测定
1.3.2.1 常规指标
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定酒精体积分数(密度瓶法)、干浸出物含量、总糖含量、总酸含量(指示剂法)、挥发酸含量、总二氧化硫含量(直接碘量法)等指标。
1.3.2.2 色度、色调
油橄榄酒于0.45 μm孔径的滤纸过滤后测定pH值,用相同pH值的柠檬酸-磷酸氢二钠缓冲液以1∶10(V/V)稀释酒样。取稀释后的酒样于1 cm比色杯中,在分光光度计波长420、520 nm和620 nm条件下分别测定其吸光度[7]。三者吸光度之和即为该酒样色度值,前两者比值为色调值。
1.3.2.3 总酚含量的测定
福林酚比色法[7]:吸取2.0 mL酒样,用水稀释至100 mL,然后吸取1.0 mL样品溶液分别加入水5.0 mL、福林酚显色剂1 mL和质量分数7.5%碳酸钠溶液3 mL,显色。放置2 h后在765 nm波长条件下测定样品的吸光度,根据标准曲线(方程)计算出样品中总酚的含量。
1.3.2.4 单宁含量的测定
参照NY/T 1600—2008《水果、蔬菜及其制品中单宁含量的测定:分光光度法》测定。
1.3.2.5 总黄酮含量的测定
AlCl3显色法[8]:吸取2 mL酒样用体积分数30%乙醇溶液稀释至10 mL,取1 mL稀释后的酒样,加4 mL 体积分数30%乙醇溶液,摇匀,再加4 mL质量分数1% AlCl3溶液,最后用体积分数30%乙醇溶液稀释至10 mL,摇匀放置10 min后在415 nm波长条件下测定样品吸光度,根据标准曲线(方程)计算出样品中总黄酮的含量。
1.3.3 感官分析
在标准葡萄酒品尝实验室中,由5 位专家组成的感官分析品尝小组参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》对该产品进行感官分析。
1.3.4 香气物质分析[9]
1.3.4.1 香气成分的富集
在装有磁力搅拌器的顶空瓶中加入5 mL油橄榄酒、1.5 g NaCl、50 μL 1-辛醇乙醇溶液(使其在最终酒样中的质量浓度为8.3 mg/L),在45 ℃条件下恒温搅拌30 min后,用活化好的固相微萃取器吸附30 min,气相色谱进样口解吸温度250 ℃,解吸时间10 min,进行分析。
1.3.4.2 气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)条件
色谱柱:Thermo TG-WAX(60 m×0.25 mm,0.5 μm);升温程序:50 ℃保持5 min,以5 ℃/min升至230 ℃,保持10 min;不分流进样;电子电离(electron ionization,EI)源;电子能量70 eV;传输线温度230 ℃;离子源温度250 ℃;质量扫描范围m/z 50~450。
1.4 数据处理
定性:由GC-MS分析得到的质谱数据经计算机在NIST、Wiley及香精香料标准谱库的检索比对进行定性,比对时要求匹配度大于800(最大值为1 000);定量:采用内标法进行半定量分析,内标选用1-辛醇。

2 结果与分析
2.1 标准曲线图
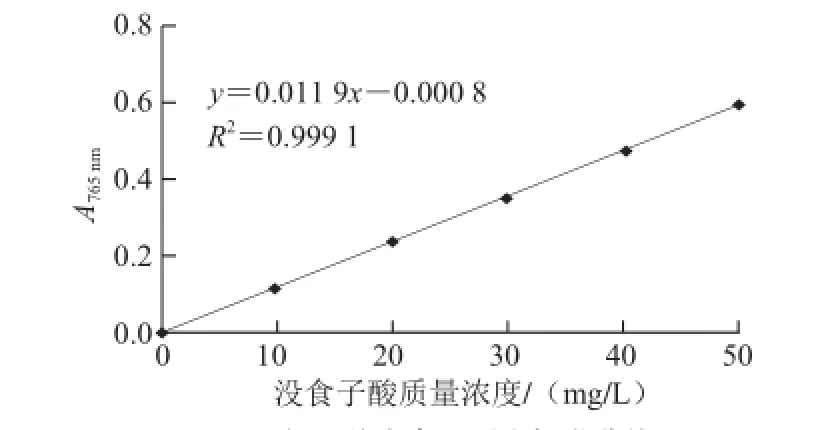
图1 总酚/单宁含量测定标准曲线Fig.1 Calibration curve for total phenols or tannin assay
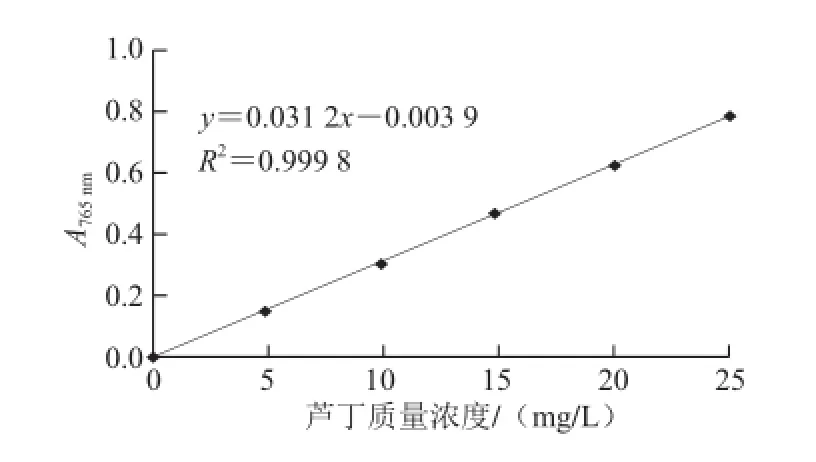
图2 总黄酮含量测定标准曲线Fig.2 Calibration curve for total flavonoids assay
2.2 理化指标测定结果与分析

表1 油橄榄酒理化指标测定结果Table 1 Physical and chemical parameters of Olea europaea L. wine
由表1可知,总二氧化硫含量、总糖含量(半干酒)、酒精体积分数、挥发酸含量及干浸出物含量等指标均符合国家标准规定;总酚、单宁含量及色度值与蛇龙珠干红葡萄酒相当[7]。色度值可用于衡量果酒的色泽品质,一般而言,总酚、单宁、总花色苷含量较高的果酒颜色深,色度值高,反之色度值则较低,但也受果酒SO2含量及pH值的影响。油橄榄酒中的黄酮类化合物主要有木犀草苷、芦丁等[3,8],总含量约为31.65 mg/L。
2.3 油橄榄酒感官分析结果
感官分析是果酒品质检验的经典方法,具有仪器分析无法替代的作用。感官分析结果表明,该果酒呈棕红色,澄清透明,无沉淀及悬浮物,具有纯正、优雅的果香与酒香,口感较舒顺、完整,有特殊的橄榄香。
2.4 油橄榄酒香气GC-MS定性结果

图3 油橄榄酒香气成分GC-MS总离子流图Fig.3 GC-MS total ion chromatogram of volatile compounds detected in Olea europaea L. wine
根据总离子流图(图3),油橄榄酒中初步鉴定出69 种香气化合物,总含量为23.44 mg/L,其中醇类12 种、酯类25 种、有机酸6 种、羰基化合物(醛和酮)8 种、萜烯类14 种、酚类4 种,分别占总组分的27.78%、45.97%、5.80%、3.39%、8.86%和8.20%,各香气物质及其含量见表2。
香气成分是衡量果酒风味品质的主要指标,果酒的香气来自果实本身、酵母发酵及陈酿等过程,其主要成分有酯、醇、萜烯、酚、缩醛、内酯、脂肪酸等[16]。各组分对香气的贡献取决于它们的浓度和阈值,根据OAV值并参考文献报道,油橄榄酒中OAV值大于1的化合物有23 种,初步确定主要香气成分有香叶醇、苯甲酸乙酯、辛酸乙酯和愈创木酚。
2.4.1 醇类化合物
发酵阶段可产生高级醇、酯和有机酸等主要香气物质,根据定性定量结果,该阶段形成的香气物质是酒最主要的香气成分。高级醇是酵母酒精发酵过程中氨基酸或糖代谢的产物,其含量受发酵条件、醪液理化指标及原料等因素的影响[13]。油橄榄酒中含量最高的醇类物质是异戊醇,其次是苯乙醇,它们都是果酒发酵中酵母的代谢产物,当其质量浓度分别高于300 mg/L和140 mg/L时会有腐臭味,低于此值则会给酒体带来宜人的果香和花香[17]。具有青草味和果香的1-己醇和顺-3-己烯-1-醇是C6醛、醇类化合物,主要由橄榄油制取过程中多不饱和脂肪酸(亚油酸和亚麻酸)在脂氧合酶作用下产生[18]。
2.4.2 酯类化合物
酯类的形成也受醪液理化组成及发酵条件的影响。酒精发酵阶段,在酯酶催化作用下酰基CoA与乙醇合成脂肪酸乙酯,乙酰CoA和高级醇合成乙酸酯[19]。在该果
酒所检出的69 种化合物中,酯类占25 种,是种类最多的化合物。

表2 油橄榄酒香气成分及含量Table 2 Aroma composition of Olea europaea L. wiinnee
酯类化合物中乙酸乙酯含量最高,在较低浓度水平下,可增加酒体香气的复杂性。具有气味活性值的乙酸异戊酯、己酸乙酯和辛酸乙酯等低分子质量酯类物质由于具有水果的芳香味而常被称为“水果”酯类[20]。
2.4.3 萜烯类化合物
萜烯类化合物属于植物体中由乙酰CoA合成的次级代谢产物,以游离态和无味的糖苷结合态存在于植物果实中,该类化合物具有浓郁的香味,且感官阈值较低[19],通常具有花香、果香、种子、木头及根茎的气味[20]。
油橄榄酒中初步鉴定出14 种萜烯类化合物,与油橄榄果实及橄榄油[18,21]中的报道相似,其中里那醇、香叶醇、异香茅醇和α-萜品醇有气味活性值,赋予酒浓郁的花香和果香。
2.4.4 其他化合物
油橄榄酒中还检测到了有机酸、羰基化合物和挥发性酚类物质等。尽管产品中鉴定出的有机酸含量都低于阈值,但这些酸仍可为酒带来新鲜感并同时平衡果香[13]。油橄榄酒中醛酮类化合物的种类少于果实和橄榄油[18,21],这可能是酿造过程中的损失及转化所致,其机理还有待进一步研究。α-紫罗酮和β-紫罗酮为紫罗兰香,在酒的香气构成中具有重要作用;β-大马酮表现为花香和果香且阈值极低(6 μg/L),对酒感官影响较大,但也有一些学者认为其主要作用是增强果实中其他化合物的香气,而非单独呈味[13]。果酒中的挥发性酚类物质来源于果实本身或酒精发酵过程,由酚酸降解或酒香酵母产生[13]。该果酒初步鉴定出的4 种挥发性酚类物质中,愈创木酚气味活性值较高。
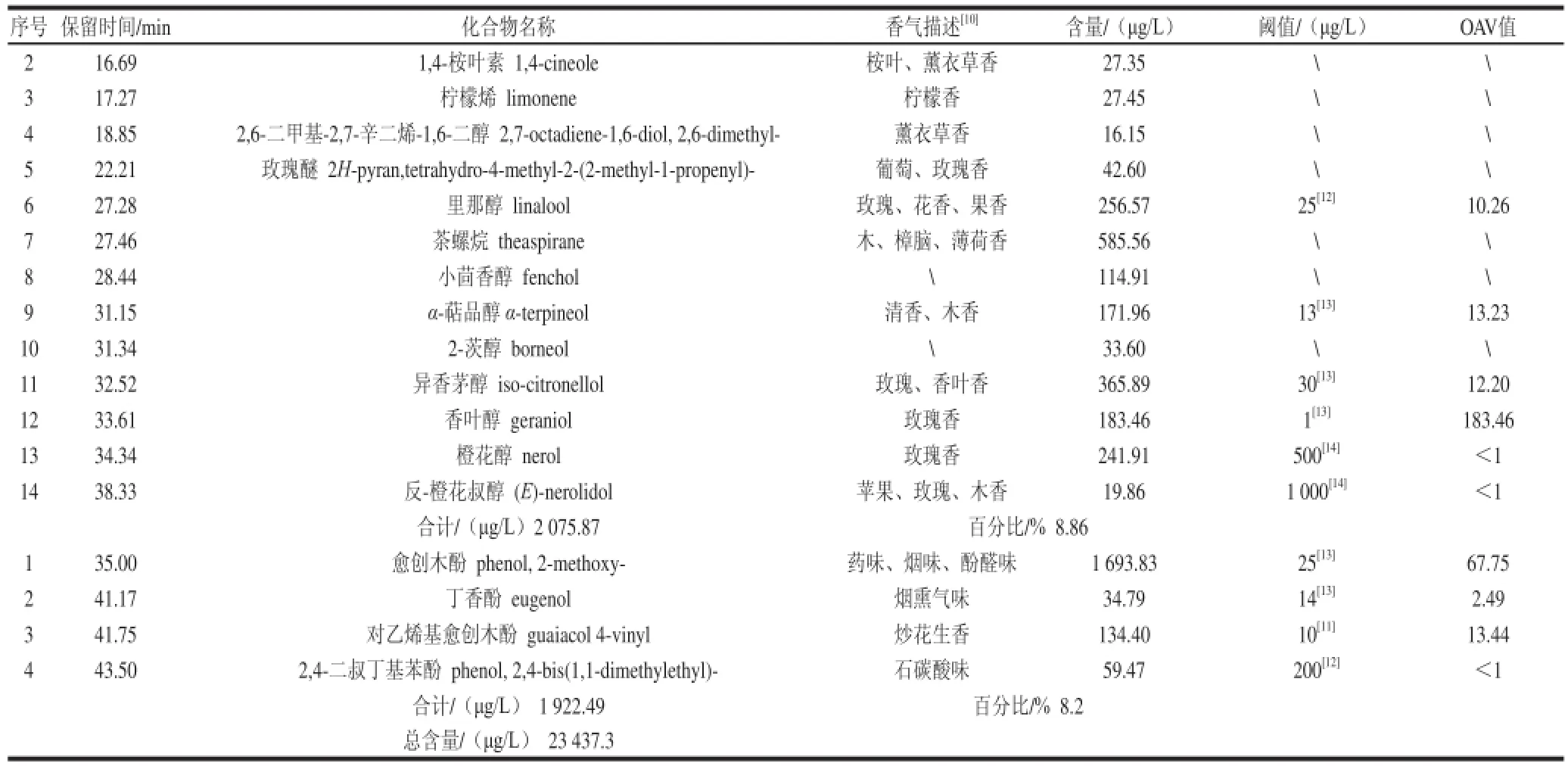
续表2
3 结 论
3.1 本实验以压榨制取橄榄油后废弃的果汁为原料,经调配发酵制得油橄榄酒。所得产品酒精体积分数(6.42%)、总糖含量(7.84 g/L)、挥发酸含量(1.04 g/L)、总二氧化硫含量(103.05 mg/L)及干浸出物含量(27.66 g/L)等理化指标均符合国家标准规定;感官分析结果表明该果酒呈棕红色,口感较舒顺、完整,具有纯正、优雅的果香、酒香及特殊的橄榄香;OAV值分析结果表明油橄榄酒主要香气成分有香叶醇、苯甲酸乙酯、辛酸乙酯和愈创木酚。
3.2 利用废弃油橄榄果汁酿造果酒方法可行,该方法在继油橄榄枝叶和果渣中有效成分的提取后进一步完善了油橄榄综合开发利用体系,对拓宽油橄榄精深加工渠道提供了理论依据。但工艺条件对酒品质的影响仍需进一步研究。
[1] 施宗明, 孙卫邦, 祁治林, 等. 中国油橄榄适生区研究[J]. 植物分类与资源学报, 2011, 33(5): 571-579.
[2] 王成章, 陈强, 孔令喜, 等. 中国油橄榄发展历程与产业展望[J]. 生物质化学工程, 2013, 47(2): 41-46.
[3] 王着. 油橄榄果渣中山楂酸和齐墩果酸提取分离工艺研究[D]. 兰州: 兰州理工大学, 2012: 1-7.
[4] PARASKEVA P, DIAMADOPOULOS E. Technologies for olive mill wastewater (OMW) treatment: a review[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(9): 1475-1485.
[5] ABRUNHOSA L, OLIVEIRA F, BELO I, et al. Lipase production by Aspergillus ibericus using olive mill wastewater[J]. Bioprocess and Biosystems Engineering, 2013, 36(3): 285-291.
[6] CLARKE R J, BAKKER J. 葡萄酒风味化学[M]. 徐岩, 译. 北京: 中国轻工业出版社, 2013: 62-66.
[7] 冒秋丹. 酵母对蛇龙珠干红酒精发酵过程中游离态和键合态香气物质的影响[D]. 兰州: 甘肃农业大学, 2012: 16-26.
[8] 郑媛媛, 李辰, 邸多隆, 等. 油橄榄叶中总黄酮含量测定方法探讨[J].光谱学与光谱分析, 2011, 31(2): 547-550.
[9] JORGE A P, QUERIS O. Analysis of volatile compounds of pineapple wine using solid-phase micro extraction techniques[J]. Food Chemistry, 2010, 122(4): 1241-1246.
[10] 刘树文. 合成香料技术手册[M]. 北京: 中国轻工业出版社, 2009: 2-454.
[11] ESCUDERO A, GOGORZA B, FERREIRA V. Characterization of the aroma of a wine from Maccabeo. Key role played by compounds with low odor activity values[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3516-3524.
[12] 段雪荣, 陶永胜, 杨雪峰. 不同成熟度赤霞珠葡萄所酿酒香气质量分析[J]. 中国食品学报, 2012, 12(11): 189-197.
[13] JUAN J, BENCOMO R, CACHO J, et al. Bound aroma compounds of Gual and Listán blanco grape varieties and their influence in the elaborated wines[J]. Food Chemistry, 2011, 127(3): 1153-1162.
[14] MOYANO L, ZEA L, MEDINA M. Analytical study of aromatic series in sherry wines subjected to biological aging[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7356-7361.
[15] CULLEREÄ L, ESCUDERO A, FERREIRA V. Gas chromatographyolfactometry and chemical quantitative study of the aroma of six premium quality Spanish aged red wines[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6): 1653-1660.
[16] STYGER G, PRIOR B, FLORIAN F, et al. Wine flavor and aroma[J]. Journal of Industrial Microbiology&Biotechnology, 2011, 38(9): 1145-1159.
[17] 宋柬, 李德美, 邓小明. 京白梨酒发酵与香气分析[J]. 农业机械学报, 2012, 43(6): 132-138.
[18] VICHI S, PIZZALE L, TAMAMES E, et al. Solid-phase micro extraction in the analysis of virgin olive oil volatile fraction: characterization of virgin olive oils from two distinct geographical areas of northern Italy[J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6572-6577.
[19] 张明霞, 吴玉文, 段长青. 葡萄与葡萄酒香气物质研究进展[J]. 中国农业科学, 2008, 41(7): 2098-2104.
[20] JACKSON R S. 葡萄酒的品尝一本专业的学习手册[M]. 王君碧, 罗梅, 译. 北京: 中国农业大学出版社, 2009: 40-58.
[21] CAMPEOL E, FLAMINI G, CHERICONI S, et al. Volatile compounds from three cultivars of Olea europaea from Italy[J]. Journal of Agricultural and Food Chemistry, 2001, 49(11): 5409-5411.
Volatile Compound Analysis of Olea europaea L. Wine
MA Teng-zhen, LI Ying, ZHANG Li, ZHANG Yan-fang, SHENG Wen-jun, ZHU Xia, HAN Shun-yu*
(Key Laboratory of Viticulture and Enology in Gansu Province, Research and Development Center of Wine Industry in Gansu Province, College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Olea europaea L. wine, fermented by Olea europaea L. juice (which arises from the production of olive oil and) with sugar/acid ratio, were evaluated for physicochemical parameters and sensory characteristics, gas chromatography-mass spectrometry (GC-MS) combined with headspace solid-phase microextraction was used to profile the volatile compounds. The results showed that the alcohol degree (6.42%), total sugar (7.84 g/L), violate acid (1.04 g/L), total sulfur dioxide (103.05 mg/L), and dry extract (27.66 g/L) of Olea europaea L. wine measured up to the Chinese national standard GB 15037-2006 Analytical Methods of Wine and Fruit Wine. A total of 69 volatile compounds were identified and quantified to account for 23.44 mg/L, which included 12 alcohols, 25 esters, 6 acids, 8 aldehydes and ketones, 14 terpenes, and 4 phenols compounds. On the basis of odor activity values, geraniol, benzoic acid ethyl ester, octanoic acid ethyl ester, and 4-vinylguaiacol were identified as the major aroma components in Olea europaea L. wine.
Olea europaea L. wine; volatile compounds; headspace solid-phase micro-extraction; gas chromatographymass spectrometry
TS262.7
A
1002-6630(2014)18-0161-06
10.7506/spkx1002-6630-201418032
2014-01-03
马腾臻(1989—),男,硕士研究生,研究方向为葡萄酒风味化学及风味酶。E-mail:matengzhen@hotmail.com
*通信作者:韩舜愈(1963—),男,教授,博士,研究方向为果蔬加工及葡萄酒风味化学。E-mail:gsndhsy@163.com

