间接竞争ELISA法检测牛乳中β-乳球蛋白含量的准确性评价
袁水林,熊 鼎,陈红兵,高金燕,李 欣,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学生命科学与食品工程学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
间接竞争ELISA法检测牛乳中β-乳球蛋白含量的准确性评价
袁水林1,2,熊 鼎1,2,陈红兵1,3,高金燕2,李 欣1,2,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学生命科学与食品工程学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
研究建立了以β-乳球蛋白标准品为包被抗原、自制抗体为一抗、辣 根过氧化物酶标记的羊抗兔IgG∶HRP为二抗、邻苯二胺为底物的间接竞争酶联免疫检测法( indirect competitive enzyme-linked immu nosorbent,ELISA)。同时以反相高效液相色谱法定量检测相同样品中β-乳球蛋白含量,采用t检验方法来评价间接竞争ELISA的方法定量检测β-乳球蛋白的准确性。t检验方法结果显示:在显著水平α=0.05下,该间接竞争ELISA法检测β-乳球蛋白的测量值较为准确。
牛乳过敏;β-乳球蛋白;间接竞争ELISA法;反相高效液相色谱
食物过敏是一种食物不良反应,属于机体对外源物质产生的一种变态反应[1]。目前,食物过敏的患病率呈增长趋势[2],估计有5%的儿童和3%~4%的成年人对食物过敏[3]。在坚果、鸡蛋、牛奶、鱼类、甲壳纲动物、大豆、小麦和花生这8大类主要食物过敏原中[4],大约有0.4%的儿童和0.2%的成年人对小麦和大豆过敏,1.5%的儿童和0.2%的成年人对鸡蛋过敏,2.5%的儿童和0.3%的成年人对牛乳过敏[2]。
牛乳及乳制品因其含有较高的营养价值而受到广大消费者的青睐,但同时, 牛乳及牛乳制品又是常见的8大食物过敏原之一[4]。有研究报道[5],婴幼儿对牛乳过敏的发病率已经高达7.5%。绝大部分牛乳过敏反应属于IgE介导的速发型超敏反应,也有非IgE介导的,如胃肠道紊乱[6]。牛乳中有20多种蛋白可能会导致牛乳过敏[7],其中酪蛋白、α-乳白蛋白和β-乳球蛋白为牛乳中的最主要过敏原。牛乳中的β-乳球蛋白作为反刍动物乳清中最主
要的蛋白质,在IgE介导的牛乳过敏反应中,60%的病人是对β-乳球蛋白过敏[8]。其含量占乳清蛋白的50%,牛乳总蛋白含量的10%。β-乳球蛋白单体的分子质量大约为18.3 kD,含有162 个氨基酸残基,等电点为5.3,分子内含有5 个二硫键[9-10],属于Lipocalin蛋白家族[11]。
根据实验室已建立的间接竞争ELISA,对实验条件加以改进,建立了检测鲜乳中牛乳β-乳球蛋白含量的方法。检测方法的评价引入统计学中t检验方法来验证间接竞争ELISA法检测牛乳以及乳清中β-乳球蛋白含量的准确性。本实验以反相高效液相色谱法定量牛乳以及乳清中的β-乳球蛋白的质量浓度作为对照,以确保实验数据的准确性。
1 材料与方法
1.1 材料与试剂
鲜牛奶 江西光明乳业有限责任公司。
β-乳球蛋白标准品(纯度90%)、羊抗兔IgG∶HRP酶标二抗 德国Sigma公司;低分子质量蛋白Marker 中国Tiangen公司;抗血清(一抗) 实验室自制[12]。
1.2 仪器与设备
ALLEGRA 64R Centrifuge冷冻离心机 美国贝克曼库尔特有限公司;PB-10型pH计 德国Sartorius公司;Mode 1860酶标仪、PowerPac 3000电泳 仪、Quantity One凝胶成像系统 美国Bio-Rad公司;LC-20AT反相高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 乳清样品的制备
1.3.1.1 鲜牛乳脱脂
用四层消毒纱布过滤鲜牛乳,除去鲜牛乳中大部分杂质,然后用高速冷冻离心机(8 000 r/min、4 ℃、10 min)脱脂,得到脱脂乳。
1.3.1.2 沉淀酪蛋白
分离脱脂乳中的酪蛋白,本实验采用的是等电点沉淀的方法[13]:脱脂乳在40 ℃的水浴锅内保温,用5 mol/L盐酸调其pH值至4.6,30 min后用高速冷冻离心机离心分离(8 000 r/min、15 min),收集离心上清液,得到乳清。
1.3.1.3 SDS-PAGE检测乳清蛋白
用不连续十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)电泳,根据分子质量对分离蛋白进行检测。所用浓缩胶质量分数为5%;分离胶质量分数为12%。样品在浓缩胶中时,恒定电流6 mA,电泳时间30 min;进入分离胶后,恒定电流在12 mA,电泳时间65~75 min。用低分子质量蛋白Marker作为参比。
1.3.2 间接竞争ELISA法检测蛋白浓度
96 孔酶标板每孔加入2.5 μg/mL 100 μL的包被抗原(β-乳球蛋白标准品),放于4 ℃冰箱过夜。次日恢复至室温,倾去包被液,每孔加磷酸盐吐温(tween phosp hate buffered saline,PBST)缓冲液300 μL洗涤3 次,每次5 min,扣干。每孔加250 μL 1%的明胶作为封阻液,37 ℃孵育1 h。恢复至室温,倾去封阻液,PBST满孔洗涤3 次,每次5 min,扣干。倍比稀释的竞争抗原50 μL与50 μL稀释的抗血清在板外反应l h后,加入包被有抗原的孔,37 ℃孵育1h后,以PBST洗涤,扣干3 次。每孔加入100 μL 1∶5 000稀释的羊抗兔 IgG:HRP, 37 ℃保温保湿1 h后,以PBST洗涤扣干3 次。每孔加反应底物100 μL,37 ℃保温避光反应15 min。每孔50 μL 2mol/L H2S O4终止反应。设置阴性孔(磷酸盐缓冲液(phosphate buffered saline,PBS)代替竞争抗原和抗血清),阳性孔(PBS代替竞争抗原)。用酶标仪于490 nm波长处测定。
1.3.3 反相高效液相色谱法测定β-乳球蛋白
1.3.3.1 标准品溶液的制备
精确称取β-乳球蛋白标准品用超纯水配制成30、40、50、60、70、80、90、100 μg/mL的标准品溶液,保存于4 ℃冰箱中备用,上样前用孔径为0.22 μm的针式滤头过滤。
1.3.3.2 样品溶液的制备
取鲜牛乳以及上述乳清,鲜牛乳用超纯水稀释50 倍,乳清用超纯水稀释10 倍,上样前用孔径为0.22 μm的针式滤头过滤。
1.3.3.3 色谱条件
本实验采用的色谱条件[14]为:色谱柱Inertsil WP300 C8(5 μm,4.6 mm×250 mm);流动相A为含0.05%三氟乙酸的乙腈,流动相B为含0.1%三氟乙酸的超纯水;梯度洗脱程序为流动相A在15 min内从30%上升到50%,然后用2 min从50%降到30%;流速1 mL/min;柱温25℃;检测波长280 nm;进样量50 μL。
1.3.4 数据处理
1.3.4.1 间接竞争ELISA法检测蛋白浓度竞争抑制率:

1.3.4.2 t检验参数


2 结果与分析
2.1 牛乳乳清的分离电泳图

图1 牛乳乳清的 SDS-PAGE 电泳图Fig.1 SDS-PAGE pattern of whey proteins
由图1可以看出,牛乳经过脱脂以及等电点沉淀可除去水牛乳中的绝大部分酪蛋白后,得到的牛乳乳清主要含β-乳球蛋白、α-乳白蛋白,还含有少量乳铁结合蛋白以及牛血清蛋白,而酪蛋白几乎没有。
2.2 间接竞争ELISA法检测β-乳球蛋白质量浓度

图2 β-乳球蛋白间接竞争ELISA竞争抑制曲线Fig.2 Indirect competitive ELISA curve of bovine β-lactoglobulin
根据本实验室[12]建立的间接竞争ELISA方法检测β-乳球蛋白的最佳条件,确定实验所用包被液、竞争抗原、一抗(抗血清)、酶标二抗质量浓度。通过预实验分析,竞争抗原质量浓度在1~1 000 ng/mL范围内接竞争ELISA抑制曲线有较好的线性关系,作该质量浓度范围内的标准曲线。第1次检测样品所用的标准曲线见图2,后9 次重复实验样品所需要的标准曲线制作方法一样。得到的标准方程为:y=-0.045 3x+89.996,R2=0.984 1。
根据1.3.2节实验步骤和1.3.4.1节竞争抑制率的计算公式,定量检测不同牧场的鲜牛乳和乳清,重复10 次,得到牛乳中β-乳球蛋白质量浓度含量见表1,牛乳乳清中β-乳球蛋白含量见表2。

表1 间接竞争ELISA法检测牛乳中β-乳球蛋白质量浓度Tabllee 11 β-Lactoglobulin concentration in fresh milk assayed using indirect competitive ELISA mg/mL

表2 间接竞争ELISA法检测牛乳乳清中β-乳球蛋白质量浓度Tabllee 22 β-Lactoglobulin concentration in whey assayed using indirect competitive ELLIISSAA mg/mL

表3 反相高效液相色谱定量检测标准品中-乳球蛋白Table 3 Quantitation of -lg concentration in standard substance using RP-HPLC

表4 反相高效液相色谱法定量样品中β-乳球蛋白Table 4 Analysis of -lg concentration in milk and whey using RP-HPLC mg/mL
2.3 反相高效液相色谱法定量β-乳球蛋白质量浓度
根据1.3.3.3节反相高效液相色谱法测定β-乳球蛋白质量浓度的色谱条件,配制所需标准品溶液以及样品溶液。由反相高效液相所得超纯水、β-乳球蛋白标准品、鲜牛乳以及牛乳乳清的图谱如图3所示,β-乳球蛋白保
留时间16.847 min。根据各质量浓度标准品的峰面积见表3,采用外标法建立定量β-乳球蛋白质量浓度的标准曲线见图4,y=2 302.4x-19 339,R2=0.997 7。

图3 反相高效液相色谱图Fig.3 RP-HPLC chromatograms
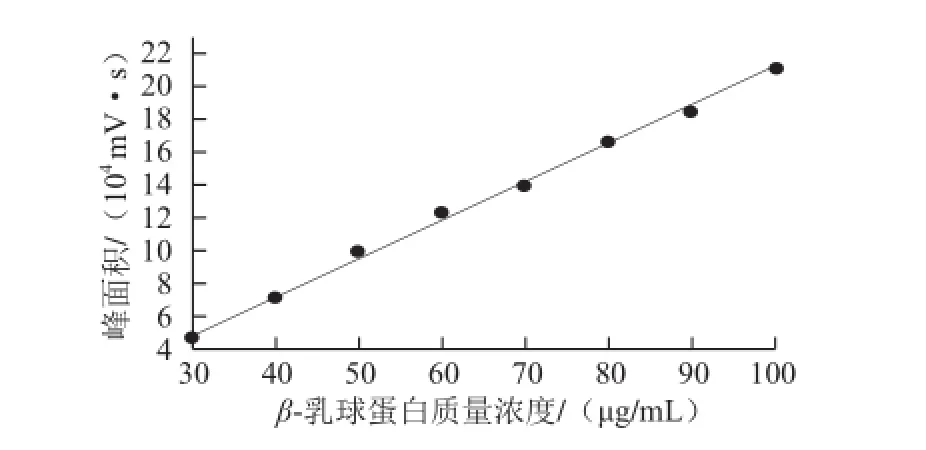
图4 反相高效液相测定牛乳β-乳球蛋白标准品的标准曲线Fig.4 Standard curve for β-lg concentrations of standard substance using RP-HPLC
根据图4建立的牛乳β-乳球蛋白标准品质量浓度与峰面积的标准曲线,由反相高效液相色潽法所测鲜牛奶以及乳清的峰面积,平行取3 次样品,定量各牧场鲜牛奶以及乳清中所含的β-乳球蛋白含量见表4。
2.4 评价间接竞争ELISA法检测牛乳中β-乳球蛋白含量的准确性
根据反相高效液相色谱法定量每个牧场中牛乳以及乳清中的β-乳球蛋白质量浓度(表3),本实验用t检验方法来验证间接竞争ELISA法检测牛乳以及乳清中β-乳球蛋白含量(表1与表2)的准确性。根据1.3.4.2节的计算公式, 计算出各t检验参数见表5。
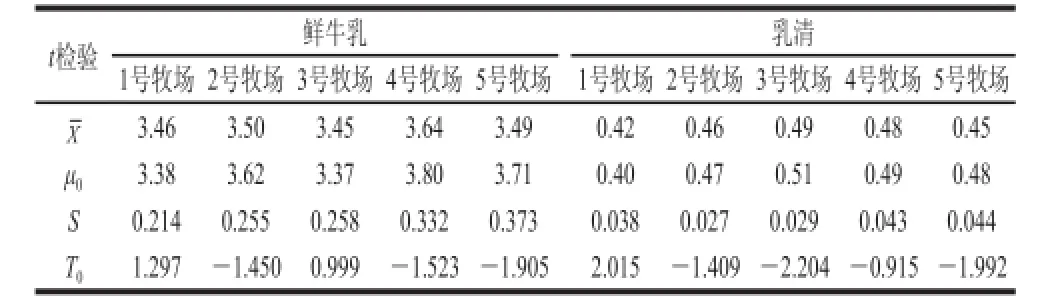
表5 鲜牛乳及乳清检验参数Table 5 The -test parameters for milk and whey
在显著水平α=0.05下,查自由度n-1=9的t-分布表,得临界值t0.025(9)=2.262,由表5的各组数据的观测值|T0|<t0.025(9),即在显著水平为α=0.05下,使用间接竞争ELISA法检测的测量值较为准确。
3 讨 论
检测食物过敏原的方法有多种,其中ELISA是最为常用的方法之一。ELISA最早由Engvall课题组[15]与Schuurs课题组[16]同时建立。它利用酶标记物同抗原抗体复合物的免疫反应与酶的催化放大作用相结合,即保持了酶催化反应的敏感性,又保持了抗原抗体反应的特异性,因而极大地提高了灵敏度[17]。目前常用的ELISA有以下几类,间接ELISA、夹心ELISA、竞争ELISA和间接竞争ELISA。本研究采用间接竞争ELISA检测牛乳中的主要过敏原-β-乳球蛋白,兼有间接ELISA以及竞争ELISA方法的优点。本研究在实验室建立的对间接竞争ELISA的方法检测β-乳球蛋白[12]的基础上,对实验条件适当改进,最终使用实验条件为包被液质量浓度2.5 μg/mL、一抗浓度稀释1∶300 000、二抗浓度稀释1∶5 000,发现在此条件下测定的β-乳球蛋白标准品线性关系最佳,吸光强度最强。
间接竞争ELISA检测方法因其具有高特异性、高灵敏度、快速等优点,目前间接竞争ELISA的方法检测牛乳中的β-乳球蛋白含量有许多研究[18-20]。布冠好等[21]以检
测的批内误差和批间误差来说明该方法的灵敏度和重复性,但未对该检测方法的准确性进行评估。张海英等[22]从回收率、精密度、特异性等方面比较了两个品牌的ELISA试剂盒,对方法的准确性并未采用其他有效方法来验证而只是用加标回收率来说明,不能排除方法本身带来的的系统误差。赵金龙[23]和张忠华[24]等也未使用其他方法来验证间接竞争ELISA检测方法的准确性。本研究应用间接竞争ELISA方法与RP-HPLC方法相结合来检测β-乳球蛋白含量,通过统计学t检验方法来评价间接竞争ELISA方法检测β-乳球蛋白的准确性。通过本研究对该方法准确性的评价,为鲜牛奶中β-乳球蛋白含量的检测提供技术基础,有助于解决我国食品安全中的过敏原牛乳β-乳球蛋白的检测问题,为开发低敏性牛乳制品提供了一定的实验依据和技术手段。
应用RP-HPLC分析牛乳蛋白国内外已有大量研究[25-27],因该方法虽成本较高,但准确灵敏,所以本实验以该测量值为标准值来评价使用间接竞争ELISA方法检测β-乳球蛋白的准确性。然后使用t检验方法评价间接竞争ELISA方法检测β-乳球蛋白的准确性。t检验是应用最多的统计分析方法之一,它具有计算简单以及检验功效较高等优点。从本实验结果来看,在使用间接竞争ELISA方法检测β-乳球蛋白10 个样品的10 组实验中,在显著水平α=0.05下,各组样品实验数据的观测值|T0|<t0.025(9),即在显著水平为α=0.05下,使用该实验条件的间接竞争ELISA法检测β-乳球蛋白的测量值较为准确。
[1] 邵洁, 夏振炜, 李云珠, 等. IgE介导的食物过敏诊断程序及临床评价[J].临床儿科杂志, 2007, 25(1): 23-25.
[2] SICHERER S H. Food allergy[J]. The Mount Sinai Journal of Medicine, 2011, 78(5): 683-696.
[3] SICHERER S H, SAMPSON H A. Food allergy[J]. The Journal of Allergy and Clinical Immunology, 2010, 125(2): 116-125 .
[4] BIRMINGHAM N P, PARVATANENI S, HASSAN H M, et al. An adjuvant-free mouse model of tree nut allergy using hazelnut as a model tree nut[J]. International Archives of Allergy and Immunology, 2007, 144(3): 203-210.
[5] WILSON N W, HAMBURGER R N. Allergy to cow’s milk in the fi rst year of life and its prevention[J]. Ann Allergy, 1988, 61(5): 323-327.
[6] W AL J M. Bovine milk allergenicity[J]. Ann Allergy Asthma Immunol, 2004, 93: s2-s11.
[7] EL-AGAMY E I. The challenge of cow milk protein allergy[J]. Small Ruminant Research, 2007, 68(1/2): 64-72.
[8] TAYLOR S L. Immunologic and allergic properties of cow’s milk proteins in humans[J]. Journal of Food Protection, 1986, 49(3): 239-250.
[9] APENTEN R, KHOKHAR S, GALANI D. Stability parameters for β-lactoglobulin thermal dissociation and unfolding in phosphate buffer at pH7[J]. Food Hydrocolloids, 2002, 16(2): 95-103.
[10] FRITSCHE R, ADEL-PATIENT K, BERNARD H, et a1. IgE-mediated rat mast cell triggering with tryptic and synthetic peptides of bovine betalactoglobulin[J]. International Archives of Allergy and Immunology, 2005, 138(4): 291-297.
[11] MANTYJARVI R, RAUTIAINEN J, VIRTANEN T. Lipocalins as allergens[J]. Biochimica et Biophysica Acta, 2000, 1482(1/2): 308-3l7.
[12] 罗曾玲. 抗水牛乳β-乳球蛋白多克隆抗体的制备与应用[D]. 南昌:南昌大学, 2007.
[13] 陶慰孙, 李惟, 姜涌明. 蛋白质分子基础[M]. 北京: 高等教育出版社, 1995: 68-69.
[14] 王莹, 屈玉霄, 刘春红, 等. 高效液相色谱法测定α-乳白蛋白和β-乳球蛋白[J]. 食品研究与开发, 2013, 34(2): 57-60.
[15] ENGVALL E, PERLMANN P. Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G[J]. Immunochemistry, 1971, 8(9): 871-874.
[16] SCHUURS A H, van WEEMEN B K. Enzyme-immunoassay: a powerful analytical tool[J]. Journal of Immunoassay, 1980, 1(2): 229-249.
[17] 焦奎, 张书圣. 酶联免疫分析技术及应用[M]. 北京: 化学工业出版社, 2004: 8-9.
[18] LUIS R, LAVILLA M, SANCHEZ L, et a1. Development and evaluation of two ELISA formats for the detection of β-lactoglobulin in model processed and commercial foods[J]. Food Control, 2009, 20(7): 643-647.
[19] PELAEZ-LORENZO C, DIEZ-MASA J C, VASALLO I, et al. A new sample preparation method compatible with capillary electrophoresis and laser-induced fluorescence for improving detection of low levels of beta-lactoglobulin in infant foods[J]. Analytica Chimica Acta, 2009, 649(2): 202-210.
[20] KARAMONOVA L, FUKAL L, KODICEK M, et a1. Immunoprobes for thermally-induced alterations in whey protein structure and their application to the analysis of thermally-treated milks[J]. Food and Agricultural Immunology, 2003, 15(2): 77-91.
[21] 布冠好, 郑喆, 郑海, 等. 牛乳过敏原β-乳球蛋白间接竞争ELISA检测方法的建立[J]. 中国农业大学学报, 2008, 13(6): 71-76.
[22] 张海英, 刘旸, 吴冬雪, 等. 食品中β-乳球蛋白过敏原检测方法的比较[J]. 食品安全质量检测学报, 2012, 4(3): 295-299.
[23] 赵金龙. β-乳球蛋白两种酶联免疫检测方法的建立和比较[D]. 天津: 天津科技大学, 2010.
[24] 张忠华. 牛乳α-乳白蛋白和β-乳球蛋白间接竞争ELISA检测方法的建立[D]. 昆明: 昆明医学院, 2009.
[25] BONFATTI V, GIANTIN M, ROSTELLATO R, et a1. Separation and quantif i cation of water buffalo milk protein fractions a nd genetic variants by RP-HPLC[J]. Food Chemistry, 2013, 136(2): 364-367.
[26] 成希飞, 李昀锴, 向明霞, 等. 反相高效液相色谱法对南方水牛乳乳清蛋白的分离和定量分析[J]. 食品科技, 2012, 37(11): 289-292.
[27] BONFATTI V, GRIGOLETTO L, CECCHINATO A, et a1. Validation of a new reversed-phase high-performance liquid chromatography method for separation and identification o f bovine milk protein genetic variants[J]. Journal of Chromatograpy A, 2008, 1195(1/2): 101-106.
Evaluation of the Accuracy of Indirect Competitive ELISA Used to Detect Milk β-Lactoglobulin
YUAN Shui-lin1,2, XIONG Ding1,2, CHEN Hong-bing1,3, GAO Jin-yan2, LI Xin1,2,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330047, China; 3. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
An indirect competitive enzyme-linked immunosorbent assay (ELISA) was established with the standard β-lactoglobulin as the coated antigen, specif i c rabbit antibody against β-lactoglobulin as the primary antibody, horseradish peroxidase labeled goat anti-rabbit IgG:HRP as the secondary antibody and o-phenylenediamine as the substrate solution. Reversed-phase high-performance liquid chromatography (RP-HPLC) was used as the reference method. The t-test method proved that the indirect competiti ve ELISA for detection of β-lactoglobulin was feasible and accurate. The results of t-test at a signif i cance level α = 0.5 showed that the indirect competitive ELISA was more accurate to detect the concentration of β-lactoglobulin.
milk allergy; β-lactoglobulin; indirect competitive enzyme-linked immunosorbent assay; reversed-phase highperformance liquid chromatography
TS207.3
A
1002-6630(2014)18-0100-05
10.7506/spkx1002-6630-201418020
2014-04-07
“十二五”国家科技支撑计划项目(2012BAK17B02);国家自然科学基金青年科学基金项目(31260204;31301522);江西省自然科学基金项目(2012BAB204002);江西省教育厅课题(GJJ12143)
袁水林(1989—),男,硕士研究生,研究方向为食品科学与工程。E-mail:yslin1989@163.com
*通信作者:李欣(1980—),女,副教授,博士,研究方向为食品生物技术。E-mail:zhizilixin@hotmail.com

