葡萄籽原花青素的提取及其抗紫外线活性测定
杨 健,袁春龙,2,*,任亚梅,方玉飞,杨晓雁,张世杰
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100;3.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
葡萄籽原花青素的提取及其抗紫外线活性测定
杨 健1,袁春龙1,2,*,任亚梅3,方玉飞1,杨晓雁1,张世杰1
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100;3.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
采用快速溶剂萃取法提取葡萄籽脱脂粉中的原花青素,通过单因素试验和正交试验优化提取工艺,最终获得葡萄籽原花青素提取物(grape seed proanthocyanidins extracts,GSPE)干粉。快速简便地测定不同质量浓度的GSPE乙醇溶液的防晒系数以反映抗紫外线活性,并探究GSPE乙醇溶液质量浓度对其抗紫外线活性的影响。结果表明,快速溶剂萃取法以乙醇做安全提取剂,最佳提取参数为萃取压强1 100 psi、萃取时间14 min、萃取温度70 ℃、乙醇体积分数70%,在此条件下,提取原花青素得率为71.62 mg/g,纯度为41.53%;1 000 μg/mL的原花青素提取物乙醇溶液的防晒系数值达24.755 6±0.759 9,具有显著抗紫外线活性;GSPE抗紫外线活性与质量浓度在一定范围内呈显著正相关。
抗紫外线;葡萄籽原花青素提取物;紫外分光光度计法;防晒系数;快速溶剂萃取法
原花青素是由黄烷-3-醇或黄烷-3,4-二醇聚合而成的一类多酚化合物,具有特殊抗氧活性,在医药领域已经得到应用,它可以显著改善因高血糖症引起的肝损伤[1],对重度抑郁症[2]的治疗有一定的作用。此外,原花青素还可以保护皮肤不受紫外线伤害,降低皮肤癌发病的几率[3-7],具备美白及抑制黑色素瘤生长[8-9]、保湿等美容效果,具有开发成防紫外线功效化妆品的潜力。目前,化妆品领域常用防晒剂的还是以甲氧基肉桂酸乙基己酯[10]、丁基甲氧基二苯甲酰基甲烷[11]等化学防晒剂为主等,但是这类防晒剂可能引发光接触致敏和光致敏[12-14],研究开发天然植物防晒剂的需要则更为迫切。
目前提取葡萄籽原花青素物的方法主要有超声波提取、微波提取等,但是耗费溶剂时间而且可能降低成分活性。本研究采用快速溶剂萃取法,大大降低了溶剂耗
费,缩短提取时间,并且简化了样品前处理程序[15-17],以乙醇作为提取溶剂更加安全,在合理选择溶剂体积分数、萃取时间、温度、压强的基础上,可以快速获得安全的葡萄籽原花青素提取物。
我国化妆品卫生规范2007版及欧洲化妆品盥洗用品及香水协会关于防晒化妆品防晒效果的评价方法是人体法,但是人体法操作复杂,可变因素繁多,是针对防晒霜产品的评价方式,不完全适用于防晒剂筛选阶段的科研过程。本研究采用体外紫外分光光度法测定防晒系数(sun-protection factor,SPF)值[18-19],既简便快速,又直观准确地评价葡萄籽原花青素乙醇提取物防晒效果,可用于产品开发过程中抗紫外线效果的分析,为其以后在化妆品领域应用提供指导。迄今为止,关于体外分光光度计法测定葡萄籽原花青素提取物(grape seeds proanthocyanidins extracts,GSPE)抗紫外线活性,及其与相应质量浓度间具体关系的研究鲜有报道。
1 材料与方法
1.1 材料与试剂
葡萄籽取自西北农林科技大学葡萄酒学院,自然晒干。
乙醇、石油醚、浓盐酸等均为国产分析纯;香草醛广东汕头市西陇化工厂;原花青素标准品 上海源叶生物科技有限公司。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本岛津公司;微型植物试样粉碎机 天津泰斯特仪器有限公司;ASE快速溶剂萃取仪 美国戴安公司;旋转蒸发仪 上海亚荣生化仪器厂;索氏提取器 上海精密仪器有限公司;LGJ-10D 型真空冷冻干燥机 北京四环科学仪器厂有限公司。
1.3 方法
1.3.1 葡萄籽脱脂粉的制备
将自然晾干葡萄籽40 ℃干燥2 h,后-20 ℃冷冻30 min,经植物粉碎机粉碎,过筛得到葡萄籽粉,于索氏提取器中以石油醚为脱脂溶剂,水浴温度70~80 ℃,浸提24 h。后取出干燥得脱脂粉,-20 ℃保存备用。
1.3.2 盐酸香草醛法测定原花青素含量
采用香草醛-浓盐酸法[20-22],以原花青素为标准品制作标准曲线,得回归方程:y=1.657 9x+0.011 3,R2=0.999 5,其中,y为吸光度,x为原花青素质量浓度/(mg/mL),线性质量浓度范围为0.125~0.625 mg/mL。精密吸取葡萄籽提取液,定容至一定体积V1,再稀释d 倍,再取稀释后的样液1 mL,加入5 mL显色剂,摇匀,避光,30 ℃水浴30 min,500 nm波长处测定吸光度,根据回归方程查得原花青素质量浓度C/(μg/mL)。
纯度测定:将葡萄籽提取液冷冻干燥,称取1.0 mg干粉,用甲醇定容至一定体积V2,再取稀释后的样液1 mL,加入5 mL显色剂,摇匀,避光,30 ℃水浴30 min,500 nm波长处测定吸光度,根据回归方程计算原花青素质量浓度C/(μg/mL)。
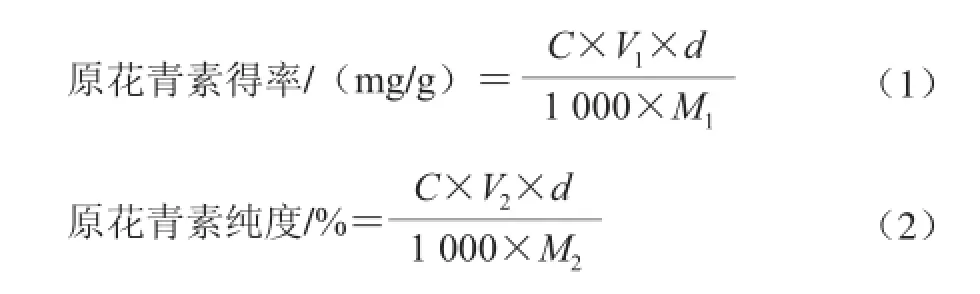
式中:M1为葡萄籽脱脂粉质量/g;M2为葡萄籽原花青素提取物干粉质量/g。
1.3.3 快速溶剂萃取法提取原花青素单因素试验
选取乙醇为提取溶剂,分别考察萃取压强、萃取时间、萃取温度、乙醇体积分数4 个因素对原花青素提取率的影响。
1.3.4 快速溶剂萃取法提取原花青素正交试验设计
综合单因素试验结果,选取萃取压强、时间、温度、乙醇体积分数中对原花青素影响显著的因素为考察因素,每个因素拟定3 个水平,选用正交试验表,以原花青素得率作为考核指标,进行正交试验筛选最佳快速溶剂提取工艺条件,因素水平见表1。

表1 原花青素的快速溶剂萃取正交试验因素与水平Table 1 Factors and levels used in orthogonal array design
1.3.5 体外紫外分光光度法测定SPF
体外分光光度法测定SPF是基于光谱学的方法,测定样品在特定波长下的紫外透光率,并借助太阳光谱强度标准数据来获得相应的SPF值。Mansur等[23]开发了一个非常简单的数学方程代替Sayre等[24]的体外方法,利用紫外线分光光度法和式(3)[23-24]进行计算。

式中:CF为校正因子(10);Iλ为太阳光谱强度,EEλ为波长λ下辐射的红斑效应,Aλ为在波长λ波长下吸光度。EEλ× Iλ是常量,它们由Sayre等[24]测定。
精确称取GSPE干粉1.000 0 g,以乙醇定容至100 mL,超声波振荡5 min后,以0.45 μm的微孔滤膜过滤,最初的10 mL滤液弃去,得到10 000 μg/mL母 液;取母液以乙醇稀释,分别得到10、100、300、500、700、900、1 000、5 000 μg/mL待测液。使用紫外分光光度计,在290~320 nm,每隔5 nm测定3 次吸光度,1 cm石英比色皿,乙醇作为空白对照。应用Mansur方程计算SPF[25-29]。

表2 SPF计算规范系数常量Table 2 Normalized product function used in the calculation of SPF
2 结果与分析
2.1 单因素试验
2.1.1 萃取压强对原花青素得率的影响
在5 种不同萃取压强下进行快速溶剂萃取,分别为800、1 000、1 200、1 400、1 600 psi,乙醇体积分数70%、时间10 min、温度70 ℃条件下循环两次使用快速溶剂萃取仪静态萃取,结果见图1。

图1 萃取压强对原花青素得率的影响Fig.1 Effect of extraction pressure on the yield of proanthocyanidins
由图1可见,萃取压强1 200 psi时为提取的原花青素最多,随着萃取时间的延长,原花青素得率降低,可能是过高压强导致原花青素裂解,故选择1 200 psi为宜。同时由单因素方差分析可知P=0.040 5<0.05,说明此因素在试验水平内影响显著。
2.1.2 萃取时间对原花青素得率的影响
在5 种不同时间下进行快速溶剂萃取,分别为5、8、11、14、17 min,乙醇体积分数70%、压强1 000 psi、温度70 ℃条件下循环两次使用快速溶剂萃取仪静态萃取,结果见图2。
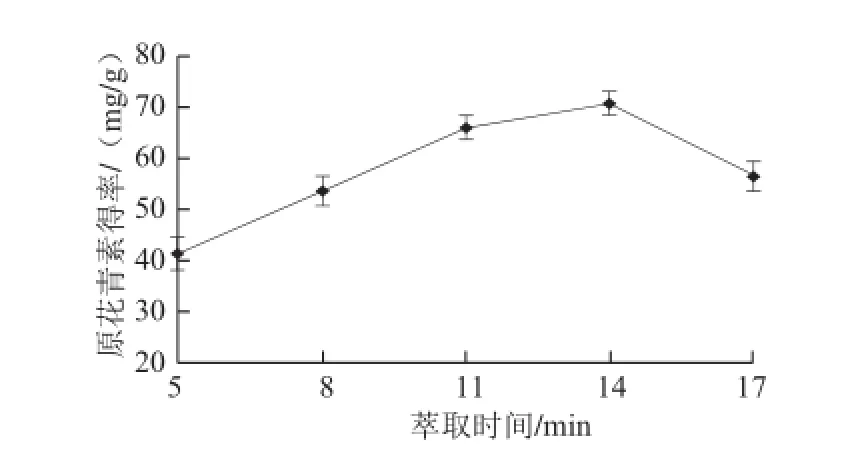
图2 萃取时间对原花青素得率的影响Fig.2 Effect of extraction time on the yield of proanthocyanidins
由图2可见,萃取时间从5~14 min时原花青素得率明显升高,随着萃取时间的延长,反而,原花青素得率降低,可能是其他干扰物质增多。故选择14 min为宜,同时由单因素方差分析知P=0.000 0<0.05,说明此因素在试验水平内影响显著。
2.1.3 萃取温度对原花青素得率的影响
在5 种不同温度下进行快速溶剂萃取,分别为40、50、60、70、80 ℃,乙醇体积分数70%、压强1 000 psi、时间10 min条件下循环两次使用快速溶剂萃取仪静态萃取,结果见图3。
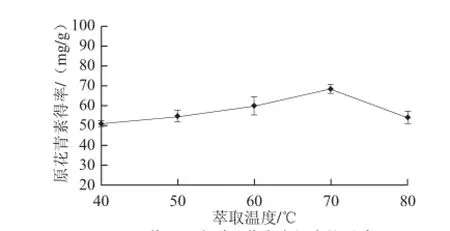
图3 萃取温度对原花青素得率的影响Fig.3 Effects of extraction temperature on the yield of proanthocyanidins
由图3可见,萃取温度为70 ℃提取的原花青素最多,随着萃取温度升高,原花青素得率降低,可能温度过高导致原花青素结构遭破坏。选择70 ℃为宜。同时由单因素方差分析知P=0.000 2<0.05,说明此因素在试验水平内影响显著。
2.1.4 乙醇体积分数对原花青素得率的影响
采用5 种不同乙醇体积分数进行研究,分别为60%、70%、80%、90%、100%,萃取时间10 min,压强1 000 psi、温度70 ℃条件下循环两次使用快速溶剂萃取仪静态萃取,结果见图4。

图4 乙醇体积分数对原花青素得率的影响Fig.4 Effect of ethanol concentration on the yield of proanthocyanidins
由图4可见,随着乙醇体积分数升高,原花青素得率先升高,但乙醇体积分数达到80%以上时,得率下降,可能由于一些醇溶性杂质成分溶出增多,干扰因素随之增大,且考虑节省溶剂减低污染,故选择80%为宜,同时由单因素方差分析知P=0.003 6<0.05,说明此因素在试验水平内影响显著。
2.2 正交试验
对萃取压强、萃取时间、萃取温度、乙醇体积分数
进行四因素三水平正交试验,以确定最佳的提取工艺条件。对正交试验进行极差分析和方差分析,分析结果(表3、4)表明,4 种考察因素对GPC提取率影响程度高低顺序为B>C>D>A,即萃取时间>萃取温度>乙醇体积分数>萃取压强,其中萃取压强对提取率影响在0.05水平上,差异不显著,其余3 个因素均有显著性。其适宜提取工艺组合:A1B2C2D1即萃取压强1 100 psi、萃取时间14 min、萃取温度70 ℃、乙醇体积分数70%。此工艺条件下原花青素得率为71.62 mg/g,纯度为41.53%。
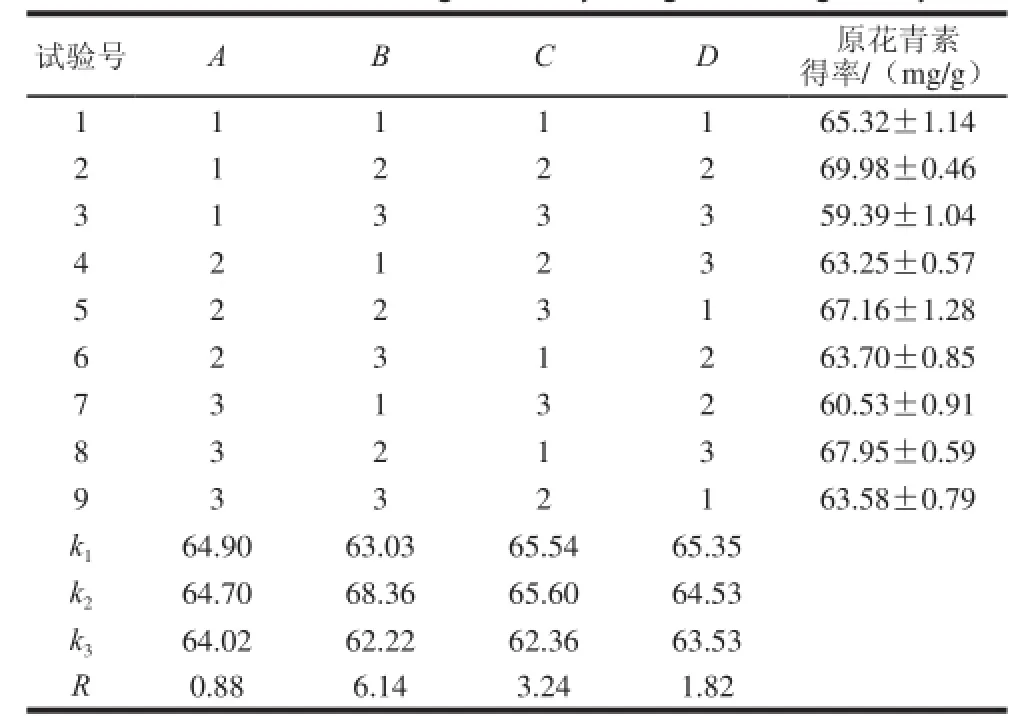
表3 葡萄籽原花青素提取工艺正交试验及结果Table 3 Results of orthogonal array design and range analysis
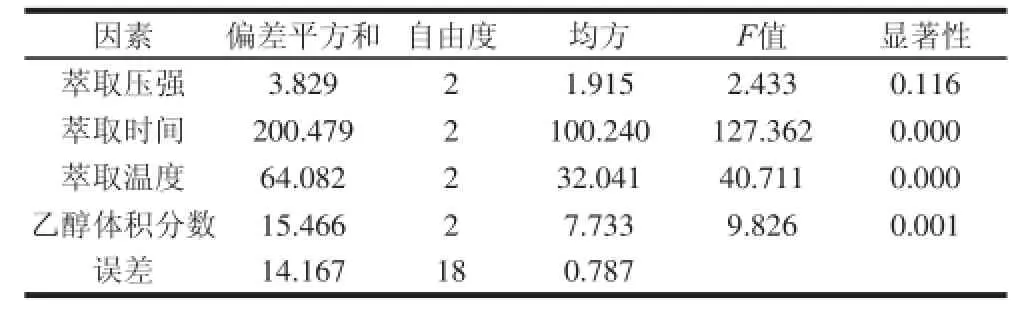
表4 葡萄籽原花青素提取工艺正交试验方差分析Table 4 Analysis of variance for the yield of proanthocyanidins
2.3 不同质量浓度的葡萄籽原花青素的抗紫外线能力测定
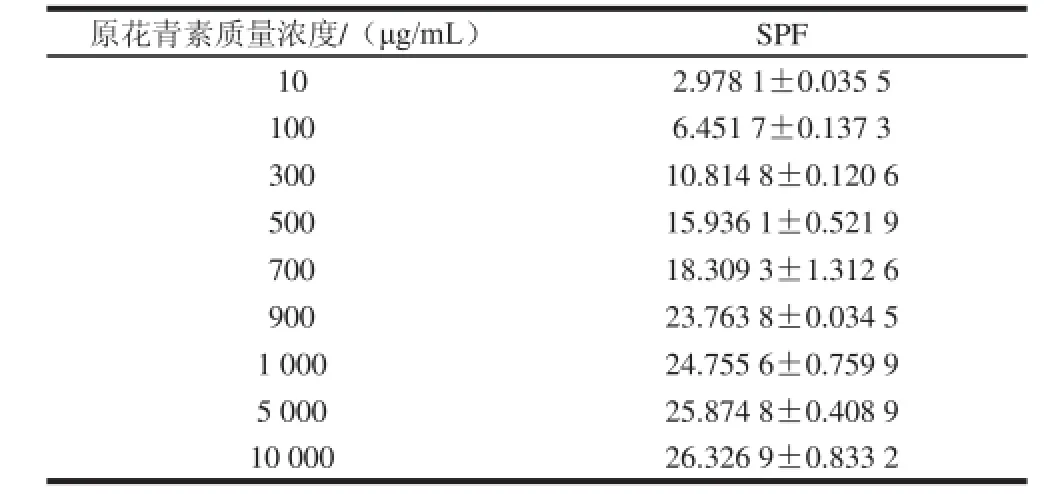
表5 葡萄籽原花青素乙醇提取物的SPF测定Table 5 SPF of GSPE
SPF是定量测量防晒剂有效性的标准。体外法的防晒系数测定在产品开发阶段用于防晒剂筛选实验很有效,是防晒系数测量人体实验的有效补充。本研究中,使用紫外分光光度法,测得GSPE不同质量浓度的醇溶液在290~320 nm,每隔5 nm测定3 次吸光度,应用Mansur方程计算SPF,结果如表5所示。
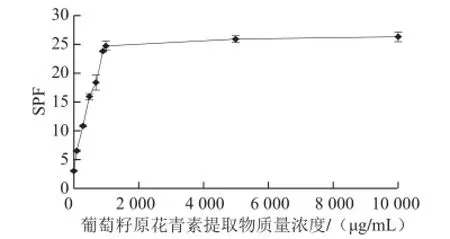
图5 葡萄籽原花青素提取物质量浓度对SPF的影响(10~10 000 μg/mL)Fig.5 Effect of GSPE concentration on SPF (10-10 000 μgg//mmLL)
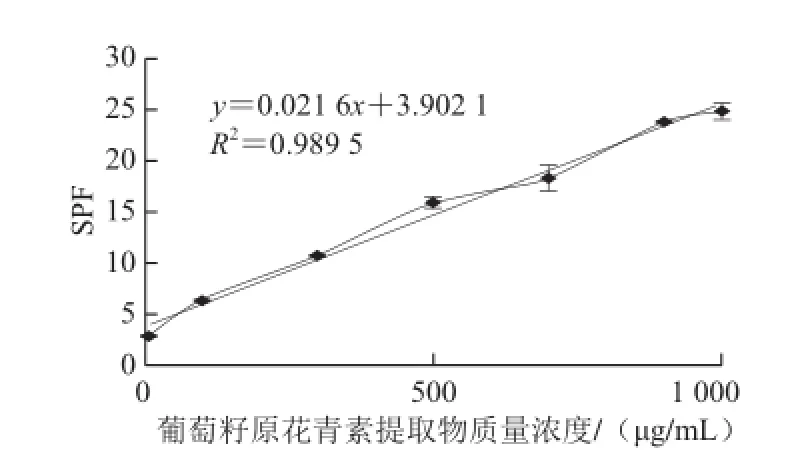
图6 葡萄籽原花青素提取物质量浓度对SPF的影响(10~1 000 μg/mL)Fig.6 Linear relationship between SPF and GSPE concentration (10-1 000 μg/mL)
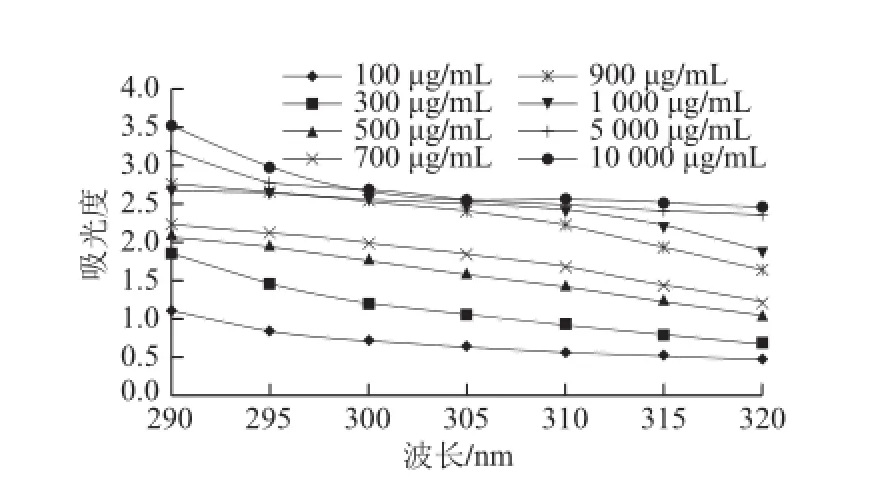
图7 100~10 000 μg/mL GSPE在的吸光度分布Fig.7 Absorbance distribution of 100-10 000 μgg//mmLL GSPE from 290 nm to 320 nm
在不同原花青素组分质量浓度下,用SPF值考察它们的紫外线吸收活性(图5)。在质量浓度较低(10~1 000 μg/mL)的情况下(图6),其质量浓度与抗紫外线活性呈现明显的线性关系,y = 0.021 6x + 3.902 1,R2=0.989 5,大于其临界相关系数,呈现显著相关性。即随着质量浓度的增加,紫外线吸收效果逐渐上升。在原花青素质量浓度为1 000~10 000 μg/mL时(图5),紫外线吸收效果的增幅大大减缓,这可能是由于随着原花青素质量浓度的增加,对紫外线的吸收作用逐渐达到饱和。另外,原花青素质量浓度为1 000~10 000 μg/mL时(图7),虽然300、305、310 nm
三点的吸光度随质量浓度变化增加不明显,但在290、295、315、320 nm波长处的吸收能力还是有较大提升,但是由于这些波长在Mansur方程中的权重系数很小,因而计算出的SPF值没有显著提高。
3 结 论
3.1 葡萄籽制备成脱脂粉后,在萃取压强1 100 psi、萃取时间14 min、萃取温度70 ℃、乙醇体积分数70%条件下采用快速溶剂萃取法提取,原花青素得率为71.62 mg/g,纯度为41.53%。
3.2 GSPE乙醇溶液质量浓度为1 000 μg/mL时,SPF达24.755 6±0.759 9,表示具有显著抗紫外线活性,在较低质量浓度10~1 000 μg/mL时,GSPE的SPF与质量浓度呈线性正相关,但是高质量浓度时SPF升高达到饱和。为葡萄籽提取物的具体抗紫外线功能提供一定定量参考信息,有利于开发其作为中高强度防晒产品防晒剂。
[1] DEY A, LAKSHMANAN J. The role of antioxidants and other agents in alleviating hyperglycemia mediated oxidative stress and injury in liver[J]. Food & Function, 2013, 4(1): 17-21.
[2] PATHAK L, AGRAWAL Y, DHIR A, et al. Natural polyphenols in the management of major depression[J]. Expert Opinion on Investigational Drugs, 2013, 22(7): 863-880.
[3] 龚晨睿, 刘睿, 王玉娥, 等. 原花青素复合制剂对辐射损伤的保护作用研究[J]. 食品科学, 2008, 29(6): 412-414.
[4] AFAQ F, KATIYAR S K. Polyphenols: skin photoprotection and inhibition of photocarcinogenesis[J]. Mini Reviews in Medicinal Chemistry, 2011, 11(14): 1200-1215.
[5] 刘玉梅, 张自强, 邓雯, 等. 葡萄籽原花青素对小鼠脑组织氧化损伤的保护作用[J]. 食品科学, 2009, 30(21): 374-376.
[6] 刘芸, 仇农学, 杨玺玉. 葡萄皮渣提取物总酚含量及体外抗氧化活性, 抑菌活性[J]. 食品科学, 2011, 32(1): 5-9.
[7] 袁小英, 刘玮, 胡益云, 等. 外用原花青素对皮肤急性光损伤日晒伤细胞及p53蛋白表达的影响[J]. 中华皮肤科杂志, 2009, 42(2): 94-96.
[8] 段玉清, 张海晖, 吴佳, 等. 莲原花青素对小鼠黑色素瘤的体内抑制作用及机制研究[J]. 食品科学, 2007, 28(4): 332-335.
[9] DENNIS L K, FREEMAN L E B, VANBEEK M J. Sunscreen use and the risk for melanoma: a quantitative review[J]. Annals of Internal Medicine, 2003, 139(12): 966-978.
[10] 高立雪, 张卫强, 喻晓毅. 防晒化妆品中的防晒剂使用频度分析[J].现代预防医学, 2011, 38(7): 1324-1325.
[11] KERR A. A survey of the availability of sunscreen filters in the UK. Clinical and experimental dermatology[J]. 2011, 36(5): 541-543.
[12] SCHEUER E, WARSHAW E. Sunscreen allergy: a review of epidemiology, clinical characteristics, and responsible allergens[J]. Dermatitis, 2006, 17(1): 3-11.
[13] 常薇. 防晒化妆品的配方及其功效评价[J]. 环境与健康杂志, 2001, 18(6): 96-97.
[14] 李敏, 骆丹. 防晒霜的应用和评价[J]. 国际皮肤性病学杂志, 2007, 33(2): 80-82.
[15] AJILA C, BRAR S, VERMA M, et al. Extraction and analysis of polyphenols: recent trends[J]. Critical Reviews in Biotechnology, 2011, 31(3): 227-249.
[16] 袁琳, 袁春龙, 胡立志, 等. 快速溶剂萃取仪提取葡萄籽中原花青素条件优化[J]. 食品科学, 2013, 34(14): 157-162.
[17] HOSSAIN M, BARRY-RYAN C, MARTIN-DIANA A B, et al. Optimisation of accelerated solvent extraction of antioxidant compounds from rosemary (Rosmarinus officinalis L.), marjoram (Origanum majorana L.) and oregano (Origanum vulgare L.) using response surface methodology[J]. Food Chemistry, 2011, 126(1): 339-346.
[18] KALE S, SONAWANE A, ANSARI A, et al. Formulation and in vitro determination of sun protection factor of Ocimum basilicum, Linn. leaf oils sunscreen cream[J]. Intenational Journal of Pharmacy and Pharmaceutical Sciences 2010, 2(4): 147-149.
[19] DE PAULA L R, PARUSSULO A L A, ARAKI K et al. Evaluation of sun protection factor of cosmetic formulations by a simple visual in vitro method mimicking the in vivo method[J]. Journal of Pharmaceutical Sciences, 2012, 101(2): 726-732.
[20] 李春阳, 许时婴, 王璋. 香草醛-盐酸法测定葡萄籽, 梗中原花青素含量的研究[J]. 食品科学, 2004, 25(2): 157-161.
[21] HIMMER W, SCHREIER P. Analysis of proanthocyanidins[J]. Molecular Nutrition & Food Research, 2008, 52(12): 1381-1398.
[22] SUN B, RICARDO-DA-SILVA J M, SPRANGER I. Critical factors of vanillin assay for catechins and proanthocyanidins[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4267-4274.
[23] MANSUR J, BREDER M, MANSUR M, et al . Determination of sun protection factor by spectrophotometry[J]. Anais Brasileiros de Dermatologia, 1986, 61(3): 121-124.
[24] SAYRE R M, AGIN P P, LEVEE G J, et al. A comparison of in vivo and in vitro testing of sunscreening formulas[J]. Photochemistry and Photobiology, 1979, 29(3): 559-566.
[25] DUTRA E A, OLIVEIRA D A G D C, KEDPR-HACKMANN E R M, et al. Determination of sun protection factor (SPF) of sunscreens by ultraviolet spectrophotometry[J]. Revista Brasileira de Ciências Farmacêuticas, 2004, 40(3): 381-385.
[26] BENDOVA HA, KRMAN J, KREJCI A. In vitro approaches to evaluation of sun protection factor[J]. Toxicology in Vitro, 2007, 21(7): 1268-1275.
[27] AKHTAR N, KHAN H M S, GELFISHAN, et al . Formulation and in vitro evaluation of a cosmetic emulsion containing apple juice extract[J]. Asian Journal of Chemistry, 2010, 22(9): 7235-7242.
[28] KAUR C D, SARAF S. Photochemoprotective activity of alcoholic extract of Camellia sinensis[J]. International Journal of Pharmacol, 2011, 7(3): 400-404.
[29] MISHRA A K, MISHRA A, CHATTOPADHYAY P. Assessment of in vitro sun protection factor of Calendula off i cinalis L. (Asteraceae) essential oil formulation[J]. Journal of Young Pharmacists, 2012, 4(1): 17-21.
Extraction and Anti-Ultraviolet Activity of Proanthocyanidins from Grape Seed
YANG Jian1, YUAN Chun-long1,2,*, REN Ya-mei3, FANG Yu-fei1, YA NG Xiao-yan1, ZHANG Shi-jie1
(1. College of Enology, Northwest A & F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-Viniclture, Yangling 712100, China; 3. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
An accelerated solvent extractor (ASE) was used to extract proanthocyanidins from defatted grape seed powder. Grape seed proanthocyanidin extracts (GSPE) were obtained under the optimal operating conditions established by one factor-at-a-time and orthogonal array design methods. We evaluated the anti-ultraviolet (UV) activity of GSPE at various concentrations in ethanol by determining sun-protection factor (SPF) by a rapid and simple method with the aim of clarifying the concentration-effect relationship. The optimal extraction conditions were found to be 14 min of extraction at 70 ℃with 70% ethanol/water mixture (V/V) at a pressure of 1 100 psi. Under these conditions, the yield and purity of GSPE were 71.62 mg/g and 41.53%, respectively. The SPF of 1 000 μg/mL proanthocyanidins in ethanol was 24.755 6 ± 0.759 9, which confirmed the anti-UV activity of GSPE. A significant positive concentration-effect relationship was found within a certain concentration range.
anti-UV activity; grape seed proanthocyanidin extracts (GSPE); ultraviolet spectrophotometry method; sunprotection factor (SPF); accelerated solvent extractor (ASE)
TS201.2
A
1002-6630(2014)18-0069-05
10.7506/spkx1002-6630-201418013
2013-10-10
;西北农林科技大学科技创新重点项目(ZD2013017)
杨健(1988—),女,硕士,研究方向为葡萄酒化学。E-mail:yangjane10@163.com
*通信作者:袁春龙(1969—),男,副教授,博士,研究方向为葡萄酒化学。E-mail:yuanchl69@nwsuaf.edu.cn

