不同亚型人SMYD3启动子转录活性比较
刘 磊,罗学刚,赵文文,穆 爱,辛中帅,张同存
(1. 工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,
天津科技大学生物工程学院,天津300457;2. 中国食品药品检定研究院,北京 100050)
不同亚型人SMYD3启动子转录活性比较
刘 磊1,罗学刚1,赵文文1,穆 爱1,辛中帅2,张同存1
(1. 工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,
天津科技大学生物工程学院,天津300457;2. 中国食品药品检定研究院,北京 100050)
利用PCR方法克隆SMYD3两个亚型的启动子区域,并构建其荧光素酶报告质粒.转染COS-7细胞后,利用荧光素酶报告分析技术,对二者启动子的转录活性进行了检测和比较.结果显示:SMYD3亚型1启动子的转录活性要显著高于亚型2启动子,生物信息学分析提示其原因可能与含有转录因子E2F-1结合位点的串联重复序列有关.
SMYD3;启动子;转录活性
SMYD3(SET and MYND domain containing 3)是近年来发现的一种具有组蛋白甲基化活性的组蛋白甲基转移酶.研究[1–2]发现,SMYD3在肝癌、乳腺癌及直肠癌中呈现过表达状态,提示其可能在肿瘤的发生和发展过程中发挥重要的作用.SMYD3可显著增强肿瘤细胞增殖、粘附及迁移能力,并促使细胞发生恶性转化,采用shRNA特异性干扰SMYD3基因后则可以明显抑制乳腺癌、宫颈癌等癌细胞的增殖与迁移能力,并诱导其凋亡[3–7].
SMYD3具有两个亚型,分别由两个不同的启动子调控二者的转录过程.然而,对于SMYD3两种不同亚型的转录调控机制及其不同启动子转录活性间的差异,迄今尚未见报道.本文通过构建SMYD3两个亚型启动子荧光素酶报告质粒,通过报告分析方法检测二者启动子转录活性差异,并结合生物信息学分析,探讨二者启动子差异在SMYD3转录调节中的影响,为进一步研究SMYD3在肿瘤发生发展中的作用机制以及新型抗肿瘤药物研发提供理论指导.
1 材料与方法
1.1 试剂与仪器
pGL3-basic荧光素酶报告质粒、T4,DNA连接酶,美国Promega公司;Taq DNA聚合酶,北京全式金生物技术有限公司;dNTP(浓度10mmol/L)、DM2000,plus DNA,Marker、DNA回收试剂盒,北京康为世纪生物科技有限公司;氨苄青霉素、青链双抗、胰酶、RNA酶、Tris饱和酚、高纯度质粒小提试剂盒、普通DNA产物纯化试剂盒,北京索莱宝科技有限公司;胎牛血清,天津康源生物科技有限公司;D-MEM/F-12细胞培养基,美国Gibco公司;胰蛋白胨、酵母抽提物,英国OXOID公司;三氯甲烷,天津市江天化工技术有限公司;SDS,美国Sigma公司;PCR引物,美国Invitrogen公司;琼脂糖凝胶,美国基因公司;荧光素酶报告基因检测系统,美国应用生物系统公司;Turbofect脂质体转染试剂盒,美国Thermo公司;限制性内切酶,美国Fermentas公司;多功能微孔板检测仪,美国基因公司;PCR仪,德国Eppendorf公司.
1.2 菌株与细胞株
E.,coli DH5α菌株,本实验室保藏;人乳腺癌细胞系MCF-7、非洲绿猴肾成纤维细胞系COS-7,购自美国模式培养物集存库(American type culture collection,ATCC).
1.3 实验方法
1.3.1 细胞培养
MCF-7及COS-7细胞用含有体积分数10%胎牛血清、体积分数1%青链双抗的D-MEM/F-12培养基于37℃、CO2体积分数5%的恒温培养箱中培养.
1.3.2 MCF-7细胞基因组的提取
用体积分数0.25%胰酶消化铺满10cm培养皿皿底的MCF-7细胞,并用冰冷的PBS缓冲液将细胞吹下,1,000r/min离心10min,收集细胞.用PBS缓冲液重悬并漂洗细胞沉淀.用5mL DNA抽提缓冲液重悬细胞,加入25µL蛋白酶K使其终质量浓度达到100,µg/mL并混匀,56℃水浴3h.加入与之等体积的Tris饱和酚抽提一次,12,000r/min离心10min收集水相,再用与水相等体积的氯仿抽提一次,12,000r/min离心10min收集水相于一个洁净的EP管中,加入与水相等体积的异丙醇和适量的3mol/L NaCl溶液,使得NaCl终浓度为0.2mol/L,于-20℃静置90min.室温下12,000r/min离心5min,弃上清液.将基因组沉淀用体积分数75%乙醇溶液漂洗两次,烘干后溶于适量TE缓冲液中.
1.3.3 人SMYD3两个亚型启动子区域荧光素酶报告质粒的构建
利用Mat Inspector对美国国立生物技术中心(NCBI)已经公布的人类SMYD3基因序列及UCSC数据库公布的SMYD3基因CDS区5′-上游序列进行序列分析,选择无转录因子结合位点区段设计两端分别带有MluⅠ和XhoⅠ的引物,SMYD3亚型1上游引物为5′-AGGACGCGTTGAGCCAATATCGTAC CAC-3′,下游引物为5′-CGACTCGAGGGTTGCGAA CTTTTCCAC-3′;SMYD3亚型2上游引物为5′-CGAA CGCGTGTTGCTTTTTGGTCTTAG-3′,下游引物为5′-CTACTCGAGCCCATCTCCCTGACTGCTAG-3′.将合成的引物稀释至工作浓度,以人乳腺癌细胞系MCF-7基因组为模板,利用聚合酶链式反应(polymerase chain reaction,PCR)在94℃变性45,s,58℃退火45,s和72℃延伸1.5min,循环30次的反应条件下分别扩增两个SMYD3亚型启动子片段,得到SMYD3亚型1转录起始位点上游839,bp至下游128,bp的启动子片段及SMYD3亚型2转录起始位点上游808,bp至下游201,bp的启动子片段.分别利用MluⅠ和XhoⅠ特异性切割PCR产物两端及pGL3-basic载体多克隆位点,切割产物经琼脂糖凝胶切胶回收后连接.连接产物转化至E.,coli DH5α菌株感受态细胞中,挑取阳性克隆经菌落PCR验证及双酶切验证将阳性克隆分别以GLP2(-)和RVP(+)为引物测序,测序结果经过与数据库公布序列进行比对验证是否将正确的目的启动子片段连接至pGL3-basic载体上.
1.3.4 细胞转染及荧光素酶报告分析
对数生长期的细胞,用体积分数0.25%胰酶消化并用适量D-MEM/F-12培养基吹悬至单细胞悬液并调整细胞浓度至5×105mL-1,每孔接种1mL细胞悬液.于37℃、CO2体积分数5%的恒温培养箱培养12~16h.利用Turbofect Transfection Regent脂质体转染试剂进行细胞转染,1,µg质粒使用2µL脂质体,37℃孵育20min,加入孔板中.加好的孔板置于37℃、CO2体积分数5%的恒温培养箱孵育6h,更换D-MEM/F-12完全培养基继续培养24h后加入Luciferase Assay裂解液,利用荧光素酶报告基因检测试剂盒及多功能微孔板检测仪测定总蛋白质量浓度及荧光强度.根据式(1)核算各实验组启动子转录活性与对照组的倍数值,其水平高低与启动子转录活性在一定范围内呈线性关系.

式中:F为相对荧光活性(RLU)倍数;Is为样品荧光强度平均值;ρs为样品蛋白质量浓度平均值;Ic为Control组荧光强度平均值;ρc为Control组蛋白质量浓度平均值.
2 结果与分析
2.1 人SMYD3两个亚型启动子区域荧光素酶报告质粒的构建
为了获得分析得到的SMYD3不同亚型启动子片段,实验中通过PCR反应,从MCF-7细胞基因组中扩增目的片段,其中亚型1启动子由于GC含量较高(54.8%),经优化后采用GC buffer可实现有效的扩增,结果如图1、图2所示.

图1 人SMYD3转录亚型1启动子荧光素酶报告质粒的构建Fig. 1 Construction of the luciferase reporter plasmid of human SMYD3 isoform promoter 1

图2 人SMYD3转录亚型2启动子荧光素酶报告质粒的构建Fig. 2 Construction of the luciferase reporter plasmid of human SMYD3 isoform promoter 2
图(a)中除M泳道外,其余泳道位于1,000,bp附近的明亮条带均为目的PCR产物.图(b)中除M泳道外,其余泳道5,000,bp附近明亮条带均为线性pGL3-basic质粒条带,1,000,bp附近的DNA条带均为目的片段条带.所有阳性克隆均经测序及序列比对,证明与已公布序列完全匹配,表明SMYD3荧光素酶报告质粒构建成功.
2.2 细胞转染
为了确保细胞转染效率,本文用可表达绿色荧光蛋白的pEGFP-C3质粒转染细胞并在蓝色激发光下观察正常表达绿色荧光蛋白的细胞数与总细胞数比对,结果如图3所示.
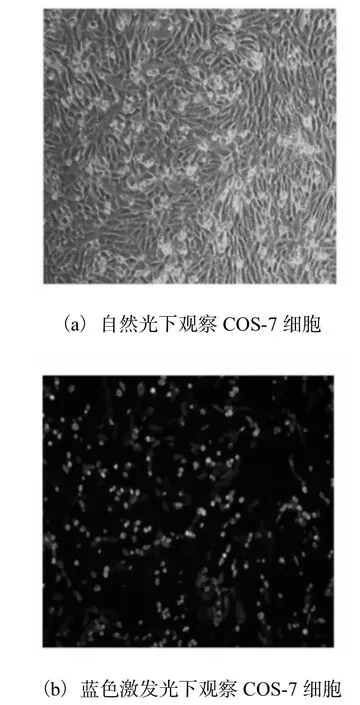
图3 细胞转染效率检测Fig. 3 Detection of the transfection efficiency
2.3 启动子转录活性分析
分别将构建成功的SMYD3亚型1、亚型2启动子荧光素酶报告基因质粒转染至COS-7和MCF-7细胞中,24h后裂解细胞测定荧光素酶活性,结果如图4所示.结果表明:SMYD3亚型1与亚型2的启动子在肿瘤细胞中的转录活性均显著高于各自在正常细胞中的转录活性,而且不论是正常细胞还是肿瘤细胞,SMYD3亚型1的转录活性均明显强于亚型2的启动子.表明SMYD3亚型1是细胞中的优势转录形式,其异常表达很可能与乳腺癌的发生发展密切相关.
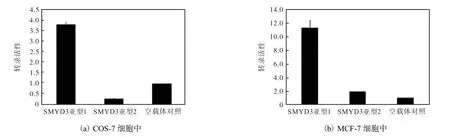
图4 人SMYD3两个亚型启动子转录活性比较Fig. 4 Comparison of the transcriptional activities of human SMYD3 promoters
2.4 人SMYD3启动子区域序列分析
根据对测序结果的分析可发现:从MCF-7乳腺癌细胞中克隆获得的人SMYD3亚型1启动子中含有2个拷贝的转录因子E2F-1结合位点(5′-CCGCC-3′),如图5(a)所示.进一步对不同物种SMYD3启动子区域进行比对,发现该位点在人、野骆驼、长尾龙猫、猕猴等不同物种中普遍存在,且序列高度保守,如图5(b)所示.表明该元件在物种进化的过程中具有较高的保守性.而对人SMYD3亚型2启动子的分析,则没有发现该结合位点,结合前人关于E2F-1结合位点串联重复多态性与肿瘤发生风险关系的报道[8],认为该结合位点的存在可能是造成SMYD3亚型1启动子转录活性强于亚型2的重要原因之一.

图5 SMYD3启动子区域分析及比对Fig. 5 Analysis and comparison of SMYD3 promotor regions
3 讨 论
谢景航等[9]也曾对SMYD3亚型2转录起始位点上游-1,527~+123,bp序列进行过分析,但他们的结果显示,各截短片段转录活性与空载质粒并无显著差异.表明该亚型SMYD3可能不是其最主要的转录形式.本研究也发现SMYD3亚型2启动子的转录活性要显著低于亚型1启动子.通过对SMYD3两个转录亚型启动子区域进行分析,发现亚型1启动子中含有2个拷贝的转录因子E2F-1结合位点(5′-CCGCC-3′),而在亚型2启动子中则没有,推测这可能是亚型1转录活性显著增高的重要原因之一.研究已显示:SMYD3 5′-调控区域的E2F-1结合位点可变数目串连重复多态性(variable number of tandem repeats polymorphism,VNTR)与肿瘤的发生过程有着密切的关系,很可能是造成癌变几率个体差异的重要原因之一.日本东京大学Tsuge等[8]发现:在SMYD3基因5′-调控区域存在E2F结合位点的串连重复序列,其拷贝数与结肠癌、肝癌以及乳腺癌的高风险性间有着紧密的联系.E2F-1属于E2F核转录因子家族成员,而E2F核转录因子家族与视网膜母细胞瘤抑癌基因RB构成的RB/E2F信号通路在细胞周期的调控及癌症发生过程中有着重要的作用[10].因此,Tsuge等认为,SMYD3很可能是RB-E2F信号转导通路中的一个下游靶点,5′-CCGCC-3′序列拷贝数增多将可能增强SMYD3与E2F-1的亲和力,从而导致结肠癌、肝细胞癌和乳腺癌风险性增加.此外,德国癌症研究中心的Frank等[11]、以及香港大学Wang等[12]的研究则与Tsuge等的有所不同,其原因很可能与患者人群的差异有关.
此外,Hamamoto等[1]通过基因芯片分析发现:SMYD3可上调细胞周期依赖激酶CDK2的表达.CDK2对于细胞周期G1/S期转换以及S期的进程具有十分重要的作用,在G1期末,CDK2将与细胞周期蛋白E结合,磷酸化RB蛋白,使其释放E2F家族转录因子,从而促使DNA合成得以进行,这一过程对细胞周期G1/S转换起着至关重要的作用.在进入S期后,CDK2又将与细胞周期蛋白A结合,调控S期的进程[13–14].结合本文的研究,认为SMYD3亚型1可能是细胞中的主要表达形式,其启动子区域E2F-1结合位点的串联重复拷贝会增强E2F-1与其结合,从而增强SMYD3亚型1的转录和表达.而SMYD3高表达后又会造成CDK2表达上调,CDK2进而促发RB的高度磷酸化,使E2F-1得以释放,E2F-1又可以再次与SMYD3 5′-调控区域结合引发后者的转录和表达.如此的正反馈循环将造成细胞周期过度活跃,细胞始终处于旺盛的增殖状态中,从而促发及推动了癌症的发展.我们将在今后的研究中进一步证实这一推论.
[1] Hamamoto R,Furukawa Y,Morita M,et al. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J]. Nature Cell Biology,2004,6:731–740.
[2] Hamamoto R,Silva F P,Tsuge M,et al. Enhanced SMYD3 expression is essential for the growth of breast cancer cells [J]. Cancer Science,2006,97(2):113–118.
[3] Wang S Z,Luo X G,Shen J,et al. Knockdown of SMYD3 by RNA interference inhibits cervical carcinoma cell growth and invasion in vitro[J]. BMB Reports, 2008,41(4):294–299.
[4] Luo X G,Ding Y,Zhou Q F,et al. SET and MYND domain-containing protein 3 decreases sensitivity to dexamethasone and stimulates cell adhesion and migration in NIH3T3 cells[J]. Journal of Bioscience and Bioengineering,2007,103(5):444–450.
[5] 罗学刚,林超,陆云华,等. SMYD3与细胞增殖相关性及其对细胞周期的影响[J]. 中国药科大学学报,2007,38(3):277–282.
[6] Luo X G,Xi T,Guo S,et al. Effects of SMYD3 overexpression on transformation,serum dependence,and apoptosis sensitivity in NIH3T3 cells[J]. IUBMB Life,2009,61(6):679–684.
[7] 王淑珍,罗学刚,丁艳,等. 可诱导的shRNAs表达系统对HeLa细胞SMYD3基因表达的抑制[J]. 中国药科大学学报,2007,38(4):369–374.
[8] Tsuge M,Hamamoto R,Silva F P,et al. A variable number of tandem repeats polymorphism in an E2F-1 binding element in the 5′ flanking region of SMYD3 is a risk factor for human cancers[J]. Nature Genetics,37(10):1104–1107.
[9] 谢景航,邹佳宁,唐聪,等. 人SMYD3基因启动子荧光素酶报告载体的构建与分析[J]. 中国药科大学学报,2009,40(2):173–177.
[10] Harbour J W,Dean D C. The Rb/E2F pathway:Expanding roles and emerging paradigms[J]. Genes & Development,2000,14(19):2393–2409.
[11] Frank B,Hemminki K,Wappenschmidt B,et al. Variable number of tandem repeats polymorphism in the SMYD3 promoter region and the risk of familial breast cancer[J]. International Journal of Cancer,2006,118(11):2917–2918.
[12] Wang X Q,Miao X,Cai Q,et al. SMYD3 tandem repeats polymorphism is not associated with the occurrence and metastasis of hepatocellular carcinoma in a Chinese population[J]. Experimental Oncology,2007,29(1):71–73.
[13] Israels E D,Israels LG. The cell cycle[J]. Stem Cells,2001,19(1):88–91.
[14] Lundberg A S,Weinberg R A. Functional inactivation of the retinoblastoma protein requires sequential modification by at least two distinct cyclin-cdk complexes[J]. Molecular and Cellular Biology,1998,18(2):753–761.
责任编辑:周建军
Comparison of Transcriptional Activities of Different Human SMYD3 Isoforms
LIU Lei1,LUO Xuegang1,ZHAO Wenwen1,MU Ai1,XIN Zhongshuai2,ZHANG Tongcun1
(1. Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2. National Institute for Food and Drug Control,Beijing 100050,China)
In this study,promoters of two isoforms were cloned with PCR method and then their luciferase reporter plasmids were constructed. Using the method of Luciferase Assay,the transcriptional activities of these two promotors of SMYD3 were detected in COS-7 cells. Results showed that the transcriptional activity of the promoter of isoform 1 is higher that that of the promoter of isoform 2. Bioinformatics analyses indicated that the significant difference in the transcriptional activity between these two promoters might be due to the tandem repeats of E2F-1 binding sites located in the promoter of isoform 1.
SMYD3;promotor;transcriptional activity
Q786
A
1672-6510(2014)04-0006-05
10.13364/j.issn.1672-6510.2014.04.002
2013–12–05;
2014–03–11
国家自然科学基金资助项目(31000343,31300642,31071126)
刘 磊(1988—),男,天津人,硕士研究生;通信作者:罗学刚,副教授,luoxuegang@tust.edu.cn.

