间隙连接蛋白43和磷脂酰肌醇3-激酶在胃癌组织中的表达及其相关性研究
程 玉,潘理会,刘海旺,李春辉
细胞间隙连接通讯 (GJIC)是由相邻细胞间通过间隙连接所介导的一种通讯方式,其通道的主要成分是间隙连接蛋白,其中间隙连接蛋白43(Cx43)是目前研究最广泛的连接蛋白[1-2]。磷脂酰肌醇 3- 激酶(PI3K)存在于细胞质的复合体,是磷脂激酶家族中的重要成员,在磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号传导通路中是始动因子,并且在蛋白激酶B(Akt)的激活过程中起着十分重要的作用。PI3K/Akt信号通路的活化可促进细胞的增殖,并促进肿瘤细胞的转移和侵袭[3-4]。本研究通过检测正常胃组织与胃癌组织中Cx43与PI3K的表达,分析胃癌组织中Cx43与PI3K的关系,以探讨细胞间信号传导与细胞内信号传导的作用,从而为探索胃癌的发生机制提供参考依据。
1 对象与方法
1.1 研究对象 选取承德医学院附属医院2012年7月—2013年2月行手术切除癌组织的胃癌患者60例,其中男48例,女12例;年龄45~77岁,平均 (58.5±10.0)岁;中~高分化者24例,低分化者36例;无淋巴结转移者25例,有淋巴结转移者35例;Ⅰ/Ⅱ期者28例,Ⅲ/Ⅳ者32例;癌组织穿透浆膜者48例,未穿透浆膜者12例。患者术前均未行放化疗治疗,术后均经病理学检查证实为胃腺癌,且相应癌旁组织均未见有癌细胞累及。
1.2 试剂与仪器 鼠抗人Cx43抗体 (福州迈新生物技术开发有限公司),兔抗人PI3K(P85α亚型)浓缩型多克隆抗体 (工作浓度均为1∶100,武汉博士德生物工程有限公司),反转录聚合酶链反应 (RT-PCR)试剂盒及DNA Marker(大连宝生物工程有限公司),PCR引物 (北京赛百盛基因技术有限公司设计合成)。Cx43基因上游引物为:5'-TCTCGCCTATGTCTCCTCCTGG-3',下游引物为:5'-AGTTAGAGATGGTGCTTCCCGC-3',扩增片段为156 bp;P85α亚型基因上游引物为:5'-TGCTATGCCTGCTCTGTAGTGGT-3',下游引物为:5'-GTGTGACATTGAGGGAGTCGTTG-3',扩增片段为175 bp;内参基因 (β-actin)上游引物为:5'-A GCGGGAAATCGTGCGTGAC-3',下游引物为:5'-ACATCTGCTGGAAGGTGGAC-3',扩增片段为453 bp。
1.3 研究方法
1.3.1 标本采集 收集手术切除的胃癌组织60份,并收集患者距癌边缘10 cm以上的正常胃组织25份。所有标本离体后立即平均分为两份,一份在离体后30 min内储存于-80℃冰箱里待用;另一分离体后立即置于10%甲醛溶液中固定,常规石蜡包埋。
1.3.2 免疫组织化学方法 标本经常规石蜡包埋后连续切片 (4 μm厚),切片以二甲苯脱蜡及系列乙醇脱水;PBS缓冲液冲洗5 min后,以3%H2O2孵育10 min(室温);PBS缓冲液冲洗6 min/次,冲洗2次后,在微波炉中进行抗原修复;加Cx43、PI3K抗体,在37℃湿盒中温育60 min后,在湿盒中4℃过夜;PBS缓冲液洗5 min/次,冲洗3次后,滴加Ⅱ抗快捷型酶标羊抗鼠/兔IgG聚合物,室温孵育15 min;PBS缓冲液冲洗5 min/次,冲洗3次后,使用二氨基联苯胺 (DAB)显色5 min;蒸馏水冲洗终止显色后,苏木素复染细胞核;封片,显微镜下观察。另外,用PBS缓冲液替代Cx43和PI3K抗体,其余染色步骤相同,制作切片作为阴性对照;用已知正常胃组织的阳性切片作为阳性对照。Cx43阳性表达染色呈黄色至棕黄色,在正常胃组织中主要表达于细胞膜,在胃癌组织中主要表达于细胞质。PI3K阳性表达染色呈黄色至棕黄色,主要表达于细胞质。在染色均匀的区域,选取5个高倍镜视野 (×400倍):(1)按阳性细胞百分率 (A值)评分:1%~25%为1分,26% ~50%为2分,>50%为3分;(2)按染色强度 (B值)评分:不着色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。两项得分相加≤2分为阴性,>2分为阳性。
1.3.3 RT-PCR 采用Triozol试剂盒分别提取胃癌及正常胃组织的RNA,分析其完整性、纯度和浓度,并作RT-PCR检测。Cx43的循环条件为:94℃预变性5 min;94℃变性30 s、58℃复性30 s、72℃延伸1 min,共循环35次;72℃延伸5 min。PI3K的循环条件为:94℃预变性5 min;94℃变性30 s、58℃复性30 s、72℃延伸1 min,共循环35次;72℃延伸5 min。β-actin的循环条件为:94℃预变性5 min;94℃变性30 s、55℃复性30 s、72℃延伸1 min,共循环30次;72℃延伸5 min。PCR扩增产物经2%琼脂糖凝胶电泳进行定性检测,相应位点出现单一电泳条带为阳性表达。以β-actin作为内参照,电泳结果用凝胶图像分析系统进行光密度测定。
1.4 观察指标 比较正常胃组织及胃癌组织中Cx43、PI3K的阳性表达率,Cx43 mRNA、PI3K mRNA的相对表达量 (通过计算Cx43 mRNA、PI3K mRNA与β-actin产物的光密度比值得出)。
1.5 统计学方法 所有数据采用SPSS 17.0统计软件进行处理,计量资料以 ()表示,采用两独立样本t检验;计数资料采用χ2检验;相关性分析采用2×2列表资料的χ2检验,并计算Pearson列联系数。以P<0.05为差异有统计学意义。
2 结果
2.1 Cx43、PI3K在胃癌组织和正常胃组织中的表达情况 Cx43在胃癌组织中的阳性表达率为33.3% (20/60),低于在正常胃组织中的阳性表达率100.0%(25/25),差异有统计学意义 (χ2=31.48,P=0.00)。PI3K在胃癌组织中的阳性表达率为86.7%(52/60),高于在正常胃组织中的阳性表达率20.0%(5/25),差异有统计学意义 (χ2=35.50,P=0.00)。Cx43、PI3K在胃癌组织和正常胃组织中的表达情况见图1~2。
2.2 不同临床病理特征患者胃癌组织Cx43、PI3K的表达情况 胃癌组织中Cx43、PI3K的表达与胃癌的分化程度、临床分期、浸润深度及淋巴结转移相关 (P<0.05)。Cx43在中~高分化胃癌组织中的阳性表达率高于低分化胃癌组织,在临床分期Ⅰ/Ⅱ期胃癌组织中的阳性表达率高于Ⅲ/Ⅳ期胃癌组织,在浸润深度穿透浆膜的胃癌组织中的阳性表达率低于未穿透浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的阳性表达率低于无淋巴结转移的胃癌组织,差异均有统计学意义 (P<0.05)。PI3K在中~高分化胃癌组织中的阳性表达率低于低分化胃癌组织,在临床分期Ⅰ/Ⅱ期胃癌组织中的阳性表达率低于Ⅲ/Ⅳ期胃癌组织,在浸润深度穿透浆膜的胃癌组织中的阳性表达率高于未穿透浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的阳性表达率高于无淋巴结转移的胃癌组织,差异均有统计学意义 (P<0.05,见表1)。
2.3 Cx43 mRNA、PI3K mRNA在胃癌组织和正常胃组织中的表达情况 胃癌组织中Cx43 mRNA的相对表达量为 (0.53±0.07),低于正常胃组织的 (0.71±0.01),差异有统计学意义 (t=12.76,P=0.00)。胃癌组织中PI3K mRNA的相对表达量为 (0.56±0.20),高于正常胃组织的 (0.31±0.26),差异有统计学意义 (t=4.79,P=0.00)。Cx43 mRNA、PI3K mRNA电泳定性检测结果见图3~4。

图1 Cx43在胃组织中的表达 (免疫组化染色,×200)Figure 1 Cx43 positive expression in gastric mucosa
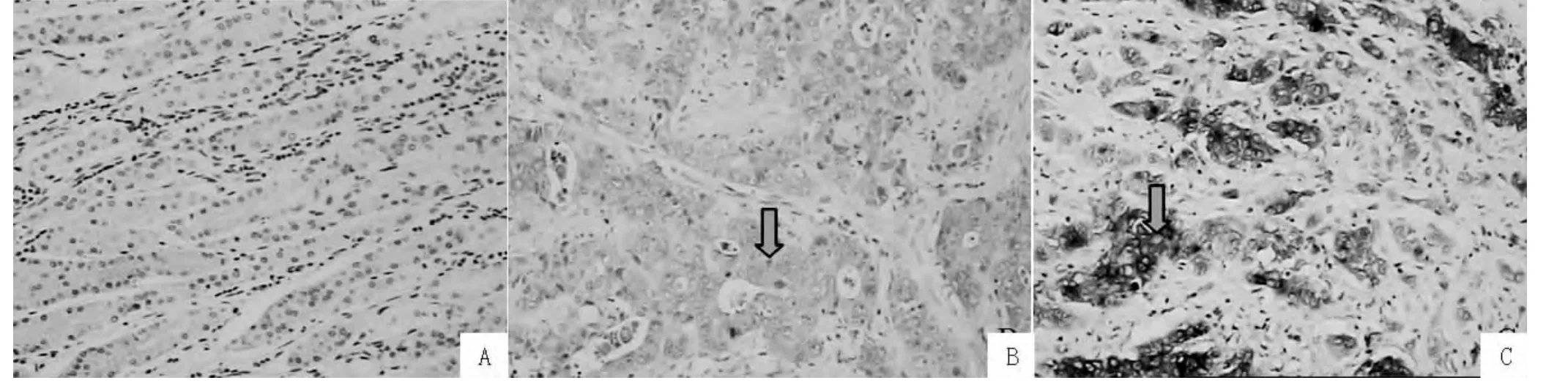
图2 PI3K在胃组织中的表达 (免疫组化染色,×200)Figure 2 PI3K positive expression in gastric mucosa
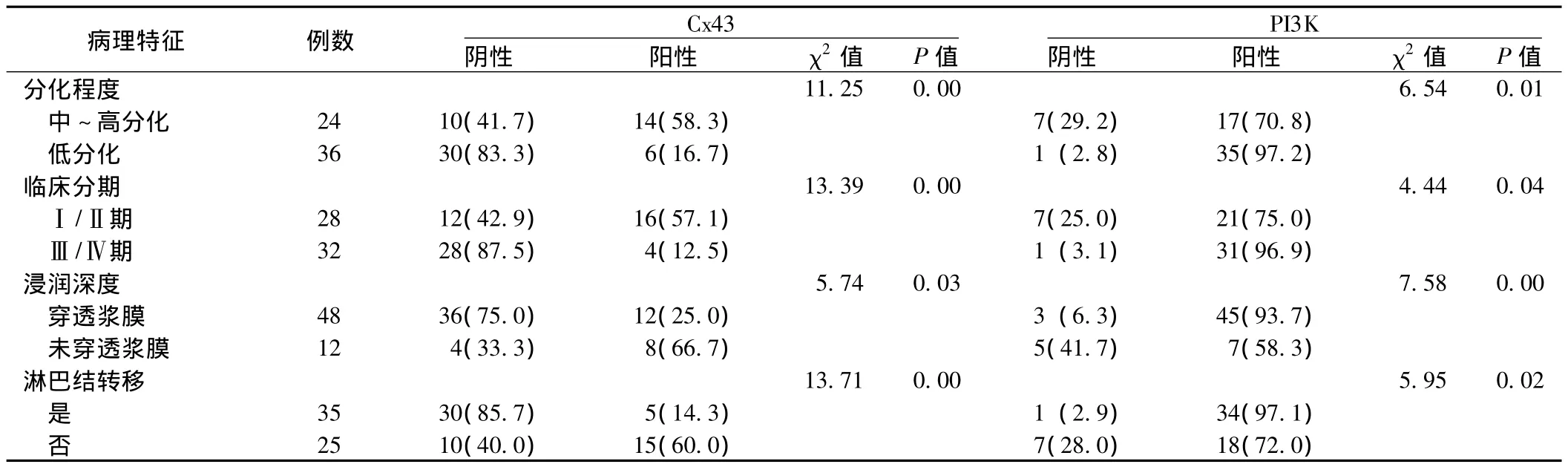
表1 不同临床病理特征患者胃癌组织Cx43、PI3K的表达情况〔n(%)〕Table 1 Cx43 and PI3K expression of gastric carcinoma in patients with diffirent clinical features
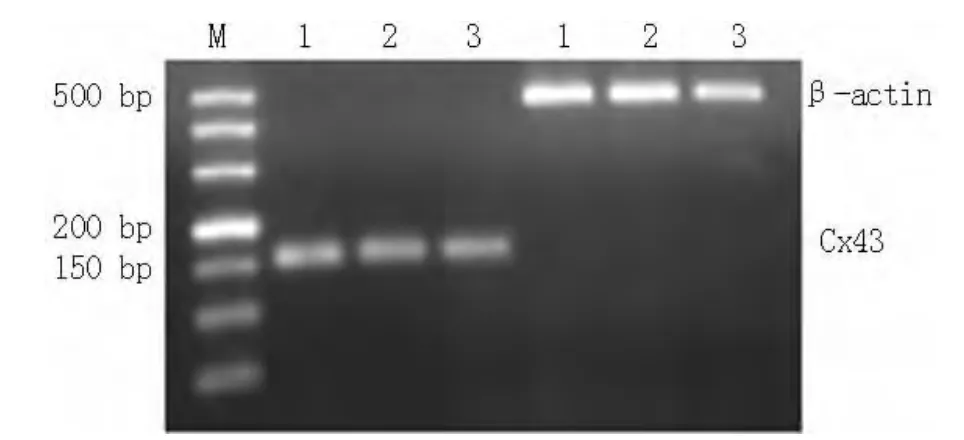
图3 Cx43 mRNA电泳图Figure 3 The electrophoresis of Cx43 mRNA

图4 PI3K mRNA电泳图Figure 4 The electrophoresis of PI3K mRNA
2.4 不同临床病理特征患者胃癌组织Cx43 mRNA、PI3K mRNA的表达情况 Cx43 mRNA、PI3K mRNA的相对表达量与胃癌的分化程度、临床分期、浸润深度及淋巴结转移相关 (P<0.05)。Cx43 mRNA在中~高分化胃癌组织中的相对表达量高于低分化胃癌组织,在临床分期Ⅰ/Ⅱ期胃癌组织中的相对表达量高于Ⅲ/Ⅳ期胃癌组织,在浸润深度穿透浆膜的胃癌组织中的相对表达量低于未穿透浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的相对表达量低于无淋巴结转移的胃癌组织,差异均有统计学意义 (P<0.05)。PI3K mRNA在中~高分化胃癌组织中的相对表达量低于低分化胃癌组织,在临床分期Ⅰ/Ⅱ期胃癌组织中的相对表达量低于Ⅲ/Ⅳ期胃癌组织,在浸润深度穿透浆膜的胃癌组织中的相对表达量高于未穿透浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的相对表达量高于无淋巴结转移的胃癌组织,差异均有统计学意义 (P<0.05,见表2)。
表2 不同临床病理特征患者胃癌组织Cx43 mRNA、PI3K mRNA的表达情况 ()Table 2 Cx43 mRNA and PI3K mRNA expression of gastric carcinoma in diffirent clinical features
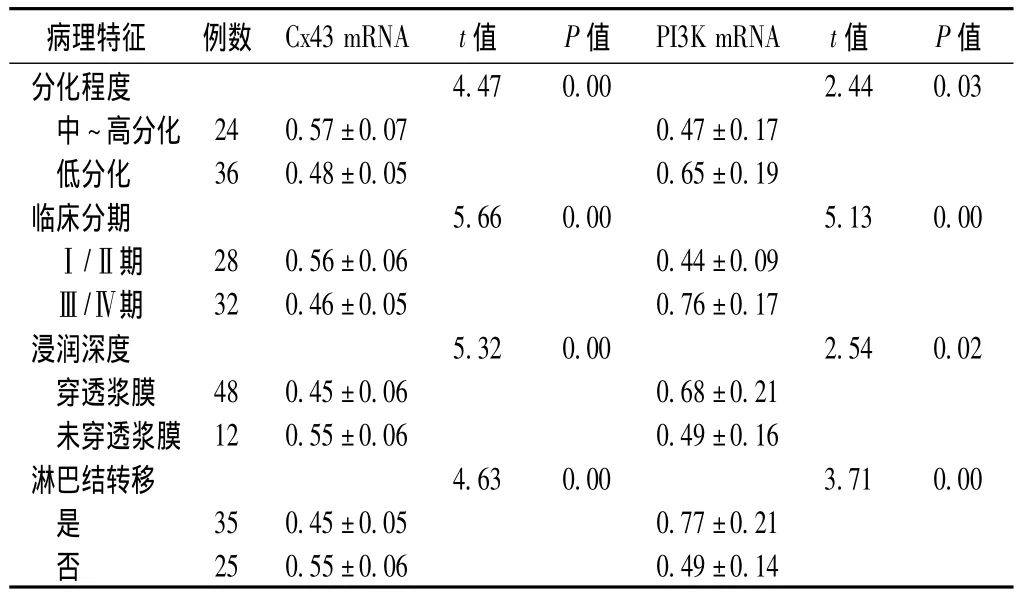
表2 不同临床病理特征患者胃癌组织Cx43 mRNA、PI3K mRNA的表达情况 ()Table 2 Cx43 mRNA and PI3K mRNA expression of gastric carcinoma in diffirent clinical features
病理特征 例数 Cx43 mRNA t值 P值 PI3K mRNA t值 P值分化程度4.47 0.00 2.44 0.03中~高分化 24 0.57±0.07 0.47±0.17低分化 36 0.48±0.05 0.65±0.19临床分期 5.66 0.00 5.13 0.00Ⅰ/Ⅱ期 28 0.56±0.06 0.44±0.09Ⅲ/Ⅳ期 32 0.46±0.05 0.76±0.17浸润深度 5.32 0.00 2.54 0.02穿透浆膜 48 0.45±0.06 0.68±0.21未穿透浆膜 12 0.55±0.06 0.49±0.16淋巴结转移 4.63 0.00 3.71 0.00是35 0.45±0.05 0.77±0.21否25 0.55±0.06 0.49±0.14
2.5 胃癌组织中Cx43与PI3K表达的相关性分析 胃癌组织中Cx43与PI3K的表达呈负相关 (P<0.05,见表3)。

表3 胃癌组织中Cx43与PI3K表达的相关性分析 (例)Table 3 Correlation between Cx43 and PI3K expression in gastric carcinoma
3 讨论
Cx43是连接蛋白家族中的重要一员,是构成胃癌组织GJIC中主要的连接蛋白[5]。其对肿瘤生长的抑制被认为是通过间隙连接 (GJ)散发一些生长抑制因子,如通过PKA(蛋白激酶A)系统参与GJ依赖的生长抑制。Tang等[6]研究发现,在胃癌细胞中与邻近的正常细胞相比,Cx43的表达显著降低;转移的淋巴结中Cx43较胃癌细胞中的Cx43表达显著升高。提示Cx43的低表达可能促进了胃癌的发生。本研究发现,胃癌组织中Cx43 mRNA的相对表达量低于正常胃组织;Cx43 mRNA在中~高分化胃癌组织中的相对表达量高于低分化胃癌组织,在临床分期Ⅰ/Ⅱ期胃癌组织中的相对表达量高于Ⅲ/Ⅳ期胃癌组织,在浸润深度穿透浆膜的胃癌组织中的相对表达量低于未穿透浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的相对表达量低于无淋巴结转移的组织。提示Cx43可能与多种致癌因素共同参与了胃癌的发生,并影响了胃癌的生物学行为;且Cx43表达水平下降和间隙连接细胞间通讯功能异常可能参与了胃癌恶性程度的进展和癌细胞的侵袭转移。
当上游信号刺激细胞膜表面时,胞膜产生的位点与PI3K结合可产生一些磷脂,激活其下游的主要靶酶Akt,活化的Akt(磷酸化Akt)可介导各种类型的细胞生长、分化以及癌细胞的侵袭和癌基因的表达[7]。本研发现,PI3K在胃癌组织中的阳性表达率 (86.7%)高于在正常胃组织中的阳性表达率 (20.0%),PI3K mRNA在胃癌组织中的相对表达量也明显高于正常胃组织。提示PI3K可能与胃癌的形成有关。本研究还发现,PI3K在胃癌中的表达与分化程度、临床分期、浸润深度及淋巴结转移均相关;PI3K mRNA在中~高分化胃癌组织中的相对表达量低于低分化胃癌组织,在临床分期Ⅰ/Ⅱ期胃癌组织中的相对表达量低于Ⅲ/Ⅳ期胃癌组织,在浸润深度穿透浆膜的胃癌组织中的相对表达量高于未穿透浆膜的胃癌组织,在有淋巴结转移的胃癌组织中的相对表达量高于无淋巴结转移的组织。表明PI3K的表达与胃癌细胞的转化过程以及癌细胞的侵袭转移有关;且其表达水平升高提示其可能成为胃癌治疗的潜在靶点。
PI3K主要由1个催化亚基P110和1个调节亚基P85 组成[8]。P85 又分为 P85α、P85β、P85γ 三种,其N末端含有1个SH3区和1个能与其他蛋白的SH3区结合的富含脯氨酸序列,其C末端含2个SH2区和1个位于2个SH2区之间可结合P110的结构区。P110除具有磷脂酰肌醇激酶活性外,还具有丝/苏氨酸 (Ser/Thr)蛋白激酶活性,可催化自身和其他接头蛋白磷酸化。有文献报道,血小板源性生长因子 (PDGF)能通过PI3K信号通路调节GJIC和Cx43的磷酸化过程,PI3K能调节PDGF诱导的蛋白激酶C(PKC)和丝裂原激活蛋白激酶途径 (MAPK途径)的过程[9]。已证实PKC途径通过使Cx43的262和368位点磷酸化,而使GJ通道通讯功能下降[10]。MAPK途径通过使 Cx43的255、279和282位点磷酸化,降低通道开放的频率来抑制其通讯作用[11]。本研究结果表明,在胃癌组织中 Cx43与PI3K的表达呈负相关。这可能是由于PI3K通过激活各种信号分子,而这些信号分子引起Cx43磷酸化,从而破坏GJIC,导致细胞间生长相互控制减弱,细胞过分克隆生长所致。这种细胞内信号传导和细胞间信号传导的相互作用可能是胃癌发生发展的机制之一。
综上所述,本研究从蛋白和基因水平证实了Cx43在胃癌组织中低表达,PI3K在胃癌组织中高表达。二者均参与了胃癌的发生、发展及浸润、转移等生物学行为。Cx43与PI3K的表达在胃癌中呈负相关,不排除与样本量较小有关,因此其具体机制还有待于进一步研究。
1 Oktem G,Bilir A,Ayla S,et al.Role of intercellular communications in breast cancer multi cellular tumor spheroids after chemotherapy [J].Oncol Res,2006,16(5):225 -233.
2 Giepmans BN.Role of connexin43-interacting proteins at gap junctions[J].Adv Cardiol,2006(42):41 -56.
3 Osaki M,Oshimura M,Ito H.PI3K-Akt pathway:its functions and alterations in human cancer[J].Apoptosis,2004,9(6):667 -676.
4 Shaw RJ,Cantley LC.Ras.PI(3)K and mTOR signalling controls tumour cell growth[J].Nature,2006,441(7092):424-430.
5 Xu CX,Jia Y,Yang WB,et al.Relationship between Helicobacter pylori infection and expression of connexin(Cx)32 and Cx43 genes in gastric cancer and gastric precancerous lesions[J].Zhonghua Yi Xue Za Zhi,2008,88(22):1523 -1527.
6 Tang B,Peng ZH,Yu PW,et al.Expression and significance of Cx43 and E-cadherin in gastric cancer and metastatic lymph nodes[J].Med Oncol,2011,28(2):502 -508.
7 Abrahamsen H,Stenmark H,Platta HW.Ubiquitination and phosphorylation of Beclin1 and its binding partners:tuning class Ⅲ phosphatidylinositol 3 -kinase acticity and tumor suppression [J].FEBS Lett,2012,586(11):1584-1591.
8 Vogt PK,Hart JR,Gymnopoulos M,et al.Phosphatidylinositol3-kinase:the oncoprotein [J].Curr Top Microbiol Immunol,2010(347):79-104.
9 Yao J,Morioka T,Oite T.PDGF regulates gap junction communication and connexin43 phosphorylation by PI3-Kinase in mesangial cells[J].Kidney International,2000,57(5):1915 -1926.
10 Solan JL,Lampe PD.Connexin43 in LA-25 cells with active v-src is phosphorylated on Y247,Y265,S262,S279/282,and S368 via multiple signaling pathways [J].Cell Commun Adhes,2008,15(1):75-84.
11 Sáez JC,Nairn AC,Czernik AJ,et al.Phosphorylation of connexin43 and the regulation of neonatal rat cardiac myocyte gap junctions[J].J Mol Cell Cardiol,1997,29(8):2131 -2145.

