响应面法优化金针菇废弃菌根的蛋白提取工艺研究
张 乐,周林燕,宋洪波,李 鹏,李亚茹,曹珍珍,魏 明,李淑荣,*
(1.中国农业科学院农产品加工研究所/农业部农产品加工综合性重点实验室,北京100193;2.福建农林大学食品科学学院,福建福州350002)
响应面法优化金针菇废弃菌根的蛋白提取工艺研究
张 乐1,2,周林燕1,宋洪波2,李 鹏2,李亚茹1,曹珍珍1,魏 明1,2,李淑荣1,*
(1.中国农业科学院农产品加工研究所/农业部农产品加工综合性重点实验室,北京100193;2.福建农林大学食品科学学院,福建福州350002)
以废弃的金针菇菌根为原料,将其制备成颗粒度为100目的粉末,以0.14mol/L NaCl溶液为提取液,采用2次提取的方法提取蛋白;在单因素实验的基础上,确定具有显著影响的料液比、提取温度、时间、pH为自变量,菌根蛋白提取率为响应值,利用Box-Behnken实验设计方案和响应面分析法,建立总蛋白提取率的二次回归模型,确定了影响提取率的因素依次为料液比>pH>时间>温度。优化得到的最佳提取条件为:料液比1∶16g/mL、温度30℃、时间30min、pH10,在此条件下蛋白提取率预测值为64.75%,验证实验中蛋白的得率为64.91%,相对偏差0.25%。
金针菇,蛋白,提取,响应面法
金针菇学名毛柄金钱菌(Flammulina velutipes),又名枸菇、冬菇、朴菇等。金针菇具有丰富的营养成分,其精氨酸和赖氨酸等人体必需氨基酸的含量高于其他菇类,能有效增进幼儿身高、体重和智力的发育,因此金针菇被誉为“增智菇”[1-3]。金针菇中还含有多糖、火菇素、倍半萜、免疫调节蛋白、核糖体失活蛋白等多种生物活性物质,这些活性成分具有很高的药用价值,具有抑制过敏反应、抗氧化、抗疲劳、提高记忆力、减缓细胞衰老、延年益寿等功效[4-6]。
我国是食用菌生产大国,位居世界之首,占全球总产量的70%以上。随着人们对食用菌消费量的提高,金针菇的产销量逐年上升[7]。金针菇在采收和加工过程中,产生大量的菌柄、菌盖、畸形菇、劣质菇等下脚料,目前少数以低价进入市场或烤制成干菇,多数未经处理而直接丢弃,而靠于基部的菌根由于其杂质多、口感差被切下来直接被当作垃圾扔掉,但这些下脚料中仍然含有大量的蛋白质、纤维素等营养成分和活性成分。学者们的研究表明,金针菇菌根和上面部分子实体的主要营养成分种类相似,并且菌根中的蛋白质含量为18%~25%,含量较高[8-9]。本论文以金针菇接近培养基部分的废弃菌根为原料,研究影响菌根蛋白浸提率的因素,并利用响应面分析法进行提取工艺优化,获得最佳工艺参数。通过本研究能有效提高金针菇副产物和下脚料的价值,减少其对环境的污染,有效增加农户的经济效益。
1 材料与方法
1.1 材料与仪器
金针菇 北京市天秀路菜市场;NaCl、NaOH、盐酸等 国药化学试剂有限公司,分析纯;牛血清蛋白、考马斯亮蓝G-250 美国Sigma公司。
DHP-9140A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;SL-100型高速多功能粉碎机 浙江省永康市松青五金厂;pB-10 sartorius普及型pH计 美国赛多利斯科学仪器(北京)有限公司;HH-4数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;GL-20G-Ⅱ型高速冷冻离心机 上海安亭科学仪器厂;全自动凯氏定氮仪 丹麦FOSS公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 金针菇菌根粉末的制备 将金针菇清理去杂后把上部子实体和菌根切分,菌根放入电热鼓风干燥箱50℃烘至恒重,万能粉碎机粉碎,贮于干燥器备用。经测定此菌根粉水分含量为6.5%。
1.2.2 金针菇菌根蛋白的提取 称取已制备好的金针菇菌根粉,按一定的液料比加入提取剂,在一定温度和pH下水浴提取一定时间后,8000r/min离心20min,取上清液,考马斯亮蓝法测蛋白含量。
1.2.3 牛血清白蛋白标准曲线的绘制 准确称取10mg牛血清白蛋白,溶于蒸馏水并定容至100mL,配制成100μg/mL的牛血清白蛋白标准溶液,分别取出0、0.2、0.4、0.6、0.8、1.0mL于6支具塞试管,分别加水补足到1mL,然后各加入5mL考马斯亮蓝G-250蛋白试剂盖上塞子,摇匀,室温静置2min后在595nm波长下比色测定。以牛血清白蛋白含量(μg)为横坐标,以吸光度为纵坐标,绘出标准曲线,得回归方程Y= 0.0063X+0.0055,相关系数R2=0.9973。
1.2.4 指标的测定 菌根蛋白提取率的计算:蛋白提取率(%)=(上清液中蛋白质量/菌根粉中总蛋白质量)×100;菌根粉总蛋白测定采用凯氏定氮法(GB/T 15673-2009);提取液蛋白的测定采用考马斯亮蓝G-250法[10-11]。水分含量测定采用直接干燥法(GB5009.3-2010)。
1.2.5 单因素实验设计
1.2.5.1 提取剂对菌根蛋白提取率的影响 取粉末样品按料液比1∶15(g/mL)加入三角瓶中,提取试剂分别为蒸馏水、0.14mol/L NaCl溶液和0.01mol/L pH7.4磷酸盐缓冲液(PBS),35℃水浴1h。比较水提法、盐提法、缓冲液提取法对菌根蛋白提取效果的影响。
1.2.5.2 颗粒度对菌根蛋白提取率的影响 取颗粒度分别为40、60、80、100、120、150目金针菇菌根粉末,以料液比1∶15g/mL,0.14mol/L NaCl为提取液,调pH10,置于40℃水浴,提取60min。
1.2.5.3 料液比对菌根蛋白提取率的影响 取颗粒度100目的金针菇菌根粉末,0.14mol/L NaCl为提取液,调pH10,水浴温度40℃,提取时间60min的条件下,研究1∶5、1∶10、1∶15、1∶20、1∶25g/mL等料液比对菌根蛋白提取率的影响。
1.2.5.4 提取温度对菌根蛋白提取率的影响 取颗粒度100目的金针菇菌根粉末,料液比1∶15(g/mL),0.14mol/L NaCl溶液为提取液,调pH10,分别置于冰箱(4℃),室温(20℃),30、40、50℃水浴条件下,提取60min。
1.2.5.5 提取时间对菌根蛋白提取率的影响 取颗粒度100目的金针菇菌根粉末,料液比1∶15g/mL,0.14mol/L NaCl溶液为提取液,调pH10,分别在40℃水浴中提取0、10、20、30、40、50、60、90min。
1.2.5.6 pH对菌根蛋白提取率的影响 取颗粒度100目的金针菇菌根粉末,料液比1∶15(g/mL),0.14mol/L NaCl溶液为提取液,40℃水浴中提取60min条件下,pH分别调为8、9、10、11、12。
1.2.5.7 提取次数对菌根蛋白提取率的影响 一次浸提并不能将菌根中的蛋白完全提取出,将第1次浸提后的残渣继续进行蛋白提取,提取条件和第1次浸提的相同,以此类推进行第2次、第3次、第4次所得滤液合并,分别测定其蛋白含量。
1.2.6 响应面实验设计 在单因素实验基础上,确定样品颗粒度100目为实验材料,以稀盐(0.14mol/L NaCl溶液)为提取液,提取次数为2次,在此条件下选择有显著影响的料液比、提取温度、时间、pH为自变量,菌根蛋白提取率为响应值(Y),采用Box-Behnken的中心组合实验设计原理,采用四因素三水平的响应面分析法[12],建立菌根蛋白质提取率的二次多项式数学模型。自变量因素及编码水平见表1。
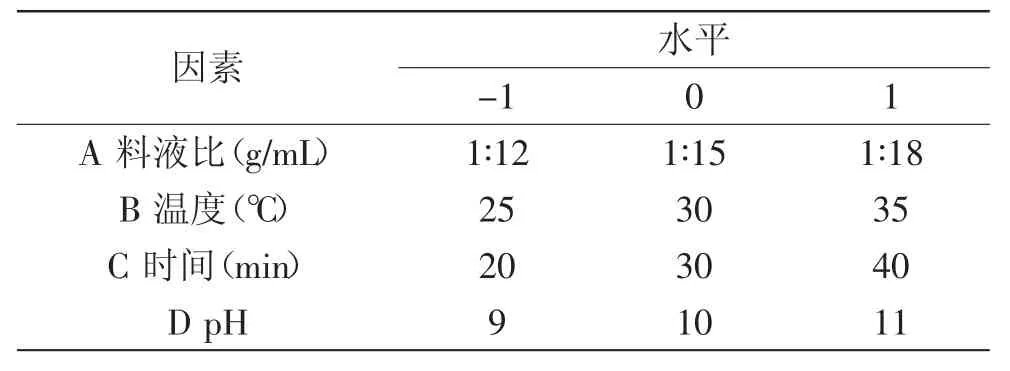
表1 实验因素水平及编码Table.1 Variables and experimental design levels for response surface
1.3 数据分析
采用Origin8.0数据处理软件和Design-Expert. 8.05b软件进行数据分析处理和绘图。
2 结果与分析
2.1 菌根蛋白提取率影响因素的研究
2.1.1 提取剂对菌根蛋白提取率的影响 水提法、盐提法、缓冲液提取法对菌丝体蛋白提取效果的影响实验结果见图1。分析图1可以看出,稀盐(0.14mol/L NaCl溶液)的提取效果最好,缓冲液次之,直接水提法的提取率最低。数据分析结果表明,三种试剂的提取效果的差异极显著(p<0.01)。原因在于稀浓度盐可促进蛋白质盐溶,并且盐离子与蛋白质部分结合,能够保护蛋白质不易变性。因此,选择稀盐(0.14mol/L NaCl溶液)为提取试剂。
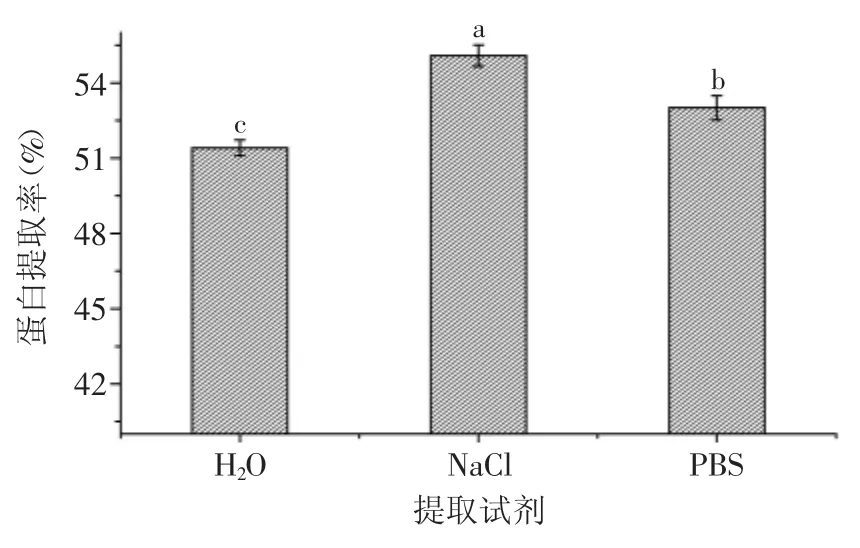
图1 提取试剂对蛋白质提取率的影响Fig.1 Effect of extraction reagent on extraction rate of protein
2.1.2 颗粒度对菌根蛋白提取率的影响 不同颗粒度对菌根蛋白提取率影响的实验结果见图2。由图2可以看出,随着粉碎度的增加,蛋白提取率明显增加;当粉碎度大于100目后,增长趋势平缓。可见,粉碎处理会破坏金针菇的细胞壁,有利于细胞内有效成分的提取。但是,100、120、150目之间的蛋白提取率无显著差异(p>0.05),考虑到粉碎过细会造成产品的提取率提高不明显,因此,选择100目为适宜的颗粒度。
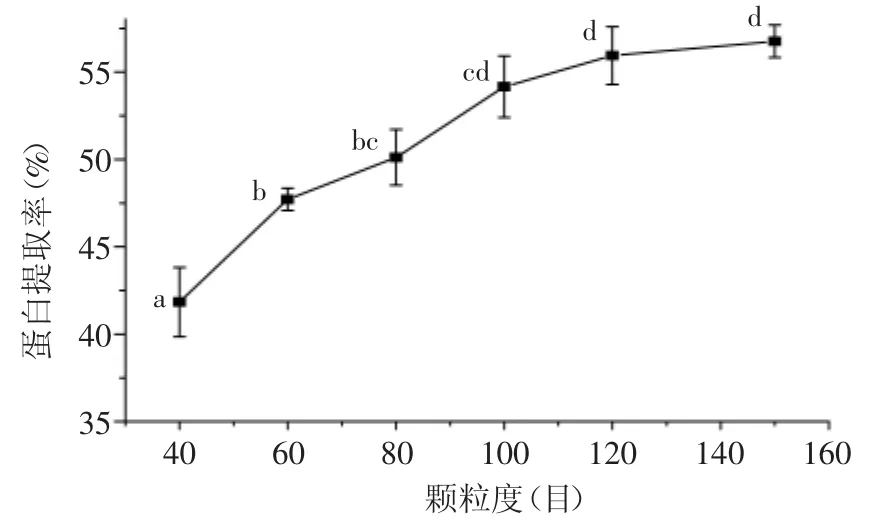
图2 颗粒度对菌根蛋白提取率的影响Fig.2 Effect of degree of grinding on extraction rate of protein
2.1.3 料液比对菌根蛋白提取率的影响 不同料液比对蛋白提取率的影响实验结果见图3。分析图3可以看出,随着料液比的增加,蛋白的提取率增加,但料液比达1∶15以后提取率增幅较小,各处理间无显著差异(p>0.05)。较低的物料浓度有助于质量扩散作用的增强,但液料比过大会造成溶剂和能源的浪费,且会给浓缩过程带来负担[13]。因此,选择料液比1∶15进行下一步实验。
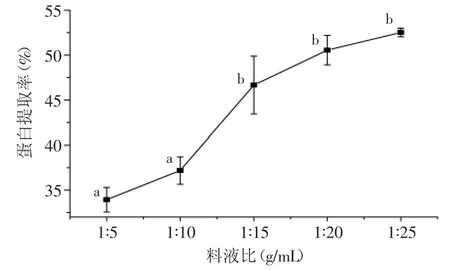
图3 料液比对蛋白提取率的影响Fig.3 Effect of solid-liquid ratio on extraction rate of protein
2.1.4 提取温度对菌根蛋白提取率的影响 不同提取温度对蛋白提取率的影响实验结果见图4。分析图4可以看出,菌根蛋白的提取率随着提取温度的升高而增大,在30℃时达到最大;此后,随温度上升提取率反而下降。在提取温度升高过程中,分子之间热运动加剧,促使提取过程中传质速率上升,提取速率加快;但温度过高,可能引起蛋白质的聚集和沉淀,使其溶解度下降,从而降低了蛋白提取率[14]。
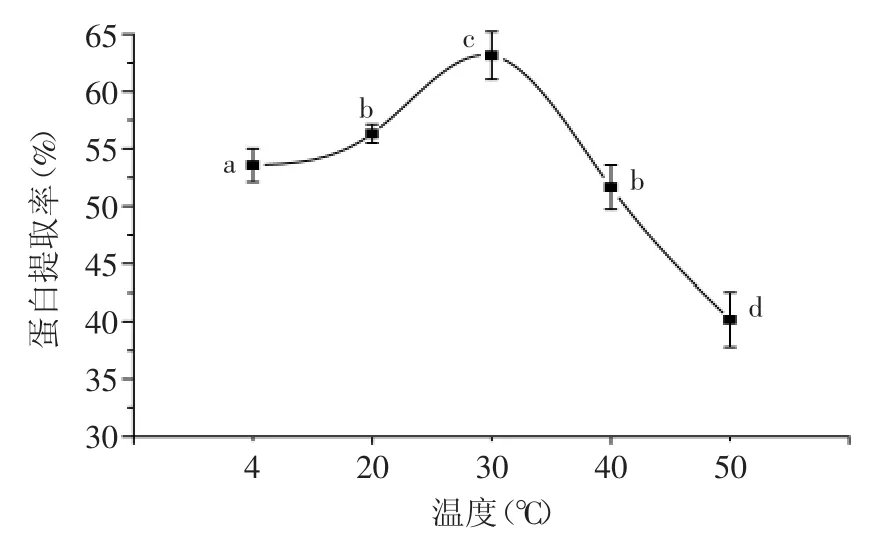
图4 提取温度对蛋白质提取率的影响Fig.4 Effect of extraction temperature on the Protein extraction rate
2.1.5 提取时间对菌根蛋白提取率的影响 不同提取时间对蛋白提取率的影响实验结果见图5。分析图5可以看出,随着提取时间的延长,蛋白提取率逐渐增大,在30min时提取率达最大,此后延长时间提取率呈下降趋势,可能是因随时间延长导致蛋白变性,使提取率呈下降趋势[15]。
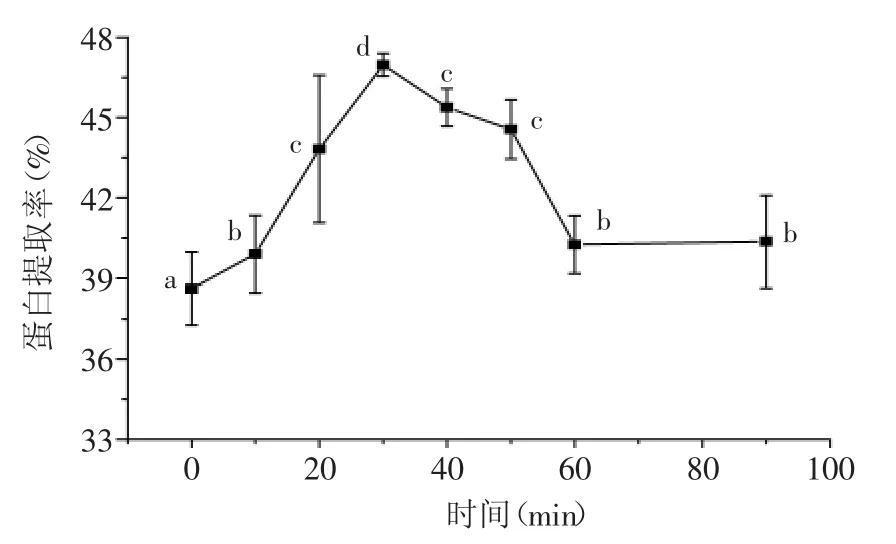
图5 提取时间对蛋白质提取率的影响Fig.5 Effect of extraction time on the Protein extraction rate
2.1.6 pH对菌根蛋白提取率的影响 不同pH对蛋白提取率的影响实验结果见图6。分析图6可以看出,随着提取液pH的升高,蛋白质提取率增大,当pH8~10之间蛋白质提取率明显增加(p<0.05);当pH大于10后蛋白质提取率增加缓慢,各处理间无显著差异(p>0.05)。随着pH的增加,蛋白质-水相互作用增强,溶解性提高。研究表明,过强的碱性会引起脱氨、脱羧、肽键断裂,引起胱赖反应,将氨基酸转变为有毒化合物,同时氨基酸之间有可能发生缩合反应产生异味[16]。
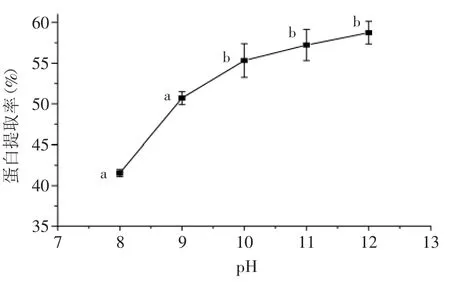
图6 提取液pH对蛋白质提取率的影响Fig.6 Effect of extracting solution pH value on Protein extraction rate
2.1.7 提取次数对菌根蛋白提取率的影响 不同提取次数对菌根蛋白的影响实验结果如图7所示。由图7可知,二次提取后蛋白提取率明显大于第1次(p<0.05),且第2、3、4次之间没有显著性差异(p>0.05)。这可能与菌根中水溶性蛋白在二次提取后基本浸出,提取剂蛋白质浓度处于平衡有关,故选择提取次数为2次。
2.2 响应面实验设计分析及提取工艺的优化
2.2.1 二次回归方程数学模型的建立 固定0.14mol/L NaCl溶液为提取剂、颗粒度100目、提取次数为2次。以有显著影响的料液比、提取温度、时间、pH为自变量,菌根蛋白提取率为响应值(Y),响应曲面实验设计和实验结果见表2。
采用Design Expert 8.05数据分析软件对表中的实验结果进行回归分析,得到金针菇蛋白提取率与料液比(A)、提取温度(B)、提取时间(C)和pH(D)4个因素的数学回归模型如下:
Y=63.96+4.03A+0.032B-0.041C+0.52D+0.67AB+ 0.32AC+1.58AD+3.60BC-1.32BD-2.20CD-5.58A2-4.64B2-6.11C2-4.63D2。对此回归模型进行方差分析,结果如表3所示。
由表3可知,该模型的F=11.54,p<0.0001,表明回归模型极显著;失拟项的F值为0.17,说明失拟项相对于误差项来讲不显著;决定系数R2为0.9203,说明该模型的拟合性较好,可以用此模型对蛋白的提取率进行分析和预测。
2.2.2 交互作用分析 由表3还可以看出,A、BC、A2、 B2、C2、D2对蛋白质提取率影响显著。由F检验可以得到因子贡献率为:A>D>C>B,即:料液比>pH>时间>温度。
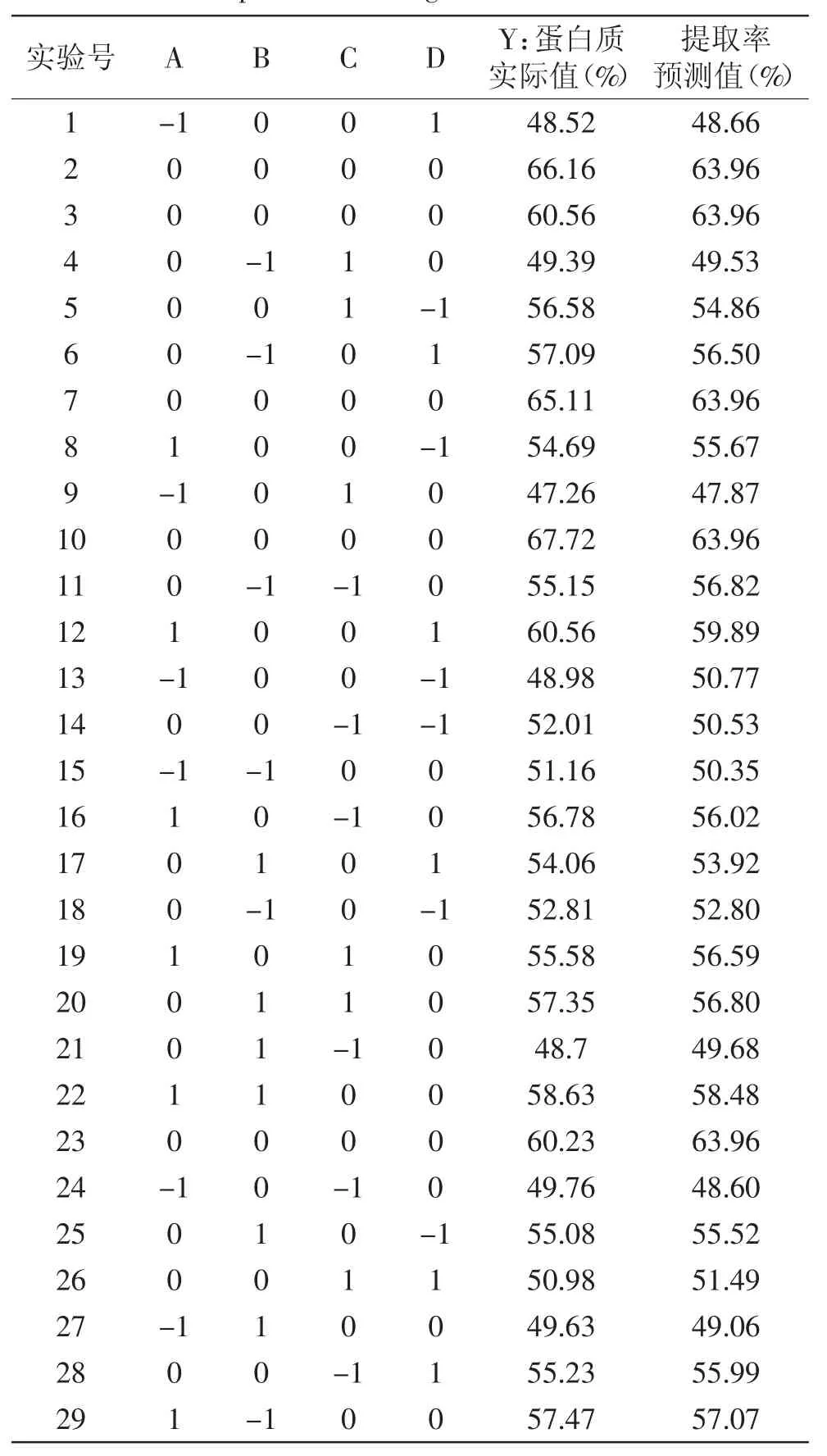
表2 响应曲面实验设计及结果Table.2 Experimental designs and extraction results
方差分析结果表明,AB、AC、AD、BD、CD无明显的交互作用,BC的交互作用显著,即温度和时间之间的交互作用对蛋白提取率有显著影响,其交互作用响应曲面如图8所示。
从图8可以看出,当提取时间一定时,提取温度在25℃至35℃之间,蛋白的提取率先是显著增大,达到最大值后又开始慢慢减小;当提取温度一定时,提取时间在20min至40min之间,蛋白提取率先是渐渐增大,达到最大之后又开始慢慢减小。
2.2.3 回归模型验证 由Design-Expert.8.05b分析软件对实验模型进行典型性分析结果表明,提取蛋白的最佳条件为料液比1∶16.14、温度30.04℃、时间29.87min、pH10.12,蛋白提取率的理论值为64.75%。考虑到实际操作,将蛋白提取条件修正为料液比1∶16、温度30℃、时间30min、pH10,实测提取率为64.91%,相对偏差0.25%,可见该模型能较好地反映蛋白质提取条件。
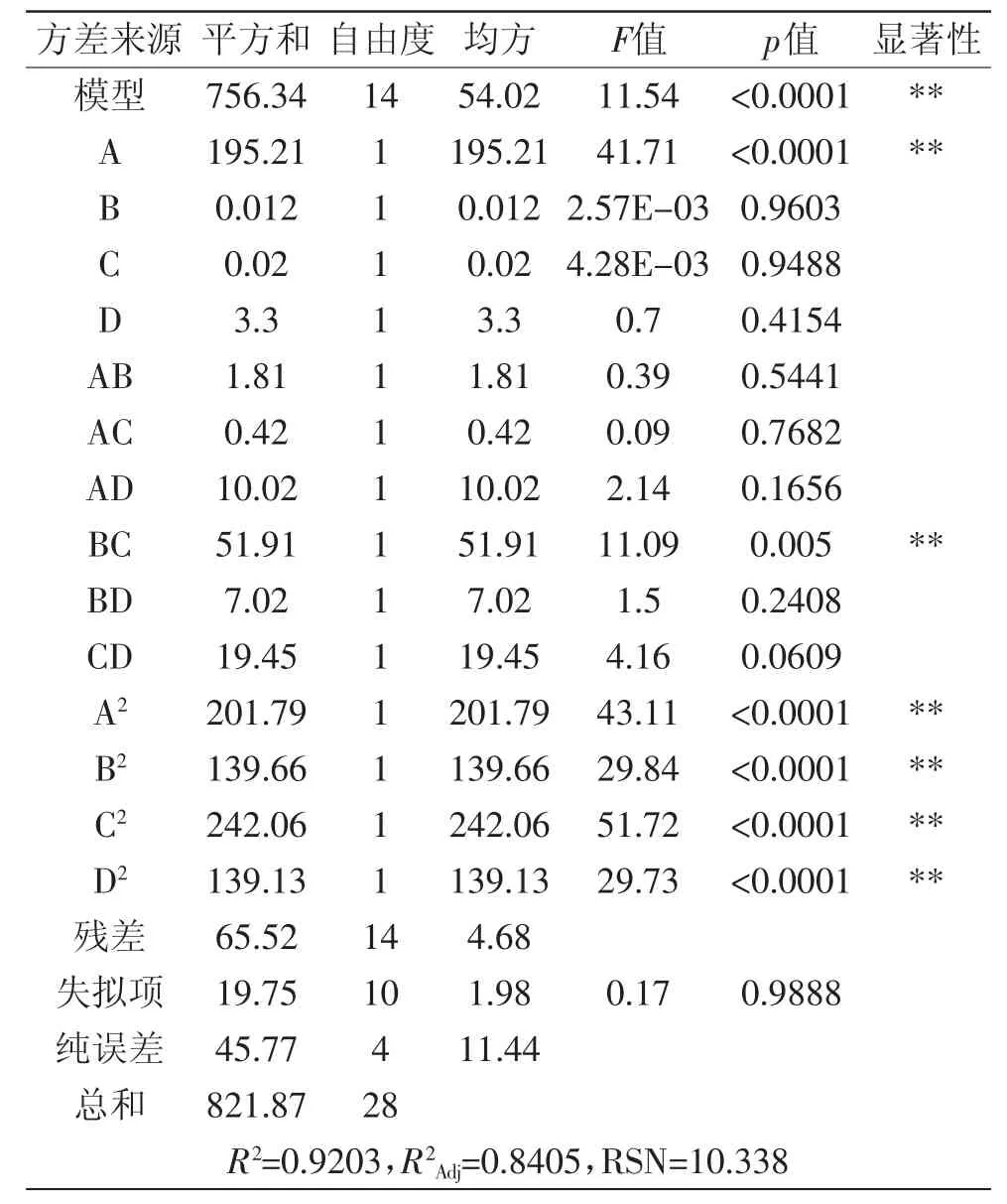
表3 回归模型的方差分析Table.3 ANOVA for response surface quadratic model
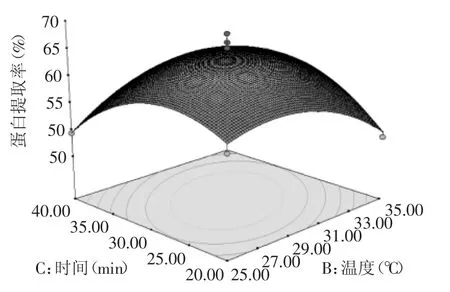
图8 提取温度和时间交互影响蛋白质提取率的曲面图Fig.8 Response surface plot of the effect of operating temperature and time and their mutual interactions on the extraction rate of protein
3 结论
本实验对影响金针菇菌根蛋白提取的因素:提取试剂、颗粒度、料液比、提取温度、时间、pH、提取次数进行了研究,在此基础上选择有显著影响的四个因素,利用Box-Behnken实验设计方案和响应面分析建立了回归方程。由F检验得到因子贡献率为料液比>pH>时间>温度。利用优化模型得到最佳提取条件为:料液比1∶16g/mL、温度30℃、时间30min、pH10,实际提取率可达为64.91%,与理论值64.75%相对偏差为0.25%,证实了该模型的可行性,为金针菇菌根蛋白的提取提供了理论依据。
金针菇废弃菌根具有很大的开发潜力,国内外学者对金针菇功能成分提取的研究主要集中在子实体上。因此,为了充分开发利用金针菇废弃菌根,有效提高金针菇副产物和下脚料的价值仍需加大科研力度,完善蛋白提取分离基本理论和方法,满足工业产业化生产的要求。
[1]蔡和晖,廖森泰,叶运寿,等.金针菇的化学成分生物活性及加工研究进展[J].食品研究与开发,2008,29(11):171-175.
[2]魏华,谢俊杰.金针菇营养保健作用[J].天然产物研究与开发,1997,9(2):92-97.
[3]于荣利,秦旭升,宋凤菊.金针菇研究概况[J].食用菌学报,2004,11(4):63-68.
[4]孔祥辉,孙宇峰,任永春,等.金针菇免疫调节蛋白的研发与应用[J].生物技术,2006,16(4):85-88.
[5]金湘,娄恺.金针菇生物活性物质结构与功能的研究进展[J].中草药,2007,38(10):1596-1598.
[6]孙正祥,王瑞霞.食用菌中生物活性蛋白的研究进展[J].食用菌学报,2009,16(2):85-90.
[7]傅俊毅.金坛市金针菇生产现状及发展对策[J].扬州大学学报,2009,17(4):34-35.
[8]王丽威,郭旭颖,陈梁成,等.水浴法和微波法提取金针菇下脚料多糖的优化及比较研究[J].食品工业科技,2012,33(8):322-325.
[9]Yang W,Fang Y,Liang J,et al.Optimization of ultrasonic extraction of Flammulina velutipes polysaccharides and evaluation of its acetylcholinesterase inhibitory activity[J].Food Research International,2011,44(5),1269-1275.
[10]陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:895-897.
[11]Bhattacharjee R,Sil P C.Protein isolate from the herb,Phyllanthus niruriL(Euphorbiaceae),plays hepatoprotective role againstcarbon tetrachlorideinduced liverdamageviaits antioxidant properties[J].Food and Chemical Toxicology,2007,45(5):817-826.
[12]王成恩,黄章俊.基于高斯函数和信赖域更新策略的Kriging响应面法[J].计算机集成制造系统,2011,17(4):740-746.
[13]Shen LQ,WangXY,WangY,et al.Studies on tea Protein extraetion using alkaline Andenzyme methods[J].FoodChemistry,2008,107(2):929-938.
[14]冯磊,麻成金,黄群,等.二次通用旋转组合设计法优化酶法提取茶叶籽蛋白工艺[J].食品工业科技,2012,33(17):215-219.
[15]Jebrail MJ,Wheeler AR.Digital microfluidic method for protein extraction by precipitation[J].AnalyticalChemistry,2009,81(1):330-335.
[16]邵佩兰,徐明.提取大豆分离蛋白的工艺研究[J].粮油加工与食品机械,2005(9):47-51.
Optimization of extraction of protein from base of Flammulina velutipes using response surface methodology
ZHANG Le1,2,ZHOU Lin-yan1,SONG Hong-bo2,LI-Peng2,LI Ya-ru1,CAO Zhen-zhen1,WEI-Ming1,2,LI Shu-rong1,*
(1.Key Laboratory of Agro-product Processing and Quality Control/Institute of Agro-Products Processing Science and Technology,Chinese Academy of Agricultural Sciences,Beijing 100193,China;2.College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
In this study,extraction of proteins from base of Flammulina velutipes was investigated.Materials were crushed into 100 mesh powders,and 0.14mol/L NaCl buffer was used to extract for twice.Based on single factor experiments,solid-liquid ratio,extraction temperature,extraction time,and extraction pH were optimized using Box-Behnken design and response surface methodology for achieving maximum extraction rate of proteins.Factor contribution rate obtained from the F-test were as follows:solid-liquid ratio>extraction pH>extraction time>extraction temperature.The optimum extraction parameters obtained from response surface analysis were as follows:solid-liquid ratio 1∶16g/mL,extraction temperature 30℃,extraction time 30min,and extraction pH10.Under the optimized conditions,the predicated extraction rate of proteins was 64.75%,meanwhile the rate of proteins was 64.91%in the validated experiment with the relative deviation value of 0.25%.
Flammulina velutipes;protein;extraction;the response surface methodology
TS201.1
B
1002-0306(2014)06-0221-05
2013-08-02 *通讯联系人
张乐(1987-),女,硕士研究生,研究方向:食品加工理论与应用。
公益性行业(农业)科研专项(201303080)。

