蛋白溶解性分析法研究大米焙炒过程中蛋白质热变性行为
陈建新,徐 岩
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122;3.江南大学生物工程学院,江苏无锡214122)
蛋白溶解性分析法研究大米焙炒过程中蛋白质热变性行为
陈建新1,2,徐岩1,3,*
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122;3.江南大学生物工程学院,江苏无锡214122)
考察了焙炒过程中大米蛋白质的热变性行为,通过大米蛋白在不同功能溶剂中的溶解度变化了解大米蛋白质在焙炒过程中次级结构的变化及热变性信息。发现热变性主要发生在焙炒的前期,热变性包括蛋白质次级结构的变化和更高能级的化学变化。与传统蒸煮方法相比,焙炒大米的蛋白质热变性程度较低。粳米和糯米中的蛋白质热变性行为基本相似,选用不同的加热介质对大米蛋白的热变性没有影响。
焙炒,蛋白提取,大米,热变性,蛋白溶解性
黄酒酿造时,需要将大米中的淀粉糊化和糖化最终变成葡萄糖。传统的大米糊化方法是先浸泡后蒸饭。为了节能和减污,空气或过热蒸汽焙炒被用于大米的糊化[1-5]。在大米热加工过程中,大米中的蛋白质也同时发生了热变性。热变性蛋白更易水解成黄酒中的营养和风味成分。
蛋白质变性实际上是它的立体构象由于外界因素的作用发生了改变,这种变化并没有破坏蛋白质的一级结构,而是蛋白质的二级、三级或四级结构变化的结果。通常由于蛋白质构象改变后,一些活跃的基团会暴露,引起蛋白分子间的相互作用形成凝胶等,蛋白质变性会造成蛋白质性质的改变,包括物理和化学性质[6]。常用蛋白质热变性研究的手段主要包括结构分析和热力学分析,其中,结构分析的方法有X射线衍射法、圆二色谱法、荧光光谱法和傅立叶红外光谱法等[7],热力学分析主要是利用差示扫描量热法分析变性过程热力学参数变化[8]。另外,也可以通过蛋白溶液消光系数随温度的变化研究蛋白质热变性[9-10]。
上述研究方法有一个共同的缺点是只能用于提纯蛋白质热变性研究。蛋白质溶解性分析可以直接研究大米中蛋白质的变性行为,蛋白质提取剂是含有不同溶质的缓冲液,针对蛋白质次级结构中不同的弱化学键。蛋白质在不同提取剂中的溶解度变化可以反映蛋白质次级结构变化的信息,进而可以了解蛋白质的变性行为。
1 材料与方法
1.1材料与仪器
大米原料一种粳米,一种糯米,均来自中国江苏宜兴市粮油集团大米有限公司,收获于2009年,经过碾米加工,在-20℃条件下保存待用;磷酸缓冲液(PB,pH7.5)、尿素、硫脲、二硫苏糖醇、曲拉通(Trionx-100)、3-((3-胆固醇氨丙基)二甲基氨基)-1-丙磺酸(CHAPS)、浓硫酸、过氧化氢、硫酸铜、硫酸钾、硒粉、氢氧化钠、牛血清蛋白、考马斯亮蓝G-250均为分析纯,均购自国药集团。
玻璃凯氏定氮仪国药集团;1-15PK型离心机德国西格玛公司;F6/10型高剪切分散乳化机上海弗鲁克流体机械公司;UV2000型分光光度计尤尼柯仪器有限公司;JFSD-100型粉碎机上海嘉定粮油检测仪器厂;焙炒流化床自制;BCD-155TDGA型冰箱青岛海尔股份有限公司;Free ZONE 2.5冻干机美国LABCONCO公司。
1.2大米焙炒
在流化床中分别采用过热蒸汽,空气在200℃下焙炒,焙炒时间分别是5、10、20、30、40s。焙炒大米经过粉碎机粉碎后,过80目筛,分装于密封袋中,在干燥器中保存。
1.3大米蒸煮
原料大米分别浸泡1、7d,然后在常压下蒸汽蒸饭30min,蒸煮后立刻放冰箱-20℃冷冻24h,再经过真空冷冻干燥,最后粉碎,过80目筛,分装于密封袋中于干燥器中保存。
1.4蛋白质提取剂系统及提取方法
根据表1配制不同的提取剂用于大米蛋白质的溶解。根据溶质的功能和组成,将提取剂分为两个系统,单一组分系统和IEF缓冲液系统。

表1 蛋白质提取剂配制表Table.1 Composition of protein extraction agent
称取50mg米粉,加入提取剂10mL,用手持式搅拌机搅拌3min,提取2h后离心(16000r/min,15min),离心后的提取液测定蛋白质浓度。
1.5大米中总蛋白含量测定
凯氏定氮法[11]。
1.6提取液中蛋白质浓度测定
1.6.1标准曲线的制作用超纯水配制100μg/mL标准BSA(牛血清蛋白)溶液。以超纯水作为实验缓冲液,分别取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8mL标准BSA溶液,分别加入1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2mL蒸馏水中,构成标准蛋白溶液。每份标准蛋白溶液中分别加入5mL考马斯G-250溶液(考马斯亮蓝G-250溶于50mL 95%乙醇,加入100mL 85%H3PO4,加蒸馏水稀释至1000mL),翻转摇匀,3~5min后,依次测标准样品在595nm下的A值(以蛋白质含量为0的做参比),每个标样重复3次读数,取其平均值,以蛋白质浓度为横坐标(μg/mL),吸光度为纵坐标(y,A595),作标准曲线,建立回归方程。
1.6.2提取液中蛋白质浓度测定取1.4所得的离心提取液0.5mL,加水混合至1mL,再加5mL考马斯蓝G-250 5mL,3min后,测595nm下样品的A值,带入标准曲线得出蛋白质含量。
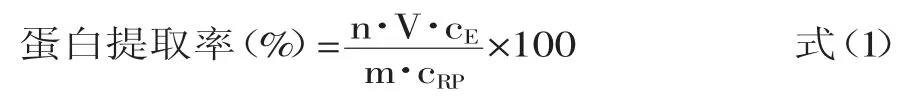
式中,V—提取液体积,mL;cE—提取液蛋白质浓度,μg/mL;n—提取液稀释倍数;m—样品质量,mg;cRP—大米样品总蛋白质含量,μg/mg。

图1 提取液蛋白质浓度测定标准曲线及回归方程Fig.1 Standard curve and regression equation ofprotein concentration of extract
2 结果与讨论
2.1单一组分系统提取大米中的蛋白质
大米总蛋白含量的测定结果,粳米总蛋白质含量91μg/mg,糯米总蛋白质含量79μg/mg。提取液中蛋白质浓度测定的标准曲线和回归方程均在图1中,标准曲线的R2值为0.99,可以满足检测要求。测定的提取液蛋白质浓度代入式(1)即可求得大米蛋白质提取率。
单一组分系统选取的提取剂的作用分别是:PB缓冲液提取原生状态蛋白质;尿素和硫脲主要破坏非共价键(氢键,疏水键);DTT破坏二硫键;Triton X-100,CHAPS破坏疏水键[12-13]。通过测定在不同提取剂中的溶解度,可以了解大米蛋白质在加热过程中次级结构的变化信息。
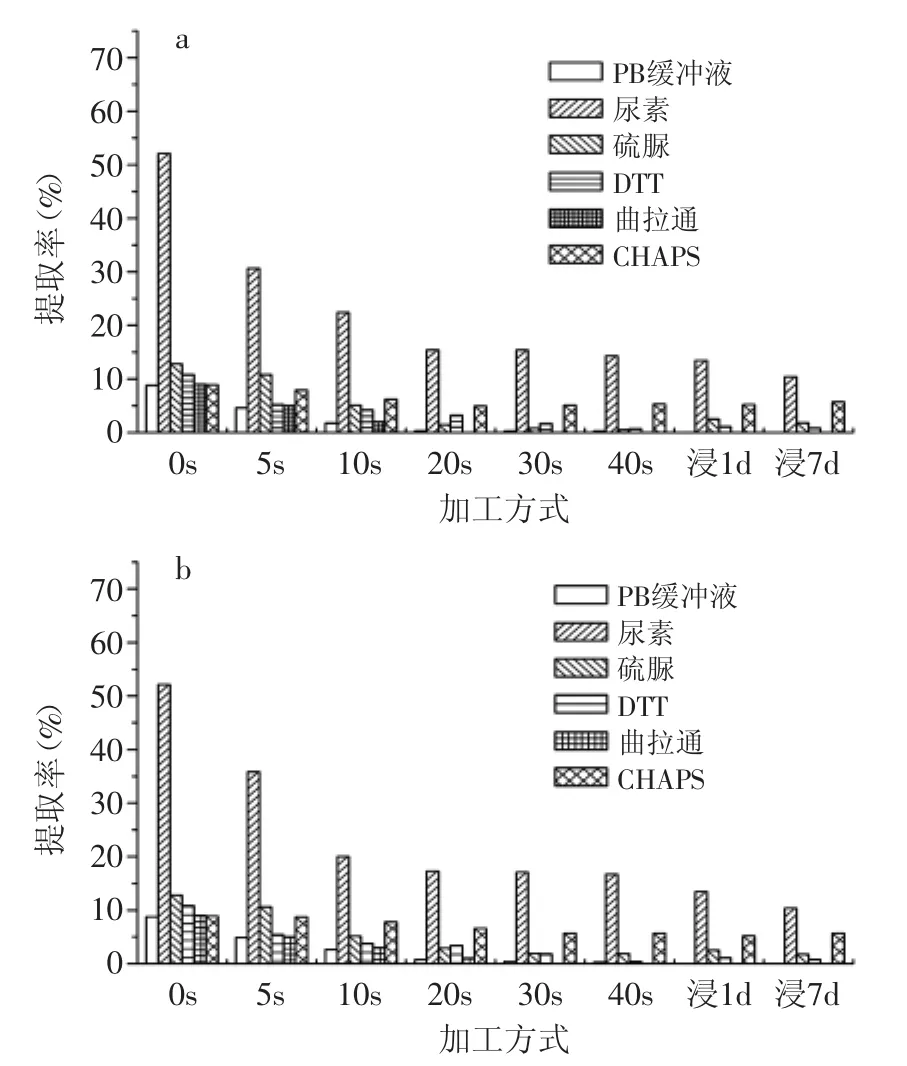
图2 单一组分提取系统粳米蛋白提取率Fig.2 Rice protein extraction rate by single component extraction system
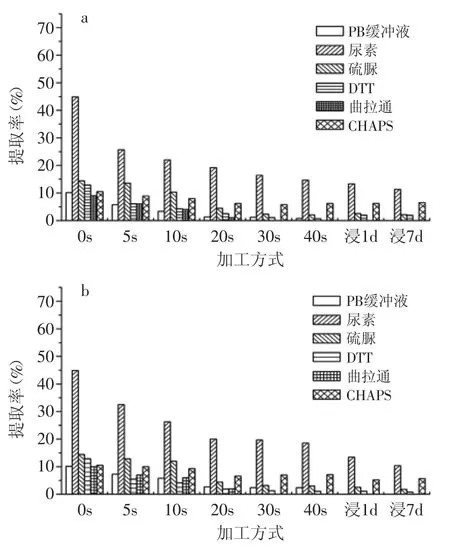
图3 单一组分提取系统糯米蛋白提取率Fig.3 Glutinous rice protein extraction rate by single component extraction system
图2~图3分别是粳米和糯米在过热蒸汽和空气中焙炒大米的蛋白提取率,磷酸缓冲液提取自然状态下的蛋白质,因此,提取率非常低。其他五种物质中,除了尿素有较高的提取率外,其他几种溶剂仅略高于磷酸缓冲液的提取能力。说明大米中的蛋白质中未有对次级结构起决定作用的弱化学键,因此,认为大米蛋白质的次级结构受多种弱化学键共同影响,任何单一的溶剂无法大幅度提高蛋白质的提取率。
尿素对促进蛋白质的溶解有比较显著的效果,其机理主要是打破氢键和疏水键,说明氢键和疏水键在大米蛋白的次级结构中起比较重要的作用,是保持大米的自然状态的主要弱化学键。大米蛋白质在尿素中的溶解度在焙炒初期急剧下降,焙炒中期后不再发生变化,说明大米蛋白热变性的过程主要发生在焙炒初期,热变性过程时大米蛋白质中的氢键和疏水键同样也发生了较大的变化。
2.2IEF缓冲液提取大米中的蛋白质
图4、图5分别是用IEF提取系统提取焙炒粳米和糯米蛋白的提取率。从总体上看,提取率显著高于单一组分系统,说明需要提取剂中多组分同时破坏蛋白质中不同的弱化学键,蛋白质的结构才能发生变化,并溶解于溶剂中。IEF缓冲液提取系统与单一组分提取系统的最大区别是尿素的作用。在单一组分中,尿素的效果比较显著,但在IFE提取系统中,尿素的作用并不突出。反之,DTT的作用却相对比较大,缺少DTT的IEF缓冲液大米蛋白质的提取能力显著下降。产生这种现象的可能原因:IEF缓冲液组分中,硫脲、曲拉通、CHAPS的作用与尿素相似,具有较强的互补性,因此,缺少尿素的IEF缓冲液仍然具有较强的大米蛋白提取能力。DTT的作用是破坏二硫键,并且在IEF的组分中只有DTT具备这种能力,因此,如果缺少DTT,IEF缓冲液无法破坏二硫键,大米蛋白质溶解能力随之大幅下降。比较在单一组分系统中,DTT溶液提取蛋白质的能力并不强,说明DTT只有在打破氢键等前提下才能发挥作用,因此,与尿素或其他相似功能的物质共同使用才能提高蛋白质提取能力。反之,硫脲、曲拉通、CHAPS也只有与DTT协同作用时才表现破坏氢键和疏水键的能力。因此,多组分协同作用是提取剂提高蛋白质提取率的关键。
与单一组分系统相同,大米蛋白质的提取率在焙炒前期变化很大,中后期基本不变,大米蛋白质的热变性主要发生在焙炒前期。说明大米蛋白对温度比较敏感,而加热时间对蛋白的变性影响不大。含水率可能对大米蛋白质的变性也有重要影响,焙炒时大米的水分不断蒸发减少,含水量由初始时的约14%降低到最终的4%左右[4]。在焙炒初期,大米的温度并不高,但含水率相对较大,而在中后期大米的温度比较高但含水率比较低。而受热时蛋白的含水率对蛋白是否发生热变性以及变性的程度有影响。
蛋白质的热变性一般属于次级结构改变,但随焙炒的进程,大米蛋白质在IEF缓冲液中的溶解度由约70%降低到约40%,说明部分蛋白质的变性不仅是次级结构中的弱化学键发生了变化,还发生了更高能级的化学变化,形成新的化学键或者蛋白质与大米中的其他成分结合成复合物等,总之,蛋白质的结构改变超出了次级结构的变化范围。
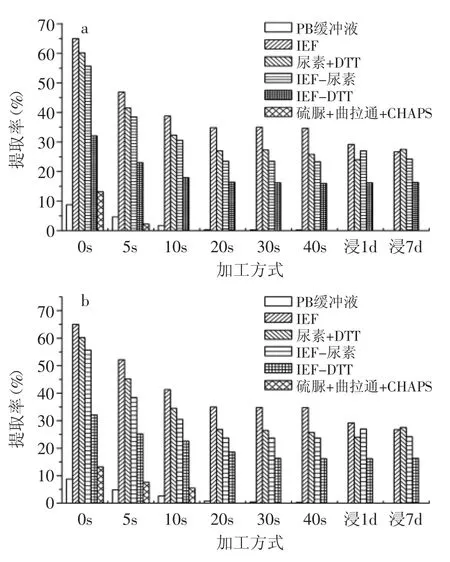
图4 IEF缓冲液提取系统粳米蛋白提取率Fig.4 Rice protein extraction rate by IEF buffer extraction system
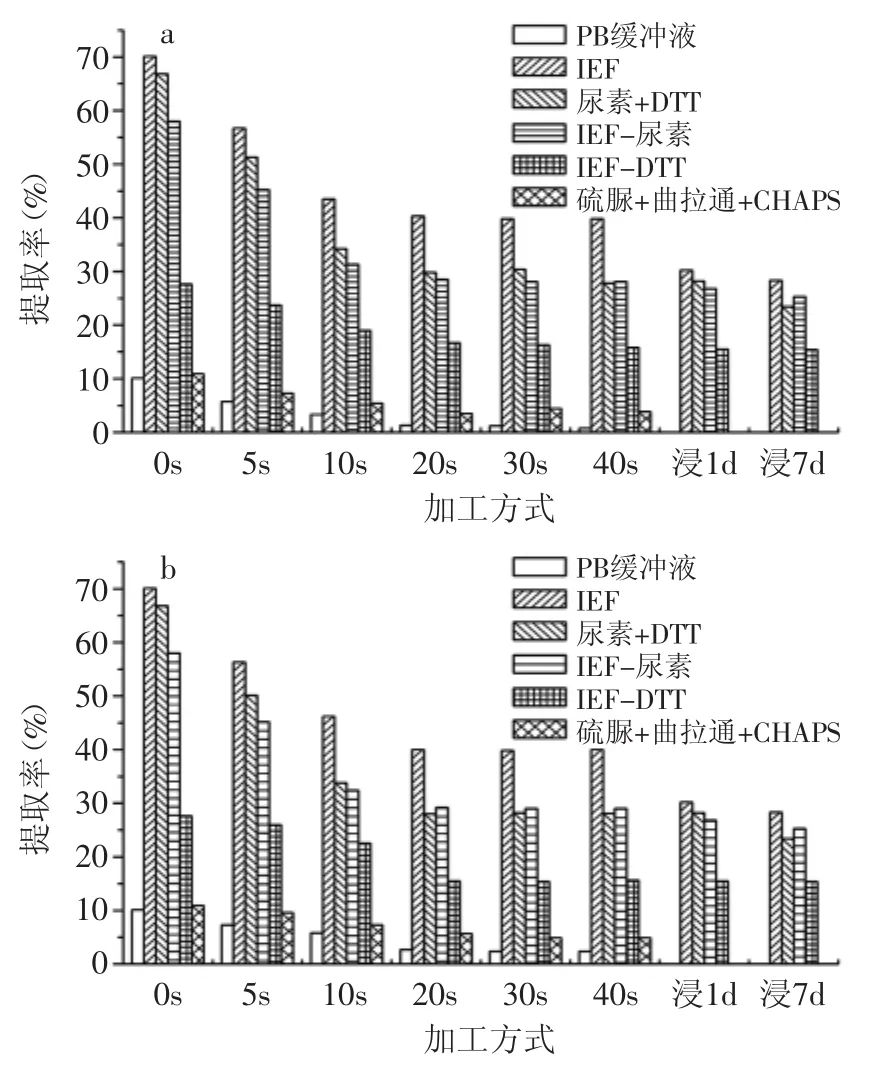
图5 IEF缓冲液提取系统糯米蛋白提取率Fig.5 Glutinous rice protein extraction rate by IEF buffer extraction system
3 讨论
与传统的湿热加工方式相比,焙炒大米中蛋白的变性程度相对较低,而传统的加工方式中,浸泡时间长的大米蛋白质变性程度更高。这种现象值得关注,因为焙炒是高温、短时和低水分含量而传统的蒸煮是低温、长时间和高水分含量。这进一步印证了水分对蛋白热变性的促进作用[6],并且长时间浸泡使大米的微观结构和蛋白质结构都发生了变化,蛋白质更容易发生热变性。
比较糯米和粳米中蛋白质溶解度,两者之间存在差异,这种差异是两种大米在微观结构和所含淀粉分子差异造成的。比较发现,过热蒸汽和空气对焙炒大米蛋白变性的影响不大,无论采用什么样的加热介质,关键是加热介质对大米自身的温度和温度变化产生的影响,如果介质的加热效果相同,那么大米蛋白的热变性也就相同,与所采用加热介质种类无关,仅与大米自身的温度变化有关。
4 结论
4.1大米焙炒过程中,大米蛋白的热变性发生在焙炒前期,并且变性程度较高,除了次级结构被改变以外,还有能级更高的化学键的变化。
4.2尽管焙炒温度较高,但焙炒大米的蛋白质变性程度低于传统的浸泡蒸煮大米,并且粳米与糯米的变性过程和程度基本相同,使用不同的加热介质对大米蛋白的变性没有影响。
[1]张建华,陶绍木,彭昌亚,等.高温流化法糊化在黄酒生产中的应用[J].酿酒,2005,32(2):79-81.
[2]毛青钟,张水娟,鲁瑞刚,等.焙炒米酿制黄洒的中试报告[J].江苏调味副食品,2007,25(5):15-17.
[3]彭昌亚,张建华,帅桂兰,等.利用高温流化米酿制新型黄酒[J].酿酒,2002,29(2):90-91.
[4]CHEN J X,XU Y.Brewing of Chinese rice wine from rice roasted using superheated steam[J].Journal of the Institute of Brewing,2012,118(1):97-106.
[5]BEIZHAO Z J.Roasted technology in the application of sake brewing[M].Wuxi:Academia Press,1997:39-42.
[6]王璋,许时婴,汤坚.食品化学[M].北京:中国轻工业出版社,2007.
[7]何建川,邵阳,张波.蛋白质和变性蛋白质二级结构的FTIR分析进展[J].化学研究与应用,2012,24(8):1176-1186.
[8]易薇,胡一桥.差示扫描量热法在蛋白质热变性研究中的应用[J].中国医药学杂志,2004,39(6):401-403.
[9]曹小敏,王志勇,刘欲文,等.等转化率法分析溶菌酶在添加剂影响下的热变性行为[J].化学学报,2010,68(2):194-198.
[10]萨楚尔夫,罗辽复.蛋白质热变性现象的研究[J].内蒙古师范大学学报,2002,31(4):337-342.
[11]GB 5511—1985,粮食、油料检验粗蛋白质测定法[S].
[12]PRUDENCIO-FERREIRA S H,AREAS J A G.Proteinprotein interactions in the extrusion of soya at various temperatures and moisture contents[J].J Food Sci,1993,58:378-381,384.
[13]LIU K,HSIEH F-H.Protein-protein interactions during high-moistureextrusionforfibrousmeatanaloguesand comparison of protein solubility methods using different solvent systems[J].Journal of Agricultural and Food Chemistry,2008,56(8):2681-2687.
Analysis of the thermal denaturation of rice protein during roasting by protein solubility study
CHEN Jian-xin1,2,XU Yan1,3,*
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China;3.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Thermal denaturation of rice protein during roasting was examined in this paper.The information about the changes of secondary structure of rice protein and thermal denaturation of rice protein was known through the solubility of rice protein changes in different solvents.It was found that the thermal denaturation occurred mainly in the early stage of roasting and thermal denaturation involved the change of protein secondary structure and the higher energy level chemical changes.Compared with the traditional cooking methods,roasted rice protein thermal denaturation degree was low.Protein denaturation degree of waxy rice and no waxy rice was similar during roasting and the effect of thermal denaturation of rice was the same using different heating medium.
roasting;protein extraction;rice;thermal denaturation;protein solubility
TS262.4
A
1002-0306(2014)06-0132-05
2013-08-02*通讯联系人
陈建新(1965-),男,大学本科,高级工程师,研究方向:酿酒机械化。

