超高压时间对胶原明胶化及成品明胶品质的影响
黄丹丹,马 良,2,周梦柔,刘 轶,张宇昊,2,*
(1.西南大学食品科学学院,重庆400715;2.西南大学国家食品科学与工程实验教学中心,重庆400715)
超高压时间对胶原明胶化及成品明胶品质的影响
黄丹丹1,马 良1,2,周梦柔1,刘 轶1,张宇昊1,2,*
(1.西南大学食品科学学院,重庆400715;2.西南大学国家食品科学与工程实验教学中心,重庆400715)
以1%(w/v)HCl溶液为传压介质,研究不同时间(0~45min)的超高压(300MPa)处理对胶原的热稳定性及成品明胶的分子量分布、凝胶强度、流变学特性等的影响,以分析超高压时间在胶原明胶化过程中的作用及其对明胶品质的影响。结果显示:经5~45min的超高压处理的明胶化胶原的热稳定性高于传统酸处理组,但是低于未处理组(超高压时间为0min);结合前期工艺研究结果,可以发现超高压处理组胶原的热稳定性较低、明胶提取率较高,说明超高压处理能够破坏链间氢键、松散胶原三螺旋结构,有利于胶原明胶化;且超高压组明胶的亚基组分(α、β)得到很好的保留,而传统酸法明胶亚基组分相对含量很低(小于10%),超高压明胶中高分子量组分(亚基组分)使超高压明胶组明胶具有较好的胶凝特性和粘弹性能。
超高压,时间,胶原,明胶,品质
明胶是一种重要的天然高分子化合物,以其良好的乳化性、持水性、成膜性、胶凝性等特点而广泛应用于食品、医药及化工等领域[1]。明胶来源于动物结缔组织中的胶原蛋白,胶原蛋白属于不溶性蛋白,其分子单位称为原胶原,每个原胶原分子由3条α-肽链组成,α-肽链自身为α螺旋结构,3条α-肽链则以平行、右手螺旋形式缠绕成“草绳状”3股螺旋结构[2]。胶原的明胶化是指破坏维系和稳定胶原三螺旋结构的非共价键和共价交联,松散胶原的三螺旋结构、破坏非螺旋结晶区,以利于后期热处理过程中胶原亚基分子的释放[3-4]。目前大规模应用于生产的明胶制备方法是传统的酸碱法,即先采用酸、碱预处理胶原原料,使之明胶化,再通过加热破坏氢键和一些共价键,使胶原三螺旋结构解体,转变成可溶性明胶[5]。随着环境保护和清洁生产日益受重视,传统酸碱诱导明胶化过程中周期长、能耗大、环境污染严重等诸多弊端日益显现。此外,酸碱作用还会导致肽键的非正常断裂,破坏胶原亚基的完整性,进而影响成品明胶的品质[2,5-6]。因此探索清洁高效的胶原明胶化诱导方法,以改进明胶传统生产工艺,对我国明胶产业的健
康发展具有重大现实意义。
近年来超高压技术被广泛应用于蛋白改性方面的研究中,这些研究表明高压会影响维系蛋白质空间结构的氢键、疏水作用、静电作用、范德华力等非共价作用,破坏蛋白质的非共价键平衡,并且可以增强蛋白的水化作用,改善蛋白溶解性[7-11]。这些作用与酸碱诱导胶原明胶化作用相一致,因此推测超高压能够诱导胶原明胶化。国内外已有少数学者应用超高压诱导胶原明胶化制备明胶的报道,例如Gómez-Guillén等[12]及本课题组[13]曾应用超高压技术改进多佛箬鳎鱼和巴沙鱼鱼皮明胶的常规酸法制备工艺,结果均显示适当的超高压预处理可增加明胶提取率,且超高压条件的改变会影响产品品质,但对相关机理未作进一步报道。由于目前世界明胶市场仍以哺乳动物源明胶为主,本课题组进一步优化了超高压制备猪皮明胶工艺,发现超高压协同低浓度的盐酸可有效诱导猪皮胶原明胶化,短时间的超高压处理可显著提高明胶的提取率和凝胶强度,但是随着超高压时间的延长,提取率趋于稳定,而凝胶强度呈降低趋势,对于相关机理尚未明确[14]。
可见,超高压技术可应用于制备高品质明胶,但目前尚无相关机理的系统研究报道。本实验首先从热力学层面及分子层面研究超高压诱导胶原明胶化过程中超高压时间对胶原结构变化的影响,进而研究超高压时间对明胶凝胶特性和流变学特性等品质的影响,并结合胶原明胶化过程中分子结构变化分析影响产生机制。以期有效阐明超高压时间在诱导胶原明胶化中的作用及其对明胶品质的影响机理,为超高压技术在明胶产业化中应用乃至明胶清洁生产工艺的建立奠定理论基础。
1 材料与方法
1.1 材料与仪器
猪皮 购于重庆市北碚区天生丽街永辉超市,原料获取后洗净,刮除表层脂肪,95℃下预蒸8m in后,切成约2mm×3mm的小块,混匀,冻藏于冰箱中备用;十二烷基硫酸钠(SDS)、Tris、过硫酸铵(APS)、β-巯基乙醇(2-ME)、四甲基乙二胺(TEMED)、考马斯亮蓝R-250 BIO BASIC公司;30%丙烯酰胺(丙烯酰胺与甲叉双丙烯酰胺质量比为29∶1) 北京索莱宝科技有限公司;甘氨酸(Glycine)、溴酚蓝(BPB) 生工生物工程(上海)有限公司;标准蛋白(分子量10~200ku) Fermentas公司。
JA3003B型电子天平 上海精天电子仪器有限公司;PHS-25型数显酸度计 杭州雷磁分析仪器厂;DZ600/2S型真空包装机 上海人民包装股份有限公司(原上海人民仪表厂);HPP.L3型超高压处理设备 天津市华泰森淼生物工程技术有限公司;8002型温控水浴锅 北京永光明医疗仪器厂;SHZ-B型水浴恒温振荡器、CJ-78-1型磁力搅拌器 上海将任实验设备有限公司;5810型台式高速离心机 德国Eppendorf公司;101-4-S型电热恒温鼓风干燥箱 上海跃进医疗器械厂;JYL-C022型九阳料理机 九阳股份有限公司;HX-1005型恒温循环器 郑州长城科工贸有限公司;TA.XT2i型物性测定仪 英国Stable M icro System公司;S-300N型DSC(差示扫描量热仪) 德国耐驰仪器制造有限公司;DHR-1型流变仪TA公司;Power PacTM型基础电泳仪 美国Bio-Rad公司;G:BOX EF型凝胶成像系统 英国Syngene公司。
1.2 实验方法
1.2.1 传统酸法诱导猪皮胶原明胶化提取明胶的工艺 首先依照GB/T 14772-2008[15]对猪皮进行脱脂处理;再采用质量分数为1%NaCl溶液浸泡以去除杂蛋白(浸泡搅拌6h,每2h换一次液);接着按1∶10的比例加入质量分数为1%HCl溶液浸泡20h,期间间断搅拌,浸泡完后洗涤至接近中性以备提胶;然后按1∶3的比例加去离子水,调节pH至4.5,于60℃水浴振荡提取6h,过滤,胶液于10000r/min离心20min,收集上清液于烘箱中70℃烘干,粉碎,得到传统酸法明胶。
1.2.2 超高压诱导猪皮胶原明胶化提取明胶的工艺 将去除杂蛋白后的样品按1∶1.5添加质量分数为1%的HCl溶液、真空包装后在300MPa下分别进行0、5、15、30、45m in的超高压处理,然后洗涤至接近中性,随后进行热力提胶,提胶条件同1.2.1。
1.3 分析方法
1.3.1 明胶化胶原的热稳定性分析 按照猪皮提胶的明胶化处理工艺处理猪皮,由于猪皮已经过脱脂、除杂蛋白,其中的干物质主要是胶原,故以所得样品作为明胶化胶原样品。分别取经0~45m in超高压处理的明胶化胶原进行DSC测定,并同传统酸处理的明胶化胶原对比,分析超高压处理时间对胶原热稳定性的影响。测定方法如下:称取样品约20mg,用铝坩锅封存,放入DSC仪,在氮气气氛下,以5℃/m in的速率从15℃升温至120℃,记录吸热曲线。
1.3.2 明胶组分分析 采用SDS-PAGE垂直电泳分析超高压明胶和传统酸法明胶的亚基组成和分子量分布。6%的分离胶,5%的浓缩胶;电泳缓冲液为10×Tris-Glycine缓冲液(含0.25mol/L Tris、1.92mol/L Glycine、10g/L SDS,稀释10倍作内槽电泳液);5×样品缓冲液(含250mmol/L Tris-HCl(pH 6.8)、0.1g/m L SDS、5mg/m L BPB、0.5m L/m L甘油、0.05m L/m Lβ-巯基乙醇);考马斯亮蓝R-250染色液(含1g/L考马斯亮蓝R-250、450m L/L甲醇);考马斯亮蓝染色脱色液(含100m L/L冰醋酸、100m L/L甲醇)。配制1.5mg/m L的明胶溶液,按4∶1添加5×样品缓冲液,沸水浴5min,冷却后上样,上样量为15μL(Marker上样量为10μL)。15mA恒流电泳,待溴酚蓝跑到分离胶中后,电流调至25mA,电泳时间约1.5h。考马斯亮蓝染色2h后用脱色液脱色,多次更换脱色液直至背景脱净,然后用凝胶成像系统拍摄电泳图谱,用(Version 2003.02)软件分析图谱。
1.3.3 明胶流变学性质测定 采用DHR-1流变仪测定6.67%的超高压明胶和传统酸法明胶的粘弹性,分析超高压时间对明胶粘弹性的影响。设定温度变化速率为1℃/min,控制变量strain(%)为5,测试夹具40mm A l平板,Peltier温度控制系统,板间距为1000μm,明胶样品溶化后于流变仪上温度由40℃
(或45℃)冷却到5℃,在5℃下保持10m in,然后由5℃加热到40℃(或45℃),测定弹性模量G′和粘性模量G″随温度扫描的变化,计算相角。
1.4 数据处理
采用Origin 8.0进行实验数据处理。
2 结果与分析
2.1 超高压时间对明胶化胶原热力学性质的影响
DSC技术是在温度程序的控制下,测量试样相对于参比物的热流速度随温度变化的一种技术,该技术克服DTA在计算热量变化的困难,为获得热效应的定量数据带来很大方便。经不同时间超高压处理的明胶化胶原的DSC图谱如图1(a)所示。正如Mu等[16-17]所报道的,猪皮胶原的DSC曲线均呈现两个吸热峰,一个位于35~40℃的副吸热峰(Ts)和一个位于45~75℃间的主吸热峰(Tm),这可能与“三螺旋结构-纤维形成”有关。三螺旋结构单元(原胶原分子)通过侧向和纵向连接形成胶原原纤维和胶原微纤维,三螺旋结构的稳定主要借助其内部多肽链分子间的氢键作用力,而胶原纤维的稳定则借助三螺旋结构单元之间的氢键作用力和共价交联作用力;稳定胶原纤维的三螺旋之间的氢键比引起胶原变性的三螺旋内部的氢键更容易断裂[16]。因此,当温度加热至Ts时,首先引起三螺旋之间的氢键断裂,导致三螺旋单体发生解离,但三螺旋内部的氢键作用力依然存在;进一步加热至Tm则引起三螺旋内部肽链间氢键作用力的减弱,导致三股螺旋解旋为不规则卷曲状,胶原变性。
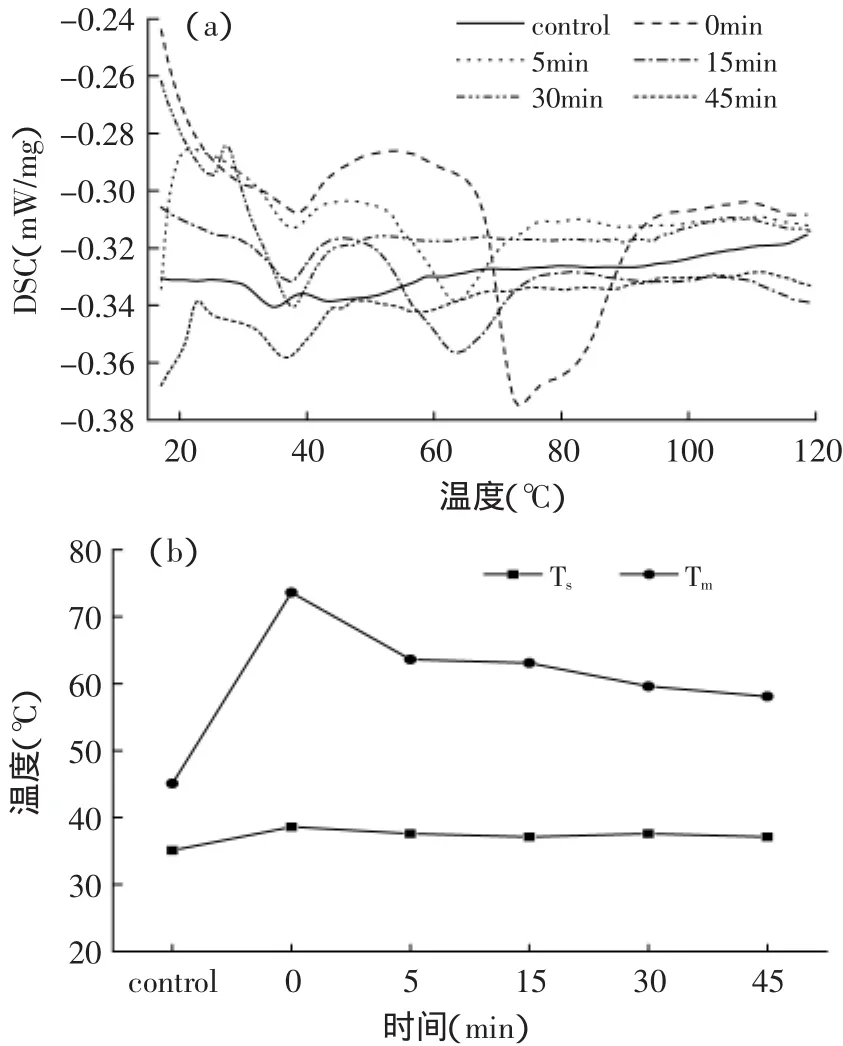
图1 300MPa下超高压预处理不同时间的猪皮胶原的DSC曲线和峰值温度Fig.1 DSC curves and temperatures for peak maximum height of collagens from pig skin pressurized at 300MPa for different time
通过Origin 8.0软件分析得到DSC曲线的峰值温度如图1(b)所示。由图1(b)可知,各时间组的Ts间无显著差异(p>0.05),但Tm差异显著(p<0.05)。未处理组(超高压处理时间为0)Tm值最高,超高压组次之,对照组(传统酸法明胶)最低,说明三螺旋内部氢键被破坏程度:对照组>超高压组>未处理组。对照组胶原经长时间的酸浸泡,充分发生酸溶胀,三螺旋结构被破坏程度最大,链间氢键作用大幅度减弱[5,18-20]。未处理组胶原仅在除杂蛋白过程中发生轻度溶胀,胶原三螺旋结构被破坏程度最低,链间氢键作用得以较大程度的保留。超高压组三螺旋内部总体氢键被破坏程度居中,说明超高压诱导胶原构象的转变,也能够松散胶原的三螺旋结构。超高压降低胶原Tm值的原因在于UHP作用破坏了胶原非共价键平衡,导致胶原原始结构伸展,立体结构崩溃,同时促进HCl分子和水分子进入螺旋内部,加速酸与胶原碱性基团的结合作用及水合作用,二者协同作用导致胶原三螺旋结构松散,链间的氢键作用减弱[11,21]。在超高压组中,随着时间的延长Tm总体呈减小趋势,但降幅不大。原因在于随着时间延长,高压协同低浓度HCl作用对胶原的非共价平衡的破坏作用增大,三螺旋结构松散程度增加,链间的氢键作用减弱,Tm降低。然而由于超高压破坏链间氢键的同时一些水合桥接(水分子介导的氢键)也会形成,这些水桥具有稳定三螺旋结构的作用,二者综合作用使得三螺旋结构被松散程度减小,Tm的降幅减小[21-22]。
前期实验结果表明[14],5~15m in的超高压处理组的明胶提取率显著高于未处理组(p<0.05),超过15m in后,延长超高压时间提取率没有显著变化(p>0.05)。结合提取率和热力学的研究结果,可以推测,5~15m in的超高压处理即可显著松散胶原三螺旋结构,促进胶原明胶化,从而提高明胶提取率;延长超高压时间,未能明显提高胶原三螺旋结构的松散程度,胶原明胶化程度变化较小。
2.2 超高压时间对明胶亚基组成及分子量分布的影响
应用SDS-PAGE电泳检测明胶的亚基组成及分子量分布,结果如图2(a)所示。可以看出,传统酸法明胶的蛋白带主要分布在70ku以下,α、β等亚基组分对应的条带不易辨出,这可能是由于长时间的酸处理在破坏非共价键平衡的同时,也破坏了胶原分子的共价键(包括肽键),导致胶原亚基降解。超高压组明胶的平均分子量明显高于传统酸处理(TG),主要由100~120ku之间两条α带和大于200ku的β带组成。这是因为超高压主要破坏胶原非共价键平衡,而介质酸的短时间作用又不足以破坏胶原分子的共价键,故亚基组分得到较大程度的保留。Gómez-Guillén等[12]报道称高压提取的明胶含有更多的高分子量组分,这与本研究的结果相一致。
经Phoretix 1D软件分析得到各明胶中α、β等高分子量组分所占比例如图2(b)所示。可见,超高压明胶的α、β等亚基组分的相对含量明显高于传统酸法明胶(p<0.05),说明超高压作用对共价键特别是肽键的破坏作用较小,能够较好的保持亚基的完整性。
随超高压处理时间由0m in延长至30m in,高分子量组分含量略有升高,至45m in时有一定下降。这可能是因为短时间的超高压作用可以促进蛋白亚基的聚凝[23],使得所提明胶的高分子量组分含量增大;超高压时间延长至45min时,对于增进蛋白聚合的贡献已经很小,而酸对共价键的破坏作用增加,高分子量组分含量降低。总体而言,0~45min的超高压处理对亚基组分的降解作用均较小。

图2 明胶的SDS-PAGE电泳图谱和亚基组分的相对含量Fig.2 SDS-polyacrylamide gel electrophoresis and the relative amountof subunit components of gelatins prepared from pig skin
凝胶强度是明胶的重要功能特性,它受氨基酸组成、平均分子量与分子量分布、胶凝环境等多种因素影响[24-25]。凝胶是明胶分子在水溶液中聚集形成的三维网络结构[2]。凝胶化过程中,肽链间相互交联形成有序的类三螺旋结构,并进一步聚集构成网络,高分子量组分能够参与形成长三螺旋结构,有利于单位体积内交联节点的增加,从而使凝胶结构强化,凝胶强度提高;而低分子量组分的存在可能阻碍亚基间的联结,且其自身需要更多的交联来形成网络,故不利于凝胶网络的形成与稳定,导致凝胶强度降低[25-30]。
前期实验结果表明[14],传统酸法明胶的凝胶强度较低,明显低于超高压组(p<0.05),这与高分子量组分相对含量呈正相关,说明超高压作用通过影响明胶的分子量分布而影响明胶的凝胶强度。然而,随着超高压时间的延长,凝胶强度呈减小趋势[14],与亚基组分相对含量的变化趋势不一致。这可能是由于随着超高压时间延长,亚基组分相对含量变化不大,而胶原内部酸残留量增大,导致中和洗酸过程延长,成品明胶中NaCl残留量增加,这就阻碍了短范围的静电相互作用,影响肽链间的交联[31]。综上所述,明
胶凝胶强度主要受分子量分布的影响,同时也受离子强度等胶凝环境条件的影响。

图3 明胶的储能模量(G′)、损耗模量(G″)和相角(δ)Fig.3 Elasticmodulus(G′),viscousmodulus(G″)and phase angle(δ)of gelatins
2.3 超高压时间对明胶流变学特性的影响
流变学特性是明胶的另一个重要性质,好的流变性能(高的胶凝/熔化温度等)能够拓展明胶的应用范围[2]。图3显示6.67%的明胶在由40℃(或45℃)冷却至5℃和随后由5℃加热至40℃(或45℃)过程中储能模量(G′:弹性成分)、损耗模量(G″:黏性成分)和相角(δ)的变化情况。各样品冷却曲线的变化趋势相似,但胶凝温度存在差异。随着温度降低,G′和G″值快速增加,表明明胶分子间交联的快速形成、凝胶结构强化,明胶迅速由溶液转变成凝胶。各超高压组明胶凝胶的G′和G″值开始升高的温度较TG高,说明超高压明胶凝胶起始温度高于传统酸法明胶。这是因为传统酸法中存在较高含量的低分子量组分,它们高温下分散度较大,不利于交联区的快速形成;而超高压明胶的亚基组分得到较好的保留,这些高分子量组分的活动性较差,在较高温度下也能快速形成交联区[25-30]。5℃时,所有样品的相角都很小(δ<2°),表明形成了较好的明胶凝胶。后续的加热曲线显示各样品的熔化温度存在差异,但均表现出快速的转变。加热过程中,超高压明胶凝胶的G′和G″值开始降低的温度较传统酸法明胶高,显示出较高的热稳定性,说明高分子量亚基间不仅能快速形成交联区,且单位体积内交联节点更多,形成的凝胶网络更稳定,这与凝胶强度的结论相一致。
由相角的快速变化可以判断明胶的胶凝/熔化温度[31]。一般以tan(δ)=1作为胶凝和熔化的转折点,其对应的温度即为胶凝/熔化温度[32],由此得出各样品的胶凝/熔化温度如图4所示。由于明胶凝胶在熔化过程中会吸收能量,故熔化温度高于胶凝温度。各超高压组明胶的胶凝/熔化温度明显高于传统酸法明胶(p<0.05),这可能是由分子量及分子量分布的差异引起的。传统酸法明胶亚基的降解程度较大,高分子量组分含量较低,形成的凝胶网络稳定较差,粘弹性能不佳;而超高压明胶的亚基得到较好保持,高分子量组分含量较高,形成的凝胶网络更稳定,粘弹性较好[2,28]。此外,随着时间延长,胶凝/熔化温度基本呈现减小趋势,与高分子量组分相对含量的变化趋势不一致,可能和凝胶强度一样,也是受离子强度(NaCl残留程度)等胶凝环境的影响[33]。

图4 明胶凝胶的胶凝温度和熔化温度Fig.4 The gelling andmelting points of gelatin gels
3 结论
本实验通过分析超高压时间对胶原结构变化的影响,进而研究超高压时间对明胶凝胶特性和流变学特性等品质得出,短时间的超高压处理即能显著破坏链间氢键、松散胶原三螺旋结构,促进胶原明胶化;超高压具有诱导胶原聚合的作用,对胶原的共价键特别是肽键影响较小,因而超高压明胶的高分子量组分含量较高;较高的高分子量有利于凝胶网络的形成与稳定,所以超高压明胶的凝胶强度、胶凝/熔化温度等品质指标均高于商品明胶。但随着进一步延长时间至45m in,超高压处理未能明显提高胶原三螺旋结构的松散程度;且酸对肽键的破坏作用增加,导致明胶亚基组分相对含量有所降低;随时间的延长,品质指标与高分子量组分含量变化趋势也没有明显的一致性,所以明胶的胶凝性还会受到胶凝环境等其他因素的影响。
压力以及传压介质的种类和浓度对胶原明胶化及成品明胶品质的影响机制尚需进一步明确。
[1]Phillipa G O,Williams P A.Handbook of hydrocolloids[M]. New York:CRCPress,1992:64.
[2]Ward A G,Courts A.明胶的科学与工艺学[M].李文渊译.北京:中国轻工业出版社,1982:22-187.
[3]Ilona K,Elz·bieta S,Maria S,et al.Effect of extracting time and temperature on yield of gelatin from different fish offal[J]. Food Chemistry,2008,107(2):700-706.
[4]Gómez-Guillén M C,Giménez B,López-Caballero M E,et al. Functional and bioactive properties of collagen and gelatin from alternative sources:A review[J].Food Hydrocolloids,2011,25(8):1813-1827.
[5]《明胶生产工艺及设备》编写组.明胶生产工艺及设备[M].北京:中国轻工业出版社,1996.
[6]Yang H S,Wang Y F,Zhou P,et al.Effects of alkaline and acid pretreatment on the physical properties and nanostructures of the gelatin from channel catfish skins[J].Food Hydrocolloids,2008,22(8):1541-1550.
[7]Chéret R,Delbarre-Ladrat C,de Lamballerie-Anton M,et al. High-pressure effects on the proteolytic enzymes of sea bass(dicentrarchus labrax L.)fillets[J].Journal of Agricultural and Food Chemistry,2005,53(10):3969-3973.
[8]Su D,Li S J,Laurie H M,et al.Effects of high hydrostatic pressure on in vitro digestion of soy protein[J].International Agricultural Engineering Journal,2010,19(1):49-58.
[9]Collins M D,Kim C U,Gruner S M.High-Pressure Protein Crystallography and NMR to Explore Protein Conformations[J]. The Annual Review Biophysics,2011,40:81-98.
[10]Torrezan R,Tham W P,Bell A E,et al.Effects of high pressureon functionalpropertiesofsoy protein[J].Food Chemistry,2007,104(1):140-147.
[11]Sarupria S,Ghosh T,Garcia A E,et al.Studying pressure denaturation of a protein by molecular dynamics simulations[J]. Proteins:Structure,Function,and Bioinformatics,2010,78(7):1641-1651.
[12]Gómez-guillén M C,Giménez B,Montero P.Extraction of gelatin from fish skins by high pressure treatment[J].Food Hydrocolloids,2005,19(5):923-928.
[13]张宇昊,马良,师萱.鱼皮明胶的超高压辅助提取工艺[J].食品科学,2011,32(6):99-103.
[14]陈丽清,张宇昊,周梦柔,等.猪皮明胶提取过程中的超高压预处理工艺优化[J].农业工程学报,2012,28(19):262-269.
[15]GB/T 14772-2008,食品中粗脂肪的测定[S].
[16]Mu C D,Li D F,Lin W,et al.Temperature induced denaturation of collagen in acidic solution[J].Biopolymers,2007,86(4):282-287.
[17]He L R,Mu C D,Li D F,et al.Revisit the pre-transition of type I collagen denaturation in dilute solution by ultrasensitive differential scanning calorimetry[J].Thermochimica Acta,2012,548:1-5.
[18]Gómez-guillén M C,Montero P.Extraction of gelatin from megrim(Lepidorhombus boscii)skins with several organic acids [J].Journal of Food Science,2001,66(2):213-216.
[19]Giméneza B,Turnayb J,Lizarbe M A,et al.Use of lactic acid for extraction of fish skin gelatin[J].Food Hydrocolloids,2005,19(6):941-950.
[20]Chung M S,Kim JG,Ockerman H W,et al.Characteristics of gelatins extracted from pigskins following different scalding treatments[J].Food Hydrocolloids,1990,4(4):299-303.
[21]汤克勇.胶原物理与化学[M].北京:科学出版社,2012:185-251.
[22]Potekhin SA,Senin A A,Abdurakhmanov N N,et al.High pressure stabilization of collagen structure[J].Biochimica et Biophysica Acta,2009,1794(8):1151-1158.
[23]Peñas E,Préstamo G,Gomez R.High pressure and the enzymatic hydrolysisofsoybeanwhey proteins[J].Food Chemistry,2004,85(4):641-648.
[24]Gómez-Guillén M C,Turnay J,Fernández-Díaz M D,et al. Structural and physical properties of gelatin extracted from different marine species:a comparative study[J].Food Hydrocolloids,2002,16(1):25-34.
[25]EysturskarðJ,Haug I J,Ulset A S,et al.Mechanical properties ofmammalian and fish gelatins based on their weight average molecular weight and molecular weight distribution[J]. Food Hydrocolloids,2009,23(8):2315-2321.
[26]EysturskarðJ,Haug I J,Elharfaoui N,et al.Structural and mechanical properties of fish gelatin as a function of extraction conditions[J].Food Hydrocolloids,2009,23(7):1702-1711.
[27]EysturskarðJ,Haug I J,Ulset A S,et al.Mechanical Properties of Mammalian and Fish Gelatins as a Function of the Contents ofα-Chain,β-Chain,and Low and High Molecular Weight Fractions[J].Food Biophysics,2010,5(1):9-16.
[28]Gilsenan PM,Ross-Murphy SB.Rheological characterisation of gelatins from mammalian and marine sources[J].Food Hydrocolloids,2000,14:191-195.
[29]Elharfaoui N,Djabourov M,Babel W.Molecular Weight Influence on Gelatin Gels:Structure,Enthalpy and Rheology[J]. Macromolecular Symposia,2007,256(1):149-157.
[30]Kulisiewicz L,Delgado A.Network structure of gelatin gel at high pressure determined by rheological measurements[J].High Pressure Research,2009,29(1):67-71.
[31]Fernández-Díaz M D,Montero P,Gómz-Guillén M C.Effect of freezing fish skins on molecular and rheological properties of extracted gelatin[J].Food Hydrocolloids,2003,17(3):281-286.
[32]刘小玲.鸡骨明胶的制备、结构及功能性质研究[D].无锡:无锡大学,2005.
[33]Haug I J,Draget K I,Smidsrød O.Physical and rheological properties of fish gelatin compared tomammalian gelatin[J].Food Hydrocolloids,2004,18(2):203-213.
Effects of pressure level on collagen gelatinizing and propertiesof extracted gelains
HUANG Dan-dan1,MA Liang1,2,ZHOU Meng-rou1,LIU Yi1,ZHANG Yu-hao1,2,*
(1.College of Food Science,Southwest University,Chongqing 400715,China;2.National Food Science and Engineering Experimental Teaching Center,Southwest University,Chongqing 400715,China)
The effects of ultra-high pressure (UHP) (300MPa) pretreatment on collagen gelatinizing and thequality of resultant gelatin was investigated in different times(from 0 to 45 minutes) with 1%(w/v) hydrochloricacid as transmission medium. With the study of collagen thermal stability and the finished gelatin’s molecularweight distribution,viscoelastic properties and rheological properties. The results showed that the pressurizedcollagens were more thermostable than the one pretreated at ordinary pressure,but less than the untreated(theUHP time was 0). While in the foregoing study,the UHP pretreatment found lower thermal stability,high extractionrate of gelatin,which showed ultra-high pressure could disrupt hydrogen bonds between chains,loose collagentriple helix collagen gelatin and contribute to gelatinizing. The pressurized collagens gelatin preserved subunitcomponent (α,β) than the traditional method (less than 10%) ,and the well-preserved subunit made thepressurized collagens owned good high pressure gelling properties and viscoelastic properties.
ultra-high pressure;time;collagen;gelatin;quality
TS209
:A
:1002-0306(2014)16-0109-06
10.13386/j.issn1002-0306.2014.16.015
2013-12-19 *通讯联系人
黄丹丹(1991-),女,在读硕士研究生,研究方向:食品科学与工程。
国家自然科学基金项目(31301425);中央高校基本科研业务费重点项目(XDJK2011B001)。

