灵芝菌丝体中灵芝酸T、R和S的H P L C测定方法的建立和应用
赵 娜,冯 娜,贾 薇,冯 杰,刘艳芳,张劲松,*
(1.国家食用菌工程技术研究中心,农业部南方食用菌资源利用重点实验室,上海市农业遗传育种重点开放实验室,上海市农业科学院食用菌研究所,上海201403;2.上海海洋大学食品科学与工程,上海201306)
灵芝(Ganoderma lucidum)俗称灵芝草,古称瑞草、仙草、万年覃等,是担子菌纲多孔菌科灵芝属真菌,具有很高的药用价值[1],现代的研究证实其有抗肿瘤、保肝、降血压、降血糖等生物活性,三萜是灵芝产生抗肿瘤、保肝等生物活性的主要药用成分[2-3]。目前,灵芝相关的保健品和药品多以灵芝子实体为原料,但因其栽培周期长,灵芝中的活性成分的种类和含量如三萜易受栽培环境的变化而变化,导致产品质量难以控制。而利用发酵的方法制备灵芝的菌丝体作为灵芝产品开发的原料,具有生产周期短,质量容易控制,易于工业化生产等优点,越来越得到业界的重视。我们的前期研究发现灵芝酸T、灵芝酸S和灵芝酸R是灵芝菌丝体中主要的三萜成分,其具有抗肝癌[4]、抗子宫颈癌[5]、抗前列腺癌的作用。因此建立灵芝菌丝体中主要三萜成分的测定方法对开发灵芝菌丝体的产品就至关重要。灵芝子实体中三萜类化合物的液相色谱分析已有报道[6-7],但涉及菌丝体中三萜成分检测方法和质量控制的很少有报道。本研究以已报道的关于灵芝酸的相关检测方法为基础[8-10],建立了HPLC法对灵芝菌丝体中灵芝酸T、灵芝酸S和灵芝酸R进行同时测定的方法,为快速准确的检测灵芝发酵菌丝体中灵芝酸含量提供了技术保证。
1 材料与方法
1.1 材料与仪器
灵芝酸T、S、R标准品 纯度>98%,上海市农业科学院食用菌所深加工技术和发酵工程研究室;赤芝0125菌丝体、灵芝119菌丝体、灵芝G0023菌丝体中国微生物菌种保藏管理委员会农业微生物中心上海食用菌分中心;水 超纯水;甲醇 色谱纯;冰醋酸 分析纯。
Waters Acquity HPLCTM型高效液相色谱仪 美国Waters公司;KQ-600B型超声清洗器 昆山市超声仪器有限公司;超纯水器 ELGA公司。
1.2 实验方法
1.2.1 色谱条件 YMC C18色谱柱(250mm×4.6mm,5μm);流动相0.5%冰醋酸溶液(A)-甲醇(B),梯度洗脱(0~20min,85%B→100%B;20~30min,100%B),流速为1mL/min;检测波长为245nm;柱温控制在30℃;进样量为10μL。
1.2.2 样品前处理条件选择
1.2.2.1 提取溶剂的选择 精密称取样品(G0023)粉末0.5g,分别加入95%乙醇、甲醇、氯仿各25mL,超声2h,放冷,过滤,补足损失的溶剂,摇匀,滤液用0.22μm微孔滤膜过滤,即得。
1.2.2.2 浸提和超声的选择 精密称取样品(G0023)粉末0.5g,加入25mL甲醇,分别浸提14h、超声1h、超声2h、超声3h、超声4h,放冷,过滤补足损失的溶剂,摇匀,滤液用0.22μm微孔滤膜过滤,即得。
1.2.3 方法学考察
1.2.3.1 标准液的配制与曲线绘制 精密称定灵芝酸T 10.67mg、灵芝酸S 10.59mg、灵芝酸R 10.65mg,置于10mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得灵芝酸T、灵芝酸S、灵芝酸R对照品储备液。分别吸取等量的灵芝酸T、灵芝酸S、灵芝酸R的对照品储备液,混合制成标准混合母液。然后分别稀释成5个浓度梯度,用孔径0.22μm滤膜过滤,置于进样瓶中。按照上述的色谱条件获得色谱图后,以峰面积为纵坐标,浓度为横坐标,制作标准曲线,求出回归方程。
1.2.3.2 精密度实验 取混合对照品连续进样6次,测定灵芝酸T、灵芝酸S、灵芝酸R峰面积,并计算峰面积的RSD值。
1.2.3.3 重复性实验 精密称取灵芝样品(G0023)6份,按确定的方法制备供试溶液,测定灵芝酸T、灵芝酸S、灵芝酸R的含量,并计算含量的RSD值。
1.2.3.4 稳定性实验 精密称取灵芝样品(G0023)1份,按确定方法制备供试溶液,分别在制备后0、5、10、15、20、25h进样测定灵芝酸T、灵芝酸S、灵芝酸R的峰面积,并计算峰面积的RSD值。
1.2.3.5 加样回收率实验 取已知含量的灵芝样品(G0023)9份,精密称取各约0.1g,按高、中、低3个浓度,各精密加入一定量的灵芝酸T、灵芝酸S、灵芝酸R对照品3份,按照确定方法制备供试溶液,测定灵芝酸T、灵芝酸S、灵芝酸R的含量,并计算含量的RSD值。1.2.3.6 样品分析 在相同的液相色谱条件下,分别将对照品溶液和供试菌丝体的样品溶液注入高效液相色谱仪中,用外标法计算含量,根据样品对应的峰面积和标准曲线,计算各样品中灵芝酸T、灵芝酸R、灵芝酸S的含量。
2 结果与分析
2.1 样品前处理方法的确定
2.1.1 提取溶剂的比较 图1的结果表明,三种提取方法的三萜图谱含有的三萜种类相同,但相同成分的峰高有差异。

表1 不同提取剂提取率的比较Table 1 Comparison of ganderic acids’extraction ratio by different extractants
表1表明,通过SAS 8.2软件组间差异分析发现结合灵芝酸T、灵芝酸S和灵芝酸R三个指标来看,氯仿、甲醇、95%乙醇三种提取剂间,Wilks’Landa统计量F=8.39,p=0.0042<0.01,表明三者存在极显著差异;氯仿和甲醇组间,F=24.36,p=0.005<0.01,说明两者存在显著差异;氯仿和95%乙醇组间,F=12.73,p=0.016<0.05,说明两者存在显著差异;甲醇和95%乙醇组间,F=4.34,p=0.095>0.05,说明两者不存在差异。其中氯仿的提取效率最差,目标物质提取量均最低,甲醇和95%乙醇谱图相似度高,甲醇的提取效果更好,目标物质均达到最高提取量,因此本研究确定采用甲醇作为提取溶剂。
2.1.2 超声和浸提提取方式的比较 结合灵芝酸T、灵芝酸S、灵芝酸R三个指标来看,经分析发现浸提和超声各组组间的Wilks’Landa统计量F=4.34,p=0.0015<0.01,表明各组间存在极显著差异。浸提14h组与超声1、2、3、4h组均存在显著性差异,但超声1、2、3、4h组之间不存在差异很明显(p>0.05)。随着超声时间的增加,灵芝酸的提取量升高。因超声的方法耗时短、提取的得率高,因此确定超声2h为最佳提取方式。
2.2 色谱条件的确定
全波长扫描发现灵芝酸T、灵芝酸S、灵芝酸R在245nm有最大吸收峰,当检测波长设为245nm,流动相为0.5%冰醋酸溶液和甲醇,柱温为30℃,流速为1mL/min时,灵芝酸T、灵芝酸S、灵芝酸R的保留时间分别为13.5、15.3、19.9min,达到基线分离(见图2)。用该色谱条件分析G0023上层菌丝体样品中这三种灵芝酸,发现它们和其他的色谱峰能很好的分开,说明该条件可用于灵芝菌丝体中这三种灵芝酸的检测(见图3)。

表2 不同提取方式提取率的比较Table 2 Comparison of GAs’extraction ratio in different extraction ways
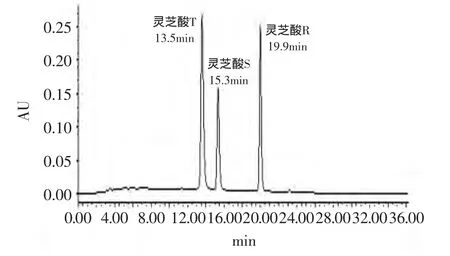
图2 混合对照品的HPLC图Fig.2 HPLC chromatograms of mixed reference substances

图3 G0023上层菌丝体样品的HPLC图Fig.3 HPLC chromatograms of Ganoderma sample G0023
2.3 方法学考察
2.3.1 标准曲线的制作 灵芝酸T、灵芝酸S和灵芝酸R的不同浓度的标准溶液的浓度和峰面积的标准曲线见图4。灵芝酸T的线性回归方程为Y=11106X-68267,r=0.9999;灵芝酸S的线性回归方程为Y=15521X-51762,r=0.9999;灵芝酸R的线性回归方程为Y=16736X-37108,r=1.0000。结果表明,灵芝酸T、灵芝酸S、灵芝酸R的测试浓度分别在4.571 ~584.256、5 ~320、4.921 ~629.888μg/mL内呈良好线性关系。

图4 灵芝酸T(A)、灵芝酸S(B)、灵芝酸R(C)的标准曲线Fig.4 Standard curve of GA-T((A)、GA-S(B)and GA-R(C)
2.3.2 精密度实验 取混合对照品连续进样6次,计算6次测定的峰面积的RSD,结果灵芝酸T、灵芝酸S、灵芝酸R峰面积的RSD值(n=6)分别为0.93%、1.76%、1.27%(见表3),表明方法的精密度良好。
2.3.3 重复性实验 取灵芝样品(G0023)6份进行重复性测试,结果灵芝酸T、灵芝酸S、灵芝酸R含量的RSD值(n=6)分别为1.31%,1.76%、1.29%(见表4),表明方法的重复性良好。

表3 精密度实验Table 3 Precision of the measured results
2.3.4 稳定性实验 把灵芝样品(G0023)的供试品溶液,分别在制备后0、5、10、15、20、25h进样测定,发现灵芝酸T、灵芝酸S、灵芝酸R的RSD值(n=6)分别为0.71%、0.66%、1.14%(见表5),结果表明方法的稳定性良好。
2.3.5 加样回收率实验 加样回收率实验结果表明灵芝酸T、灵芝酸S、灵芝酸R特异性良好。平均加样回收率和RSD值(n=9)分别为99.1%、2.4%,100.6%、1.1%,100.7%、0.9%。
2.3.6 灵芝菌丝体中灵芝酸的含量的测定 利用建立的HPLC方法对不同菌丝体中灵芝酸T、灵芝酸S、灵芝酸R的含量进行测定(见表7)。利用SAS 8.2软件组间差异分析,结合119上层菌丝、G0023上层菌丝、赤芝0125-1上层菌丝和下层菌丝四个指标来看,灵芝酸T、灵芝酸S、灵芝酸R三组间,Wilks’Landa统计量F=28.45,p=0.0003<0.01。说明不同菌株间的灵芝酸T、灵芝酸S和灵芝酸R的含量差异大,且三者之间的比例也不同,119上层菌丝体灵芝酸T、灵芝酸S和灵芝酸R之间的比为15∶5∶1,而G0023上层菌丝体为2∶2∶1;说明同一菌株不同发酵部位的菌丝体中灵芝酸T、灵芝酸S和灵芝酸R的含量差异也很大,且比例也不同,如赤芝0125-1上层菌丝体为6∶2∶1,赤芝0125-1下层菌丝体为2∶1∶1。
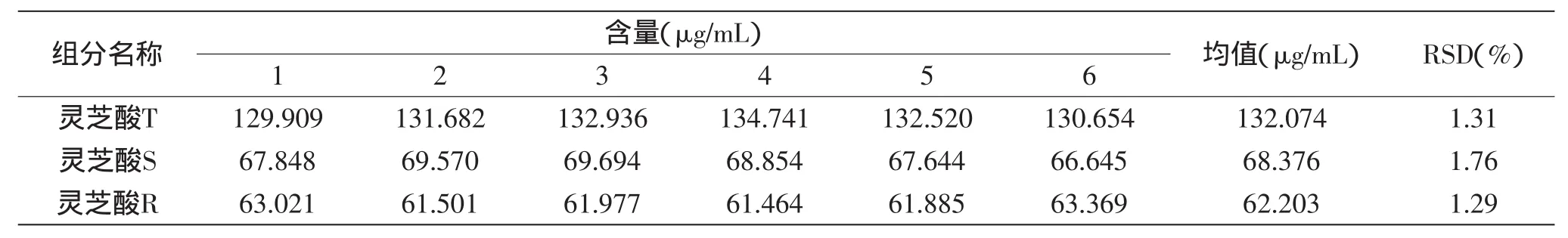
表4 重复性实验Table 4 Reproducibility of the measured results

表5 稳定性实验Table 5 Stability of the measured results
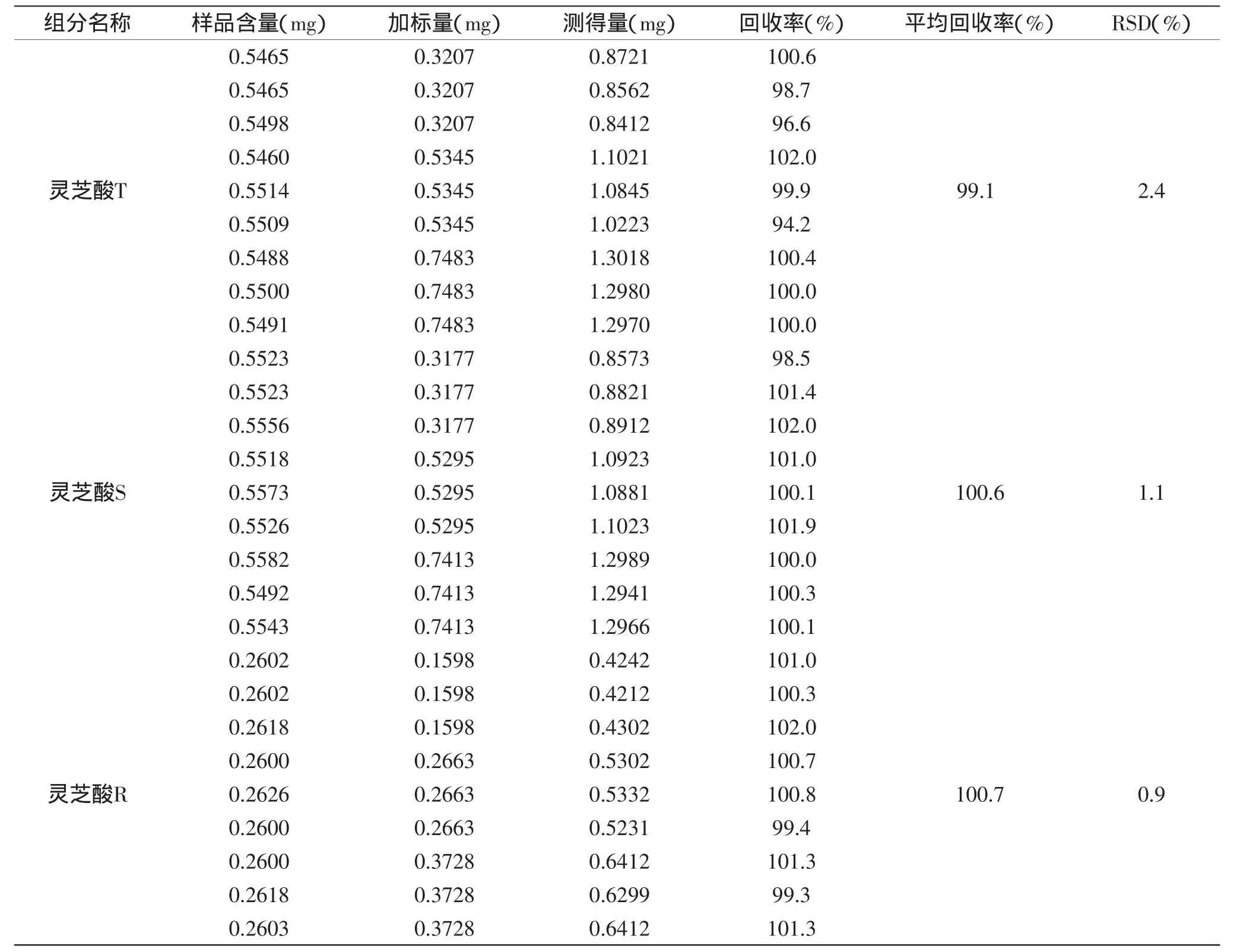
表6 加样回收率Table 6 Recoveries for the measured results

表7 不同灵芝菌丝体中灵芝酸的测定结果Table 7 Determination of ganoderic acids in different Ganoderma mycelium samples
3 结论
本研究确定了灵芝菌丝体三萜的提取方法和优化利用C18柱同时检测灵芝酸T、灵芝酸S和灵芝酸R的色谱条件,通过精密度、重复性和加样回收率的考察,表明本研究获得的HPLC方法符合作为检测方法的要求,适合灵芝发酵菌丝体中灵芝酸T、灵芝酸S、灵芝酸R的同时定量分析,是一种理想的灵芝菌丝体中三萜的定量分析方法。
[1]林志彬.灵芝的现代研究[M].北京:北京医科大学出版社,2001:1-327.
[2]唐文.发酵灵芝菌丝体中灵芝酸的分离纯化及其抗癌活性研究[D].上海:华东理工大学,2006.
[3]周月琴,杨晓彤,杨庆尧.灵芝三萜的药理活性研究进展[J].菌物学报,2005,24:303-305.
[4]Tang W,Liu JW,Zhao W,et al.Ganoderic acid T from Ganoderma lucidum mycelia induces mitochondria mediated apoptosis in lung cancer cells[J].Life Sciences,2006,80:205-211.
[5]Liu RM,Zhong JJ.Ganoderic acid MF and S induce mitochondria mediated apoptosis in human cervical carcinoma HeLa cells[J].Phytomedicine,2011,18(5):349-355.
[6]郭江红,赵亚萍.HPLC法测定复方甲苯咪唑片中甲苯咪唑和盐酸左旋咪唑的含量[J].中国药品标准,2010,11(3):219.
[7]张瑞丽,郝智慧,刘元元.HPLC法测定复方氯硝柳胺片的含量[J].中国兽药杂志,2012,46(7):34
[8]董虹玲,夏广萍,赵娜夏,等.HPLC法测定灵芝子实体和孢子粉中灵芝酸C2、灵芝酸G和灵芝酸A[J].现代药物与临床,2013,28(1):41-43.
[9]Wagner R,Mitchell DA,Sassaki GL,et al.Current techniques for the cultivation of Ganoderma lueidum for the production of biomass,ganoderic acid and polysaeeharides[J].Food Technology and Biotechnology,2003,41:371-382.
[10]徐军伟.在液体静置培养和振荡培养中单体灵芝酸的生产及差异表达基因的鉴定[D].上海:华东理工大学,2009.

