链球菌性乳房炎LAMP可视化检测方法的建立
,,,,,,,,
(广西大学动物科学技术学院,广西南宁 530005)
链球菌性乳房炎LAMP可视化检测方法的建立
贺婷,左宗辉,杨蓉,陈亚明,杜向宏,杜玉兰,阮氏青海,赵熠珩,何宝祥
(广西大学动物科学技术学院,广西南宁 530005)
目的应用环介导等温扩增(loop-mediated isothermal amplifcation,LAMP)技术,建立一种简便、快速检测链球菌性乳房炎致病菌的方法。方法本研究根据链球菌属细菌的特异性基因(tuf),设计一套LAMP引物,优化反应条件,进行特异性和敏感性实验。结果通过反应条件优化,该方法在水浴锅中1 h内即可完成全部反应,反应结果肉眼即可判定。对链球菌检测的敏感性最高达到52 fg/μL,是普通PCR方法的10倍,且与其它常见乳房炎致病菌无交叉反应。结论本研究成功建立了链球菌性乳房炎LAMP可视化检测方法,该法特异、快速、灵敏,操作及结果判定简便,设备要求低,适合基层兽医临床应用。
链球菌;环介导等温扩增;可视化检测;乳房炎
奶牛乳房炎是一种严重制约奶牛养殖业、乳品加工业健康发展,危害公共卫生安全及人类健康的疾病,有效预防和控制该病已成为国内外关注的焦点。无乳链球菌(Sreptococcus agalactiae, Group B Sreptococcus,GBS)、停乳链球菌(Sreptococcus dysgalactiae subsp. Dysgalactiae,Group C Sreptococcus,GCS)及乳房链球菌(Sreptococcus uberis)是引起奶牛乳房炎的常见致病菌,因抗生素治疗、产乳量下降以及对奶牛乳腺组织造成的不可逆损害,链球菌性乳房炎一直是奶牛业中高度流行、损失巨大的疾病[1]。尽管乳房链球菌及停乳链球菌被认为是专性动物病原菌[2-3],但无乳链球菌同时也能够感染人类,引起严重的侵袭性新生儿感染,感染孕妇、老年人,导致免疫力低下的成年人死亡[4-5]。因此,保障奶品质,严格控制链球菌性乳房炎的发生和流行,具有深远的经济影响与公共卫生学意义。
致病菌检测是乳房炎治疗和控制方案的一个重要部分,及时、准确地鉴别致病菌对治疗有直接影响。如链球菌性乳房炎致病菌对青霉素、氨苄青霉素等抗生素均敏感,治疗效果好[6]。因此,在临床中准确、快速的检测出链球菌性乳房炎,有助于在早期及时采取防治措施、避免抗生素滥用,提高乳房炎治愈率。
在临床实践中,链球菌属致病菌培养要求条件高、分离鉴定难度大、灵敏性低、耗时长;以分子生物学为基础的多项检测技术如普通 PCR[7]、实时定量PCR[8]、多重 PCR[9],方法快捷、灵敏,准确度较高。但是,这些现代检测方法均需要复杂的仪器设备和技术要求,成本高,不适合临床和基层现场检测,难以推广普及。
环介导恒温扩增(loop mediated isothermal amp-lifcation,LAMP)是日本学者Notomi等于2000 年建立的一种新型核酸扩增技术,在等温条件下进行的核酸变性和自动循环的链置换核酸扩增反应,其扩增效率可达109~1010个拷贝数,且整个反应在水浴锅或恒温金属浴中完成[10]。该方法灵敏、特异、简便、快速,结果判定方便、成本低廉,尤其适合在基层开展病原微生物的早期诊断和筛查。目前已在核酸研究,病毒、细菌及寄生虫等微生物的诊断与预防、动物胚胎的性别鉴定,转基因食品检测和法医学等诸多领域广泛应用[11]。
目前,国内外尚未见到使用LAMP技术可视化检测链球菌性乳房炎致病菌的报道。本研究针对链球菌属致病菌的保守基因设计出一套通用LAMP引物,并在反应前加入荧光染料钙黄绿素和螯合剂Mn2+,根据反应过程中产生的副产物与Mn2+结合后释放出钙黄绿素产生黄绿色荧光,从而可肉眼直接判读实验结果。这样就不需要实验室特殊设备,在牛场等基层单位可直接利用该技术,为奶牛乳房炎的快速诊断提供了方法与参考。
1 材料与方法
1.1 材料
1.1.1 菌株 无乳链球菌、表皮葡萄球菌、枯草芽孢杆菌和沙门氏菌为本实验室临床分离鉴定保存;停乳链球菌临床分离株由广西大学基础兽医实验室曾芸老师惠赠;乳房链球菌、金黄色葡萄球菌、大肠埃希氏菌、蜡样芽胞杆菌和猪链球菌2型为本实验室保藏菌株。
1.1.2 试剂 Bst DNA Polymerase、10×Bst Buffer购自New England Biolabs公司;甜菜碱(Betaine)、钙黄绿素(Calcein)购自Sigma公司;dNTP (10mM each)、DNA Marker、6×loading buffer购自北京全式金生物技术有限公司;2×Taq MasterMix购自康为世纪生物科技有限公司;MgSO4、MnCl2等其它化学试剂均为国产分析纯。
1.2 LAMP引物设计
根据GenBank公布的链球菌属保守序列tuf基因(AY266996),使用在线软件 Primer ExplorerV4(http∶//primerexplorer.jp/elamp4.0.0/ index.html)设计 LAMP 引物。引物由北京三博远志公司合成。
1.3 DNA模板制备
煮沸法制备DNA模板:取处于对数生长期的细菌纯培养物1 mL,10000 r/min离心10 min,弃上清;加1 mL无菌生理盐水重悬、洗涤菌体,离心10 min,弃上清;加入100μL TE溶液(10 mM Tris-HCl,1 mM EDTA,pH 8.0),悬浮沉淀,沸水浴20 min后,10000 r/min离心10 min,取上清液作为反应模板,-20℃保存备用。
1.4 LAMP反应的建立及条件优化
配制的LAMP反应体系为25μL,在经典反应体系的基础上,对以下反应条件进行摸索:1~5 μL dNTPs(10 mmol/L each,终浓度为0.4 ~2.0 mmol/L)、0~3.0μL MgSO4(100 mmol/L,终浓度 为0~12 mmol/L)、0~6μL Betaine(5 mol/L,终浓度为0~1.2 mol/L)、0.25~1.25μL 内引物(FIP 40μmol/L、BIP 40μmol/L,终浓度为FIP 0.4 ~2.4 μmol/L、BIP 0.4 ~2.4μmol/L)、1μL外引物(F3 5μmol/L、B3 5μmol/L,终浓度为F3 0.2μmol/L、B3 0.2μmol/L)、2.5μL10×Bst Buffer、1μL Bst DNA 聚合酶、1μL钙黄绿素Calcein(625μmol/L,终浓度为25μmol/L)1μL MnCl2(12.5mmol/L,终浓度为0.5mmol/L)和2μL模板DNA,超纯水补足至25μL。反应条件:温度按56℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃依次递增,反应时间60 min,80℃ 5 min灭活终止反应,按照上述反应体系及条件分别进行摸索优化。反应完成后取2μL扩增产物2%琼脂糖凝胶电泳,多次重复试验后根据扩增效果(有无特征性梯形条带出现及条带的亮度)进行分析筛选,最终获得最佳反应体系和条件。
1.5 结果判定
由于在反应之前已将荧光试剂(Calcein/ MnCl2)加入反应体系,故在反应结束后,肉眼在可见光或紫外光下直接观察反应液颜色变化,即可判定结果。或取2μL 扩增产物进行2%琼脂糖凝胶电泳,70V 50 min后观察结果。
1.6 特异性实验
按照优化好的LAMP反应体系,分别以无乳链球菌、停乳链球菌、乳房链球菌、金黄色葡萄球菌、大肠埃希氏菌、蜡样芽胞杆菌、枯草芽孢杆菌、沙门氏菌和白色念珠菌的粗提DNA为模板进行LAMP扩增,观察反应结果,验证方法特异性。
1.7 敏感性实验
将无乳链球菌DNA按10倍系列稀释为52.6 ng/μL、5.26ng/μL、526pg/μL、52.6pg/μL、5.26 pg/μL、526fg/μL、52.6fg/μL、5.26fg/μL和0.526fg/μL,按照最佳反应体系和最佳反应条件进行LAMP反应,观察扩增结果,确定最低检测限。
同时以常规PCR为对照,以相同的模板浓度进行PCR扩增(常规PCR扩增上游引物F:ATGGTAGTTAAAGTTGGTATTAACG,下游引物R:TTATTTAGCGATTTTTGCAAAGTAC,目的基因为链球菌属gapC,1011 bp,扩增产物1.5%琼脂糖凝胶电泳)。
2 结果
2.1 LAMP引物
通过在线引物设计软件,设计了一套链球菌属特异性的LAMP引物,引物序列见表1。
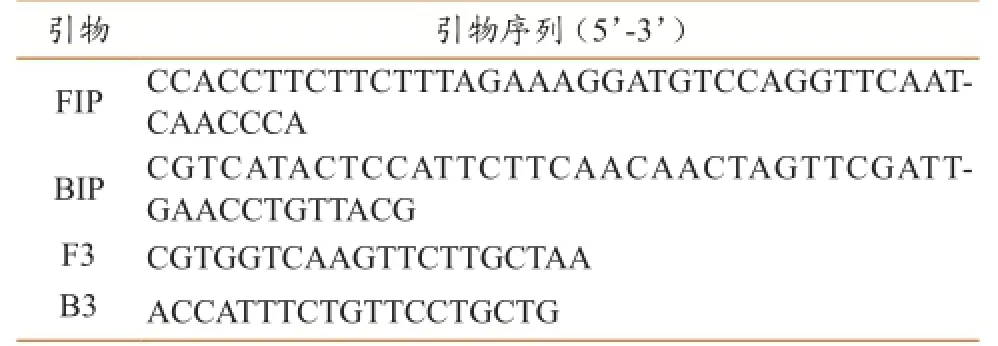
表1乳房炎链球菌属通用LAMP引物
2.2 反应条件优化结果
25μL LAMP反 应 体 系:3μL dNTPs(10 mmol/L each, 终 浓 度 为 1.2 mmol/L)、2μL MgSO4(100 mmol/L,终浓度为8 mmol/L)、4 μL Betaine(5 mol/L,终浓度为0.8 mol/L)、0.75 μL 内引物(FIP 40μmol/L、BIP 40μmol/L,终浓度为FIP 1.2μmol/L、BIP 1.2μmol/L)、1μL外引物(F3 5μmol/L、B3 5μmol/L,终浓度为F3 0.2μmol/L、B3 0.2μmol/L)、2.5μL 10×Bst Buffer、1μL Bst DNA 聚合酶、1μL钙黄绿素Calcein(625μmol/L,终浓度为25μmol/L)1μL MnCl2(12.5 mmol/L,终浓度为0.5 mmol/L)和2 μL模板DNA,超纯水补足至25μL。最佳反应条件:63℃反应60 min,80℃ 5 min灭活。
反应完成后,可见光下直接用肉眼观察反应管,若颜色变为绿色(翠绿色),为阳性反应;若颜色不变仍呈桔红色,则为阴性反应(见图1-A);紫外光下阳性反应液发出绿色荧光,而阴性反应液无明显荧光(见图1-B)。阳性反应物经2%琼脂糖凝胶电泳后,可观察到LAMP反应所特有的梯形条带(见图2)。

图1敏感性实验可视化LAMP图
2.3 特异性实验

图2 LAMP反应产物2%琼脂糖凝胶电泳检测结果
结果显示(图3),只有链球菌属菌(无乳链球菌、停乳链球菌、乳房链球菌)检测结果为阳性,而对金黄色葡萄球菌、大肠埃希氏菌、蜡样芽胞杆菌、枯草芽孢杆菌、沙门氏菌和白色念珠菌的检测均为阴性。说明本实验所设计的LAMP通用引物具有极强的特异性。

图3特异性实验可视化LAMP图
2.4 敏感性实验
结果如图1所示,所设计的LAMP特异性引物在最佳反应条件下,对链球菌属细菌DNA的最小检出限为52.6 fg/μL。
常规PCR对照组2%琼脂糖凝胶电泳观察结果如图4所示,得到PCR预期扩增片段大约为1011bp,常规PCR方法最小检测限为526 fg/μL。本实验建立的LAMP检测方法敏感性比常规PCR高10倍。
3 讨论
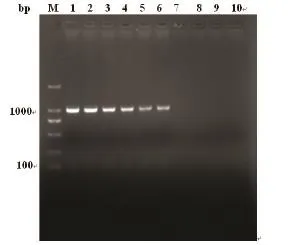
图4敏感性实验普通PCR电泳图
链球菌属细菌是奶牛乳房炎的主要致病菌之一,对奶牛健康、奶品质及产奶量等生产性能造成的影响巨大。同时,患病奶牛乳汁中含有大量体细胞等炎性因子、病原菌及其所产生的毒素等有害物质,误饮可直接危害人类健康,甚至诱发疾病。研究表明,链球菌性乳房炎致病菌对青霉素、氨苄青霉素、万古霉素、氯霉素、利福昔明、阿莫西林-克拉维酸、头孢唑林及头孢哌酮均敏感,而对氨基糖苷类(链霉素,庆大霉素)、大环内酯类(红霉素)、林可酰胺类和四环素类抗生素存在耐药性[6,12-13]。因此,及时、准确的鉴别链球菌属细菌,对链球菌性乳房炎的防控、减少抗生素滥用、公共卫生安全等均具有重要意义。
本实验首次采用LAMP技术,针对链球菌属保守基因(tuf)的6个特异区域设计了4条特异性引物,实验结果显示,LAMP技术在恒温条件下即可完成扩增反应,相较于传统的PCR方法,已经不再受昂贵仪器的限制;反应时间短,1小时内即可完成。敏感性与特异性实验结果显示,对于链球菌属细菌的检测,LAMP扩增的敏感性是传统PCR扩增技术的10倍,且特异性良好。
LAMP反应可扩增出大量的DNA,每50μL的反应体系内所扩增出的DNA量超过45μg[14]。同时也会产生大量的反应副产物焦磷酸镁白色沉淀,从而使反应液呈白色浑浊,离心可见白色沉淀[10]。然而当浑浊度较低时,肉眼不易察觉。故在反应液中加入染料,既能够提高LAMP反应结果的可视化识别率,又无需电泳,能够直接应用于疫病的现场诊断,是最为简单方便有效的结果判定方法之一。目前常见的方法是在反应结束后开盖加入SYBR Green I等荧光染料显色,缺点是易出现假阳性结果。原因有二:一方面,LAMP扩增产物量极大,开盖操作、枪头吸打液体引起反应管内空气摩擦流动,极易形成气溶胶污染实验环境。而气溶胶一旦出现则难以消除,从而造成假阳性;二,SYBR Green I等染料同样会与引物二聚体、气溶胶污染的双链DNA结合显色,造成结果误判。而使用Calcein/ MnCl2做荧光染料,不仅成本低,且只有在发生LAMP扩增反应时才会出现绿色(翠绿色),避免了假阳性干扰,降低了气溶胶污染的产生,具有更好的特异性,实现反应结果的可视化。因此,本实验在反应前配制LAMP反应液时就加入荧光试剂(Calcein/ MnCl2)。反应前钙黄绿素被Mn2+螯合,不发出荧光,反应液颜色为桔红色;随着特异性扩增反应的发生,从dNTP解离出的焦磷酸根与Mn2+结合,释放钙黄绿素,发出荧光,且扩增效率越高,荧光越强。此时,反应液颜色为绿色(翠绿色)。
本研究建立了能可视化检测链球菌性乳房炎通用LAMP检测方法,具有快速、灵敏、特异、简便、成本低廉等特点,对检验人员和实验设备无特殊要求,且结果通过肉眼判断即可。该技术有助于提高基层诊断实验室及兽医单位链球菌属致病菌的检测能力,对链球菌性乳房炎的早期准确诊断、防治有积极的意义,同时也为奶牛乳房炎快速诊断技术奠定了基础。
[1] Erskine R J, Wagner S, Degraves F J. Mastitis therapy and pharmacology[J]. Vet Clin North Am Food Anim Pract,2003,19(1): 109-138.
[2] Facklam R. What happened to the streptococci: overview of taxonomic and nomenclature changes[J]. Clin Microbiol Rev,2002, 15(4): 613-630.
[3] Vieira V V, Teixeira L M, Zahner V, et al. Genetic relationships among the different phenotypes of Streptococcus dysgalactiae strains[J]. Int J Syst Bacteriol, 1998, 48 Pt 4: 1231-1243.
[4] Bisharat N, Crook D W, Leigh J, et al. Hyperinvasive neonatal group B streptococcus has arisen from a bovine ancestor[J]. J Clin Microbiol, 2004, 42(5): 2161-2167.
[5] Brochet M, Couve E, Zouine M, et al. Genomic diversity and evolution within the species Streptococcus agalactiae[J]. Microbes Infect, 2006, 8(5): 1227-1243.
[6] Rato M G, Bexiga R, Florindo C, et al. Antimicrobial resistance and molecular epidemiology of streptococci from bovine mastitis[J]. Vet Microbiol, 2013, 161(3/4): 286-294.
[7] 王丽君,陈伟,张利莉. 奶牛乳房炎相关链球菌PCR检测方法的建立[J].畜牧与兽医,2010,42(10):7-10.
[8] Katholm J, Bennedsgaard T W, Koskinen M T, et al. Quality of bulk tank milk samples from Danish dairy herds based on real-time polymerase chain reaction identifcation of mastitis pathogens[J]. J Dairy Sci, 2012, 95(10): 5702-5708.
[9] Goli M, Ezzatpanah H, Ghavami M, et al. The effect of multiplex-PCR-assessed major pathogens causing subclinical mastitis on somatic cell profiles[J]. Trop Anim Health Prod,2012, 44(7): 1673-1680.
[10] Notomi T, Okayama H, Masubuchi H, et al. Loopmediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): E63.
[11] Mori Y, Kanda H, Notomi T. Loop-mediated isothermal amplification (LAMP): recent progress in research and development[J]. J Infect Chemother, 2013, 19(3): 404-411.
[12] Petrovski K R, Laven R A, Lopez-Villalobos N. A descriptive analysis of the antimicrobial susceptibility of mastitis-causing bacteria isolated from samples submitted to commercial diagnostic laboratories in New Zealand (2003-2006)[J]. N Z Vet J, 2011, 59(2): 59-66.
[13] Hendriksen R S, Mevius D J, Schroeter A, et al. Prevalence of antimicrobial resistance among bacterial pathogens isolated from cattle in different European countries:2002-2004[J]. Acta Vet Scand, 2008, 50(1): 28.
[14] Nagamine K, Watanabe K, Ohtsuka K, et al. Loopmediated isothermal amplifcation reaction using a nondenatured template[J]. Clin Chem, 2001, 47(9): 1742-1743.
Development of a Loop-Mediated Isothermal Amplifcation Assay for Visual Detection of Streptococci from Bovine Mastitis
He Ting,Zuo Zonghui,Yang Rong,Chen Yaming,Du Xianghong,Du Yulan,Ruan Qinghai,Zhao Yiheng,He Baoxiang
(College of Animal Science and Technology,Guangxi University,Nanning 530005)
ObjectiveTo develop a loop-mediated isothermal amplifcation (LAMP) assay for rapid detecting Streptococci from bovine mastitis.MethodsA set of specifc primers were designed according to the tuf gene sequences published in GenBank for LAMP assay,the reaction parameters were optimized and then specifcity and sensitivity were tested.ResultsThe results could be observed within an hour after optimization of the reaction conditions. The detection limit of this LAMP assay was 52 fg/μL,10 times sensitive than routine PCR assay and had no cross reaction with other pathogens of mastitis.ConclusionThis LAMP assay was specifc and sensitive for visual detection of Streptococci from bovine mastitis without expensive equipment. The LAMP assay could be a good alternative method for feld specifc diagnosis of Streptococci in grassroots veterinary stations and farms.
Streptococci;loop-mediated isothermal amplifcation;visual detection;mastitis
S858.23
:A
:1005-944X(2014)04-0085-05
国家自然科学基金,项目批准号:31260631;广西高校教改项目编号:GXTSZY141
何宝祥

