高致病性猪蓝耳病免疫金标试纸条的研制与应用
吴 斌,张秀云,屈 菲,郑 勇,苏 旺
(辽宁出入境检验检疫局,辽宁 大连 116001)
高致病性猪蓝耳病(HP PRRS)是由猪繁殖与呼吸综合征(俗称猪蓝耳病,PRRS)病毒变异株引起猪的一种急性、高热性、高致死性传染病。仔猪发病率可达100%、死亡率可达50%以上,母猪流产率可达30 %以上,育肥猪也可发病死亡。世界动物卫生组织(OIE)将高致病性猪蓝耳病列为法定报告动物疫病,我国列为二类动物疫病,加以重点防控[1-3]。尤其近年来高致病性猪蓝耳病的出现已经成为规模化猪场的主要疫病之一,给养猪业造成了巨大的经济损失。胶体金免疫层析试纸条技术是一种无需专业技术人员对微量样品即可检测的快速、简便、费用低廉、结果容易判定的检测方法[4]。本研究制备的高致病性猪蓝耳病抗原免疫金标试纸条具备敏感、特异的优势,同时大大缩短检测时间,仅十几分钟就可完成。这种快速便捷的检测高致病性猪蓝耳病的新型检测技术具备广阔的应用前景,尤其适用于基层兽医部门及相关实验室的快速检测。
1 材料与方法
1.1 细胞、毒株、临床样品和抗体
Marc-145细胞及高致病性猪蓝耳病病毒SD-4/2006分离株(HP-PRRSV/SD-4/2006)、PRRSV标准毒株、猪瘟病毒(CSFV)、猪传染性胃肠炎病毒(TGEV)、猪伪狂犬病病毒(PRV)、猪圆环病毒(PCV)均由本实验室分离、鉴定及保存;辽宁、上海、江苏、山东等地7个养殖场送检的60份猪肺脏、脾脏及淋巴结样品;纯化的抗HPPRRSV单克隆抗体及高致病性猪蓝耳病多抗血清由本研究课题制备提供。
1.2 试剂与材料
DMEM培养基购自Gibco公司;胎牛血清购自杭州四季青公司;柠檬酸钠(C6H5Na3O7·2H2O)、氯金酸(AuCl3·HCl·4H2O)、羊抗鼠 IgG二抗、牛血清白蛋白(BSA)购自美国Sigma公司;NaCl、KCl、KH2PO4、Na2HPO4均为国产分析纯;Tween20为化学纯;硝酸纤维素膜(NC膜)购自美国Whatman公司;玻璃纤维、吸水纸购自美国基因公司。
1.3 主要实验仪器
Biodot XYZ 3050三维喷点平台、Biodot CM4000试纸条切刀机,购自美国Biodot公司;高速冷冻离心机(德国Eppendorf公司);微波催化合成/萃取仪XH2100A购自北京祥鹄科技发展有限公司。
1.4 胶体金标记抗体的制备
40 nm胶体金颗粒的制备:将98 mL去离子水放入干净的锥形瓶中,用封口膜封住瓶口,放入微波合成仪中加热搅拌,温度上升到65 ℃,稳定2~3 min,快速加入1 %的氯金酸1 mL,设置参数到95 ℃,当温度上升到95 ℃,稳定2~3 min,快速加入1 mL 1%的柠檬酸三钠,反应约2~3 min,颜色发生变化直至呈酒红色,稳定3 min后取出,继续搅拌至室温。
金标抗体最适pH值的测定:取1.5 mL离心管,分别加入1 mL胶体金溶液,用0.1 mol/L K2CO3调pH值至7.0、7.5、8.0、8.5、9.0。取酶标板8孔,分别加入200 µL不同pH值的胶体金铺底,每孔再分别加10 µL单抗,震荡反应30 min后,每孔加20 µL 10% NaCl溶液,震荡反应15min。用酶标仪检测,在520 nm波长条件下,选择OD值最高的那一点处的pH值为最适的pH值。
金标抗体的最佳浓度确定:将纯化的高致病性猪蓝耳病病毒多抗稀释至0.2 mg/mL,取酶标板11孔,按表1顺序依次加入:每孔200 µL胶体金铺底,取不同体积多抗加入,去离子水补足体积。震荡反应30min后,每孔加入20 µL 10% NaCl溶液,震荡反应15 min。胶体金与抗体达到或超过最低稳定量的各孔仍保持红色不变,同时用酶标仪检测,在520 nm波长条件下,选择OD值稳定的含抗体量最低孔即为200 µL胶体金所需抗体的量。
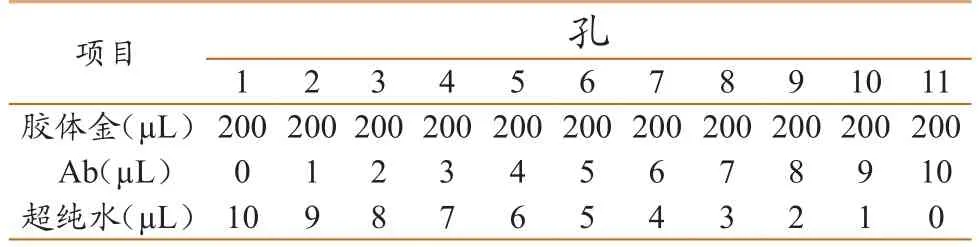
表1 胶体金标记抗体最低稳定量的测定
金标抗体的制备:用0.1 moL/L K2CO3调节1 mL胶体金溶液pH值至最适值。搅拌条件下,将最适抗体量缓慢加入胶体金溶液中,室温反应30 min,加入 600 µL 10 % BSA 封闭 30 min,12000 r/min离心30 min,弃上清,沉淀物用1 mL TBS(Tris-HCl 0.01 moL/L、0.02 % NaN3、1 %蔗糖、1 %BSA)混悬30 min,12000 r/min,4 ℃离心,弃上清,0.1 mL TBS重悬,4 ℃避光保存备用。
1.5 免疫层析试纸条的组装
样品垫、结合垫(含金标高致病性猪蓝耳病病毒多抗,干燥)、硝酸纤维素膜(检测线:HPPRRSV单克隆抗体1 mg/mL;质控线:羊抗鼠IgG二抗1 mg/mL),吸水垫依次贴在带有粘合剂的PVC背板上,切成4 mm宽的试纸条,室温干燥备用。
1.6 金标试纸条效果验证及结果判定
阴阳性检测试验:分别将200μL接种Marc-145细胞的HP-PRRSV/SD-4/2006液和无HPPRRSV/SD-4/2006的细胞培养液滴加到试纸条的样品垫上,查看结果是否与预期结果一致。
敏感性试验:按Reed-Muench法计算病毒TCID50。用试纸条对病毒增殖液进行检测,以能够出现阳性结果的最低TCID50病毒含量确定该试纸条的灵敏度。同时以纯化的灭活高致病性猪蓝耳病病毒(HP-PRRSV/SD-4/2006)为检测对象,先用稀释液10倍稀释,然后做系列倍比稀释,分别将倍比稀释的病毒液滴加到试纸条样品垫上,确定出现阳性结果的最低病毒含量。
特异性试验:3份不同稀释度的高致病性猪蓝耳病病毒(HP-PRRSV/SD- 4/2006)细胞培养液样品,样品标记为1、2、3;3份不同稀释度的PRRSV (ATCC VR2332)细胞培养液样品,样品标记为4、5、6;2份猪细小病毒细胞培养液样品,样品标记为7、8;2份猪伪狂犬病毒细胞培养液样品标记为9、10;2份猪流行性乙型脑炎病毒细胞培养液样品,样品标记为11、12。用组装的试纸条检测以上样品,验证其特异性。
重复性试验:将不同批次的试纸条分别检测5份阳性细胞培养液和5份阴性细胞培养液,每个样品重复检测3次。
稳定性试验:将高致病性猪蓝耳病抗原金标试纸条分别放在不同条件下贮存:37 ℃1周、4 ℃半年,每隔1月取出对相同的阳性与阴性参考样本进行测试。
临床样品的检测:将辽宁、上海、江苏、山东7个养殖场送检的60份猪肺脏、脾脏及淋巴结样品病料中加入5倍体积的PBS研磨,反复冻融三次,8000 r/min离心15 min,取上清,样品分为两份,一份按照农业部推荐的高致病性蓝耳病试剂盒的诊断方法(RT—PCR方法)进行检测,一份应用本研究制备的高致病性猪蓝耳病抗原金标试纸条方法检测,每份样品设置重复[4]。
2 实验结果
2.1 胶体金的表面特征
制备的胶体金溶液呈酒红色,透光性好。电镜下观察颗粒大小一致,分布均匀,平均直径约为40 nm(图1)。
2.2 最适pH值和最适抗体标记量的优选

图1 胶体金电镜结果
从图2和图3可以看出,当pH值在8.5左右,纯化的高致病性猪蓝耳病病毒多抗浓度为5 μg/mL时,金标抗体的OD520值最高,说明在此条件下,胶体金标记抗体的效率最高。因此我们选择pH 8.0~8.5和多抗浓度5μg/mL作为最佳实验条件。
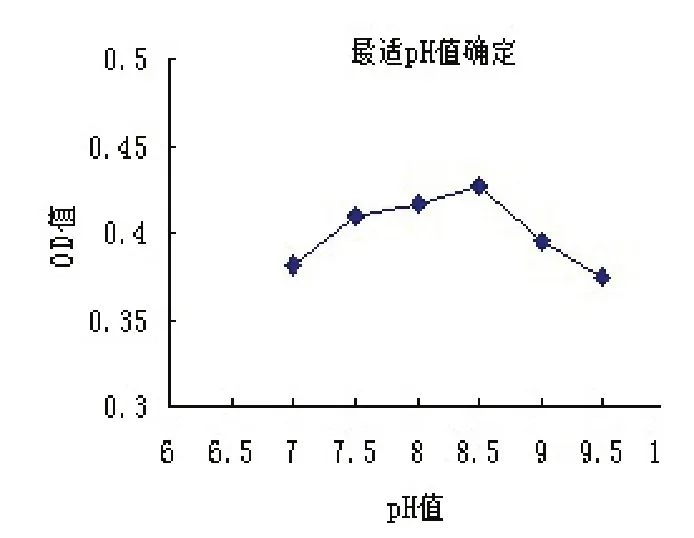
图2 最适pH值的确定

图3 金标抗体最佳浓度的测定
2.3 阴、阳性试验
HP-PRRSV/SD-4/2006细胞培养阳性液(1、2)的试纸条在检测线处和质控线处各出现一条红色条带,而滴加无HP-PRRSV/SD-4/2006的细胞培养液(3、4)的试纸条只在质控线处出现红色条带(图4)。试验证明:所研制的试剂条能准确地检测样品中是否含有高致病性猪蓝耳病。
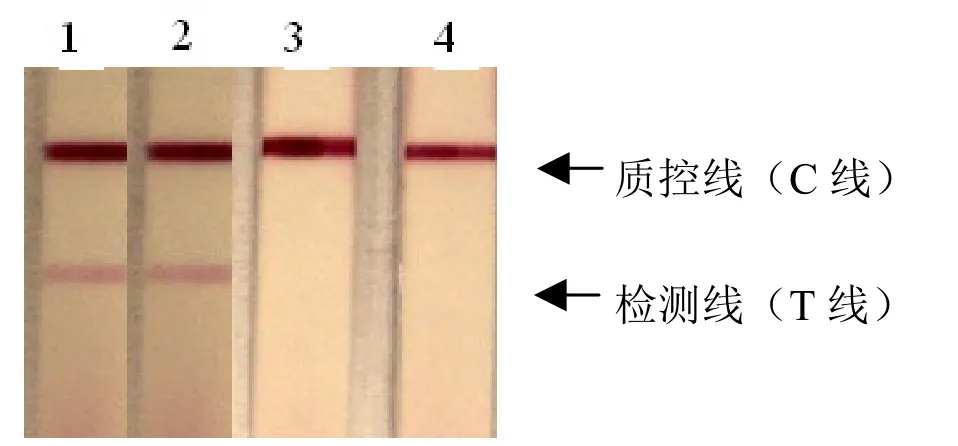
图4 阴阳性样品检测结果
2.4 敏感性试验
病毒接种后Marc-145细胞后培养3 d,待出现病变,按Reed-Muench法计算病毒TCID50。测定HP-PRRSV/SD-4/2006病毒的TCID50为10-8/mL。经试纸条检测,出现阳性结果的最低病毒含量为100 TCID50,以该值确定为高致病性猪蓝耳病免疫金标抗原试纸条的灵敏度检测限。同时应用该试纸条可检测到1:1280稀释倍数的病毒稀释液,病毒含量为0.214mg/L(表2)。

表2 金标试纸条敏感性试验
2.5 特异性试验
使用制备的金标试纸条检测12个待测样品,除与HP-PRRSV/SD-4/2006有较强的特异性反应外,与PRRSV(ATCC VR2332)也有部分的较弱反应,而与其他病毒样品均不反应(表3)。

表3 金标试纸条特异性试验
2.6 重复性试验
将不同批次的试纸条分别检测5份阳性样品和5份阴性样品,每个样品重复检测3次。结果显示不同批次的试纸条检测结果都一致,表明试纸条具有较好的重复性。
2.7 稳定性试验
用不同贮存条件下取出的试纸条,对相同的阳性与阴性参考样本进行检测,测试时PRRSV阳性与阴性结果均成立,同时对样品进行检测,结果表明不同贮存条件下的试纸条,显色程度与显色时间无明显差异,说明其稳定性较好。实验证实制备的试纸条可在4 ℃条件下至少保存半年。
2.8 临床样品检测结果
对送检的来自辽宁、上海、江苏、山东7个养殖场的60份猪肺脏、脾脏及淋巴结样品,分别应用试纸条和农业部推荐的高致病性蓝耳病诊断试剂盒的方法(RT—PCR方法)进行检测,结果显示,应用该高致病性猪蓝耳病抗原免疫金标试纸条检测出10份阳性样品,利用高致病性蓝耳病RT—PCR诊断试剂盒检测出11份阳性样品(图5),两种方法检测结果的符合率达91 %(10/11)。

图5 临床样品的RT—PCR检测结果
3 讨论
目前,高致病性猪蓝耳病主要检测方法为RT—PCR检测法和ELISA检测法,这两种检测方法都需要专业实验设备和相应的人员。而免疫金标试纸条检测法检测简便快捷,无设备和人员要求,具有更加广泛的应用性。
胶体金溶液可与多种生物大分子结合成稳定的复合物,已应用于血清学试验、细胞生物学及医学等领域。胶体金制备方法很多,但采用柠檬酸钠还原法制备单一粒度的胶体金颗粒效果较好。在制备胶体金过程中,影响因素很多,如使用的容器必须清洁,否则将导致金溶胶混浊或颗粒大小不匀;在试验中,对玻璃容器采用5’-二氯二甲硅烷的氯仿溶液硅化处理;还原剂柠檬酸钠必须一次性快速加入,搅拌均匀,一次制备的量不宜过多;试剂溶液均需用四蒸水配制,并用微孔滤膜过滤。制备的胶体金存放于4℃备用,及早标记,避免放置过程中出现自凝或细菌生长[4-5]。金溶胶与被标蛋白质的用量比例是影响标记成功与否的一个重要因素。因此,在每次标记时,都要测定二者具体的稳定点,以获得最佳标记率。
为了建立敏感可靠的高致病性蓝耳病胶体金免疫层析检测方法,本实验选用抗高致病性蓝耳病病毒的多抗,减少了非特异性反应,提高了反应的特异性,且多抗的制备简单而经济,抗体浓度高且反应灵敏。本实验制备的高致病性猪蓝耳病试纸条,与猪蓝耳病经典毒株PRRSV(ATCC VR2332)有部分较弱的反应,说明该试纸条在检测区分高致病性猪蓝耳病病毒和经典型猪蓝耳病病毒方面的精准性上,还需进一步的改进和完善。分析原因可能是高致病性猪蓝耳病是PRRSV (ATCC VR2332)NSP2基因存在30个氨基酸不连续缺失的变异株,同源性很高[6,7],易出现交叉反应。如针对变异基因设计制备金标单克隆抗体,会提高其特异性,但成本相应变高。试验结果表明,免疫金标试纸条是一种实验原料来源容易,可作为监测和诊断高致病性蓝耳病的常规手段,易于推广使用。但由于技术限制造成它的检测灵敏度低,尚不能实现定量检测,故这类免疫金标试纸条主要用以检测正常体液中是否存在的生物活性物质(如传染病的抗原及抗体),因此该方法目前常作为初期筛查,用于疾病的辅助诊断。
[1]刘业兵,郑杰,宁宜宝.高致病性PRRSV(HuN株)NSP2基因的扩增与分析[J].中国兽药杂志,2007,41(10):10-12.
[2]杨汉春.我国猪繁殖与呼吸综合征的流行现状与控制对策动态[J].当代畜禽养殖业,2004(5):112-115.
[3]孙庆申,仇华吉,童光志等.猪繁殖与呼吸综合征单克隆抗体研究进展[J].动物医学进展,2005,22(4):25-28.
[4]任先平.胶体金标记抗体技术[J].免疫学杂志,1989,5(1):62.
[5]崔尚金,姜建宏,周艳君.猪繁殖与呼吸综合征胶体金抗体检测技术的建立和初步应用[J].中国预防兽医学报,2005,27(3):213-216.
[6]Allende R,Lewis T L,Lu Z,et a1.North American and European porcine reproductive respiratory syndrome viruses different non-structural protein coding regions[J].Gen Virol,1999,80(2):307-315.
[7]童光志,周艳君,郝晓芳.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-326.

