生物转化法制备白头翁皂苷A3
曹 体 爽,刘 廷 强,王 东 明,金 凤 燮,鱼 红 闪
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
白头翁皂苷是中药白头翁重要的活性成分之一,其质量分数在8~10%。其中天然存在的大部分都是多糖基的皂苷,分子质量大,不易于人体吸收利用[1]。白头翁皂苷A3[2]是具有2个糖基的低糖基皂苷,有研究表明,白头翁皂苷A3可保护由于氰化钠及葡萄糖缺乏造成的细胞模型PC-12,减少细胞凋亡。应用流式细胞技术测得浓度分别为0.1、1、10mg/mL的白头翁皂苷A3均可以对细胞起到保护作用[3]。本实验室前期在白头翁皂苷的分离提取[4]、生物转化及其分离纯化[5]方面做了大量工作,发现了白头翁皂苷的提取方法以及对白头翁皂苷具有水解作用的酶。
本实验利用生物转化法,以白头翁总皂苷为底物,制备低糖基皂苷A3,并通过硅胶柱层析及结晶与重结晶等方法对产物白头翁皂苷A3进行精制,为制备高纯度的白头翁皂苷A3提供依据。
1 实 验
1.1 材料与仪器
中药白头翁,购于大连同仁堂药店,产地东北;白头翁A3标准品,广州暨南大学叶文才教授提供。菌种Absidiasp.P00r,由大连工业大学生物学院菌种保藏所提供;薄层层析板Silica Gel 60-F254;硅胶柱;Waters 2695高效液相色谱分析仪。
1.2 方 法
1.2.1 白头翁总皂苷的制备
根据文献[4]所述方法制备白头翁总皂苷。
1.2.2 酶液的制备
根据文献[6]所述方法制备酶液。
1.2.3 白头翁皂苷的生物转化
白头翁总皂苷用20mol/L pH 5.0的HAc-NaAc缓冲液配成质量分数为2%的酶反应底物,加入等体积酶液,40 ℃条件下于5L 反应釜中反应24h。反应液经AB-8脱糖、D-296脱色处理后浓缩蒸干,即得白头翁皂苷酶解产物。
1.2.4 硅胶层析分离白头翁皂苷酶解产物
取制得的白头翁皂苷酶解产物,以3倍样品质量的80~100目硅胶制成样品胶,15倍样品质量的300~400目硅胶做分离胶。用一定量的纯氯仿通柱,按照V(氯仿)∶V(甲醇)=9.5∶0.5、9∶1、8.8∶1.2、8.5∶1.5 依次进行洗脱。每200mL收集一瓶,并用TLC法跟踪检测。
1.2.5 结晶法纯化白头翁皂苷A3
将硅胶柱分离得到的含白头翁皂苷A3的组分溶于甲醇中,室温放置,自然挥发结晶,得到针状晶体。过滤收集针状物,再将针状晶体用甲醇加热溶解、过滤,不溶物单独收集,滤液放置室温下挥发重结晶,24h 后有针状晶体析出,积累到一定程度时,过滤收集晶体。
1.2.6 HPLC法检测白头翁皂苷A3的纯度
检测器为Waters 2996二极管阵列检测器,Empower 色谱工作站进行检测。色谱柱为Kromasil C18柱(5μm,φ4.6mm×200mm);进样量,10μL;柱温,35 ℃;体积流量,1.0mL/min;检测波长,205nm。
流动相:乙腈(A)-水(B);0~10min,φ(A)=20%~28%;10~20 min,φ(A)=28%;20~25min,φ(A)=28%~32%;25~40min,φ(A)=32%~40%;40~50min,φ(A)=40%~100%。
2 结果与讨论
2.1 白头翁总皂苷的制备及其生物转化
中药白头翁1 000g经70%酒精浸泡3次,浸提液合并浓缩,再经脱脂、脱糖、脱色后,蒸干洗脱液共得白头翁总皂苷98.6g,得率为9.86%。取白头翁总皂苷50.0g,经Absidiasp.P00r产的粗酶液转化后,经脱糖、脱色处理,得到产物总皂苷34.2g,得率为68.4%。TLC法检测酶水解白头翁总皂苷结果如图1所示。

图1 TLC检测白头翁总皂苷的生物转化结果Fig.1 Result of biotransformation of total pulsatilla saponins
2.2 硅胶柱层析法分离白头翁皂苷A3
利用硅胶柱层析法分离白头翁皂苷A3,根据TLC检测结果,分别收集较纯的各组分,收集情况如表1所示。

表1 白头翁总皂苷A3洗脱分离收集表Tab.1 Fractions of anemoside A3eluted from silica gel
经硅胶柱层析法分别获得了较纯的3种组分。由图2可以看出,3种组分在TLC板中均为单点,与标准品作对照,组分3为白头翁总皂苷A3。
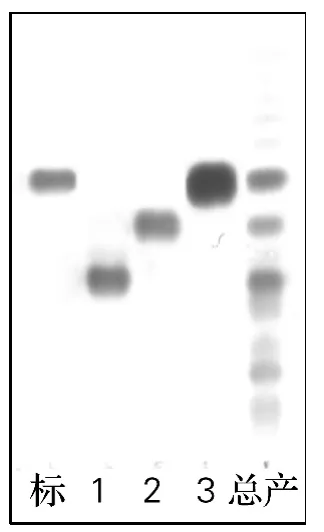
图2 白头翁总皂苷A3单点组分TLC图Fig.2 TLC result of anemoside A3pure fractions
采用HPLC 法检测组分3 中白头翁总皂苷A3的纯度,结果如图3所示。由图3可知,虽然组分3在TLC 上呈现单点,但是在HPLC图谱中显示出2 个吸收峰。其中出峰时间为45.384min与标准品白头翁皂苷A3的出峰时间相近,说明组分3中不仅含有白头翁皂苷A3,还含有一种与白头翁皂苷A3极性相近的物质。因此,需要对A3进行进一步精制。
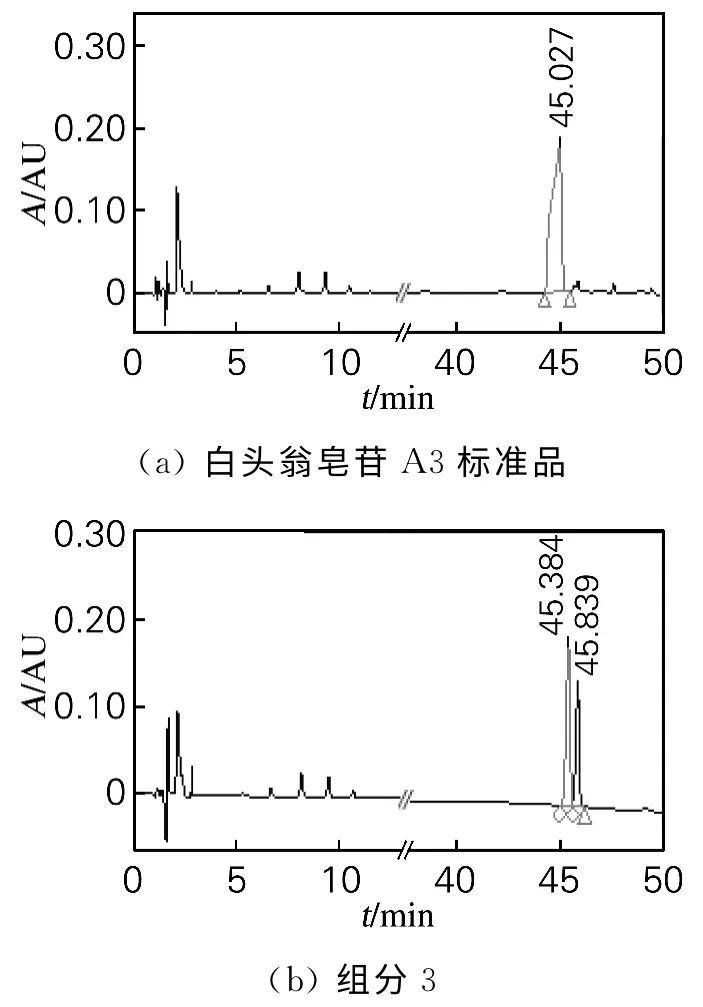
图3 HPLC法检测组分3中白头翁总皂苷A3的纯度Fig.3 HPLC result of standard of anemoside A3 and fraction 3
2.3 结晶法纯化白头翁皂苷A3
甲醇溶解硅胶柱分离得到的组分3,静置结晶,得到无色针状晶体。晶体经HPLC 检测,第一次结晶并未将组分3 中的2 种物质分开。因此,再用甲醇将第一次结晶得到的样品进行溶解,溶解过程中,发现有一部分白色沉淀物质并不溶解。将不溶于甲醇的部分单独收集、干燥,对不溶物进行HPLC检测,结果如图4所示。
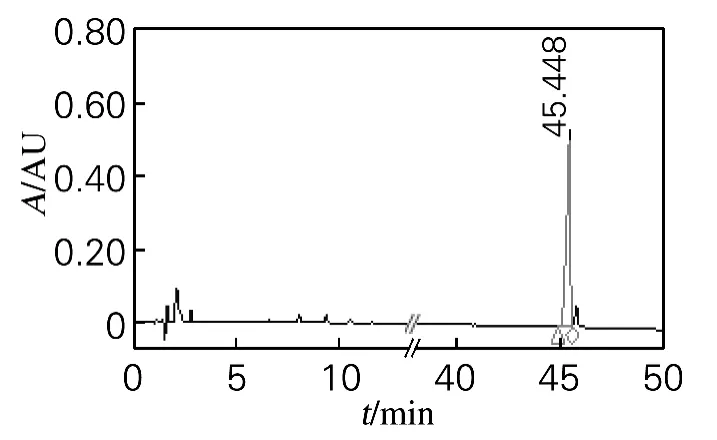
图4 组分3再次结晶产物的HPLC检测结果Fig.4 HPLC result of fraction 3recrystallization
与图3(a)对照可以看出,第二次甲醇溶解时,不溶解部分为白头翁皂苷A3(图4),质量为1.56g,得率为30.59%,纯度达到95.4%以上。硅胶柱分离得到的组分3,第一次甲醇完全溶解。而再结晶获得的晶体物质再用甲醇进行溶解时,大部分并未溶解,从而分离得到了白头翁皂苷A3。这可能是由于组分3中含有其他杂质,第一次结晶时,对白头翁皂苷A3起到了助溶的作用;同时说明组分3中另一种成分在甲醇中的溶解性更好。
3 结 论
50g白头翁总皂苷经生物转化,并经AB-8、D-296脱糖、脱色,可得酶解产物34.2g,得率为68.4%。采用硅胶柱层析法分离纯化白头翁皂苷A3,以V(氯仿)∶V(甲醇)=9∶1的洗脱剂洗脱出含白头翁皂苷A3及与其极性相近的物质的混合物,得率为15%。经结晶法可以制得纯度为95.4%白头翁皂苷A3,得率为4.56%,达到了对白头翁皂苷A3分离纯化的目的。
本实验以白头翁总皂苷为底物,利用生物转化法成功制备出纯度较高的低糖基白头翁皂苷A3。
[1]金凤燮.天然产物生物转化[M].北京:化学工业出版社,2009:123.
[2]陈文侃,林强,陈玲,等.中药白头翁的皂苷Ⅳ.主皂苷B4和A3 结构的研究[J].化学学报,1990,48(5):501-505.
[3]GAO Xiang-dong,YE Wen-cai,YU A C H,et al.Pulsatilloside A and anemoside A3protect PC12cells from apoptosis induced by sodium cyanide and glucose deprivation[J].Planta Medica,2003,69(2):171-174.
[4]刘琳,金凤燮.白头翁皂苷的分离提纯[J].大连轻工业学院学报,2004,23(1):18-21.(LIU Lin,JIN Feng-xie.Separation and purification of pulsatilla saponin[J].Journal of Dalian Institute of Light Industry,2004,23(1):18-21.)
[5]王伟,唐正军,鱼红闪,等.白头翁皂苷酶解产物的分离纯化[J].大连轻工业学院学报,2005,24(1):4-7.(WANG Wei,TANG Zheng-jun,YU Hong-shan,et al.Seperation and purification of Pulsatilla Saponin products by gradient elution and enzyme hydrolysis[J].Journal of Dalian Institute of Light Industry,2005,24(1):4-7.)
[6]杨宇,王东明,金凤燮,等.白头翁皂苷糖苷酶的纯化及其酶学性质[J].大连工业大学学报,2009,28(6):404-407.(YANG Yu,WANG Dong-ming,JIIN Feng-xie,et al.Purification of pulchinenoside-glycosidase and its enzymatic characteristics[J].Journal of Dalian Polytechnic University,2009,28(6):404-407.)

