黑籽瓜种子蛋白质的功能特性
邓芝串,张 超,张 晖,陆晓婷,王 立,钱海峰,齐希光
(1.北京市农林科学院蔬菜研究中心,北京100097;2.江南大学食品学院,江苏无锡214122)
籽瓜又称“打瓜”,外形与西瓜相似但比西瓜略小,味淡。籽瓜属葫芦科普通西瓜亚种的变种,分为黑籽瓜和红籽瓜两种,我国籽瓜主要产区为吉林、山西、内蒙古等地,年产量为百万吨以上[1]。籽瓜种子中蛋白质的含量36%~40%,其蛋白质含有丰富的必须氨基酸,除了赖氨酸外,其他几种必需氨基酸均达到或超过FAO(联合国粮农组织)规定的标准[2-3],是一种优质的植物蛋白质资源,在食品加工领域有着广阔的开发前景。以往,对籽瓜种子的研究多集中在促进其萌芽方法和其健康生产上。近年来,对籽瓜种子中油脂的研究也逐渐的展开,籽瓜种子中油脂的含量为45%左右,主要成分为亚油酸、棕榈酸和硬脂酸,亚油酸是人体无法合成的必需脂肪酸,具有降血压、调血脂,防止动脉硬化等功效[4]。张超等也采用水酶法优化了籽瓜种子中油脂的提取工艺[5]。但是对籽瓜种子中另一种重要成分——蛋白质的研究则较少,只有张玉秀等对其氨基酸和脂肪酸组成进行系统的评价和比较[2]、张超等优化水酶法提取籽瓜种子蛋白质的工艺[6]。本文以黑籽瓜种子为原料,采用碱溶酸沉法进行蛋白质的提取,制备黑籽瓜种子蛋白质,测定蛋白的热变性温度,并系统的研究pH、NaCl浓度和温度对蛋白功能特性的影响,不仅能为黑籽瓜种子蛋白在工业应用中提供理论指导,而且为黑籽瓜种子蛋白的深入研究打下基础。
1 材料与方法
1.1 材料与仪器
黑籽瓜种子 民籽一号,甘肃省民勤县金谷源农业科技有限公司;福临门一级大豆油 中粮集团;氯化钠、氢氧化钠、浓盐酸、浓硫酸、SDS、正己烷等 均为分析纯,国药集团化学试剂有限公司。
CR21GⅢ高速冷冻离心机日本日立公司;T6新世纪紫外分光光度计 北京普析通用仪器有限公司;冷冻干燥机 美国Laboconcor公司;Delta 320 pH计 梅特勒-托利多(上海)仪器有限公司;Q200差示扫面量热仪DSC 沃特世科技(上海)有限公司,配备TA Instruments-Waters LLC分析系统;T18 basic 19G分散乳化机 广东IKA科学仪器有限公司等。
1.2 实验方法
1.2.1 原料预处理 黑籽瓜种子手工去皮、粉碎、过60目筛,以正己烷按照料液比为1∶4(w/v)浸提,进行2~3次脱脂处理,经干燥后,放入密封袋,冷藏备用。
1.2.2 黑籽瓜种子基本成分的测定 水分含量的测定:GB/T 5009.3-2010采用常压干燥法进行;粗脂肪含量的测定:GB/T 5009.6-2003采用索氏提取法;灰分含量的测定:GB 5009.4-2010采用干法灰化法测定;粗蛋白含量的测定:GB/T 5009.5-2010采用凯氏定氮法进行。
1.2.3 黑籽瓜种子蛋白质的制备 脱脂后的黑籽瓜种子粉末按1∶10(w/v)的料液比加入去离子水,用0.5mol/L的NaOH溶液调解pH至11.5,61.5℃条件下搅拌水浴浸提77m in,3500r/m in离心15m in,取上清液调节pH至5.0使蛋白沉淀,8000r/min离心15min得到蛋白沉淀,用去离子水洗涤沉淀2~3次,调节pH=7,冷冻干燥得到黑籽瓜种子蛋白质[7]。
1.2.4 蛋白质热变性温度的测定 用配备热分析软件(TA Instryments-Waters LLC)的差示扫描量热仪(DSC)来测量蛋白质的热变性温度。将蛋白质按1∶4与去离子水混合,制成蛋白质浆,4℃下平衡过夜。取一定量浆状的蛋白质置于仪器配套的铝制埚内,以5℃/m in的速率,从70℃升温到110℃,进行扫描测量,同时以空埚做参比。最后用仪器配套的软件进行数据处理。
1.2.5 溶解度的测定 参考文献[8]的方法,并做了适当的修改,具体方法如下:取0.1g蛋白质溶解到10m L去离子水中,用0.5mol/L的HCl或0.5mol/L的NaOH调节来得到不同的pH,在一定的温度下搅拌30m in,每隔10min调一次pH,8000r/min离心30min,溶解度按式(1)计算。

1.2.6 持水性的测定 依据文献[9]的方法,并做适当的改动,具体方法如下:取3g蛋白样品与25m L的去离子水混合,每隔10m in搅拌一次,每次搅拌1m in,共搅拌6次。搅拌结束后3000r/m in离心25m in,将上清液移除,沉淀在50℃下干燥25m in称重,持水性按式(2)计算。

1.2.7 持油性的测定 依据文献[10]的方法,并做适当的改动,方法如下:取0.5g蛋白样品与6m L大豆油均匀混合,静置30min,3000r/min离心25min,将上清液移除,沉淀称重,持油性按式(3)计算。

1.2.8 乳化性及乳化稳定性的测定 依据文献[11]的方法测定,并做适当的修改,具体方法如下:取8m L的大豆油加入到24m L 0.1%的蛋白质溶液中,10000r/min均质1m in,形成均匀的乳液。在均质后的0min和10min分别移取50μL的乳液,加入到一个含有5m L 0.1%SDS(w/v)溶液的试管中,用分光光度计在500nm处测定吸光值,乳化性及乳化稳定性分别按式(4)和式(5)计算。
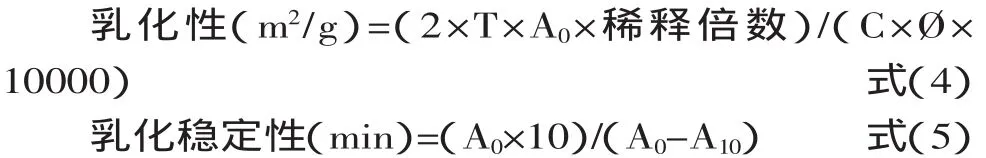
其中,T=2.303;C为蛋白质溶液的浓度;Ø为油相的体积比;A0为0min时在500nm处的吸光值;A10为10m in时在500nm处的吸光值。
1.2.9 起泡性及起泡稳定性的测定 依据文献[12]的方法测定,并做适当修改,具体方法如下:取0.5g的蛋白质溶于50m L的去离子水中,磁力搅拌30min,在分散机的程序3(大约10000r/m in)上均质2m in,转入100m L的量筒内分别测量,0min泡沫的体积V0和30m in后泡沫的体积V30,起泡性和起泡稳定性分别按式(6)和式(7)计算。

2 结果与分析
2.1 黑籽瓜种子主要成分的含量
黑籽瓜种子中各组分的含量如表1所示。
2.2 黑籽瓜种子蛋白质的热变性温度
图1黑籽瓜种子蛋白的DSC图谱中显示两个截然不同变性吸热峰,其对应的变性峰值温度分别是84.79℃和100.72℃。与Chun Liu和Xian sheng Wang等[13]在2008年报道的大豆分离蛋白7S的变性温度82.50℃和11S变性温度98.95℃相比,黑籽瓜种子蛋白质具有相对较好的热稳定性。据A li Abas Wani和Dalbir Singh Sogi[11]在2011年报道西瓜种子蛋白的DSC图谱也有两个截然不同的两个热变性峰。

表1 黑籽瓜种子的主要成分Table1 Main components of black seed-watermelon seed kernel
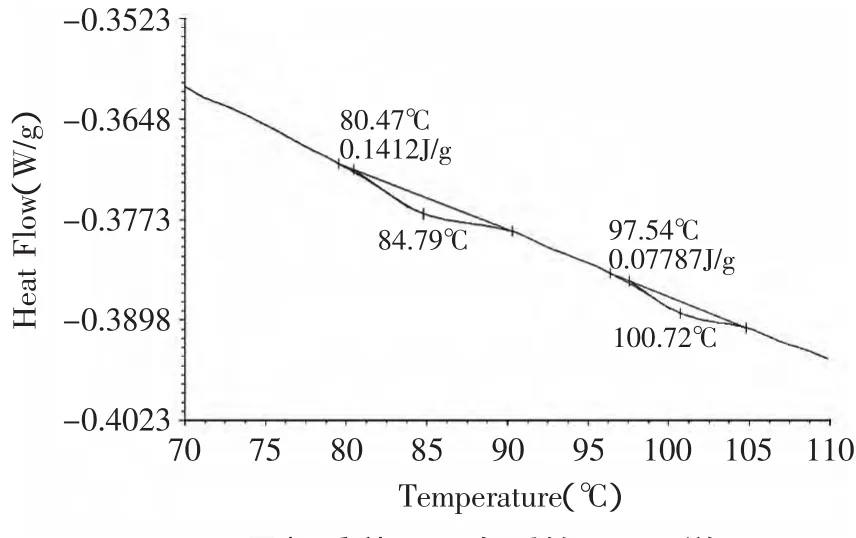
图1 黑籽瓜种子蛋白质的DSC图谱Fig.1 Thermograms of black seed-watermelon seeds protein by DSC
2.3 黑籽瓜种子蛋白的溶解度
由图2(A)可知,当NaCl浓度小于1mol/L时,黑籽瓜种子蛋白质的溶解度随着NaCl浓度的增加而增加,而当NaCl浓度大于1mol/L时蛋白质的溶解度随着NaCl浓度的增加而减小。这是因为当NaCl浓度处于较低水平时,NaCl的存在使蛋白质表面所带电荷增加,与水分子的结合力增强,使蛋白质的溶解度增加;然而当NaCl浓度过高时,过量的NaCl会与蛋白质争夺水分子,破坏蛋白的水化层,同时过量的NaCl离子又能中和蛋白表面的电荷,使原来稳定的体系变的不稳定,导致蛋白质的溶解度降低。
由图2(B)可知,黑籽瓜种子蛋白质的溶解度在等电点附近最低,只有1.5%。当蛋白处于偏离等电点的酸性或碱性环境时,其溶解度都呈增加趋势,并且在碱性环境下的溶解度高于酸性环境下的溶解度。是因为在等电点处,蛋白质表面所带正负的电荷为零,蛋白质分子之间的静电斥力最弱,由于疏水相互作用使导致蛋白质分子之间聚集沉淀。
由图2(C)可知,当温度处于30~80℃时,黑籽瓜种子蛋白质的溶解度随着温度的增加而增加。当温度大于80℃时,蛋白质的溶解度降低。这是因为在较低温度范围内,随着温度的增加,蛋白质的构象发生轻微的改变,立体构象伸展,与水分子之间的相互作用增强,溶解度增加,而由图1可知,当温度大于80℃时,蛋白质发生热变性,蛋白质分子的立体构象被破坏,内部的疏水基团暴露在分子表面,溶解度下降。
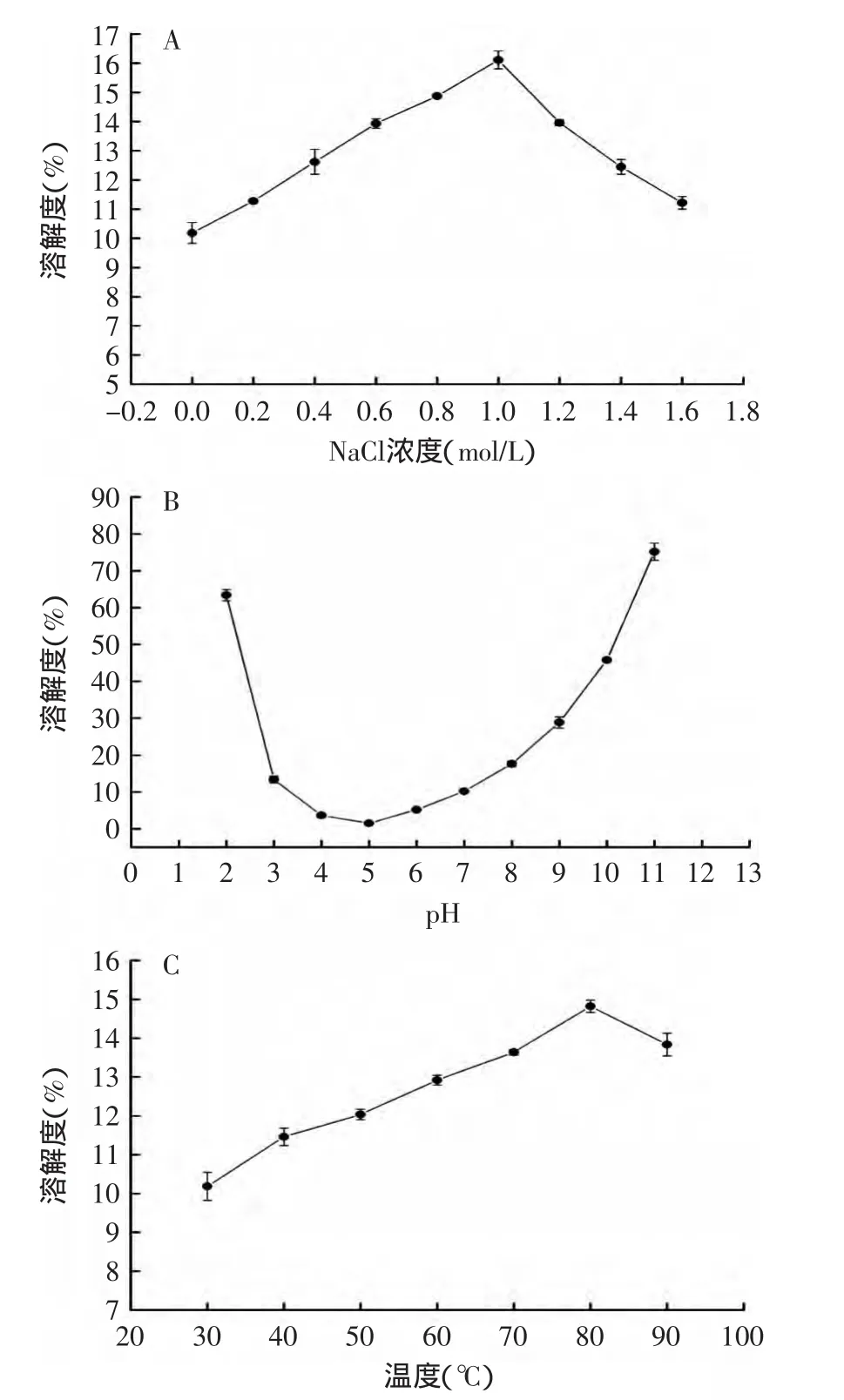
图2 pH、NaCl浓度、温度对溶解度的影响Fig.2 Effectof pH,NaCl concentration and temperature on solubility
2.4 黑籽瓜种子蛋白质的持水性
由图3(A)可知,当环境中NaCl浓度处于0~1.2mol/L时,黑籽瓜种子蛋白的持水性随着NaCl浓度的增加而增加。当NaCl浓度处于0~1.0mol/L时,发生“盐溶”现象,增加了蛋白与水的相互作用,蛋白的持水性增大;而当NaCl浓度处于1.0~1.2mol/L时,虽然此时盐离子浓度过高,中和了蛋白表面的小部分电荷,略微破坏了一些水化层,使蛋白质分子与水分子之间的亲和力减弱,持水性下降,但过高的盐离子能降低蛋白的溶解度,能减少溶于水而损失掉的蛋白的量,使沉淀下来的蛋白质增加,使实测的持水性增加。
由图3(B)可知,当pH从酸性环境逐渐靠近等电点时,黑籽瓜种子蛋白质的持水性逐渐降低,这是因为越靠近等电点,蛋白质分子表面所带的正负电荷越少,与水分之间的作用力越弱,持水性越差;当pH逐渐远离等电点而向碱性环境偏移时,蛋白质的持水性先增加后降低,这是因为,pH逐渐偏离等电点,蛋白质所带的电荷不断增加,与水分子之间的相互作用增强,持水性增加,但在较强的碱性环境下,虽然蛋白质带电荷增加,蛋白质分子与水的相互作用增强,但是此时蛋白质的溶解度大大的增加,使得实际测量持水性反而下降。
由图3(C)可知,在20~80℃的温度范围内,黑籽瓜种子蛋白质的持水性随着温度的升高而增加。这是因为,此时温度虽然升高但未达到蛋白质的变性温度,升温使蛋白质空间立体结构伸展,解离,有利于蛋白质分子与水分子的相互作用,使持水性增加。
图3 pH、NaCl浓度、温度对持水性的影响Fig.3 Effectof pH,NaCl concentration and temperature on water-holding capacity
2.5 黑籽瓜种子蛋白质的持油性

图4 温度对持油性的影响Fig.4 Effect of temperature on oil-absorbing capacity
由图4可知,当在10~30℃时,黑籽瓜种子蛋白质的持油性随着温度的升高而增加,30℃时持油性达到最高309.9g/100g;当温度高于30℃时,随着温度的升高,蛋白质持油性不断下降,这是因为,温度增加,油的粘度降低,流动性增加,蛋白质与油之间的吸附作用减弱,从而降低了蛋白质的持油性[14]。
2.6 黑籽瓜种子蛋白质的乳化性及乳化稳定性
蛋白质乳化性是指蛋白样品与油水结合在一起,形成乳状液的能力;乳化稳定性是指油水乳化液保持稳定的能力[15]。
由图5(A)可知,当NaCl浓度处在0~1.0mol/L的范围内,黑籽瓜种子蛋白的乳化性及乳化稳定性都随着NaCl浓度的增加而增加,当NaCl浓度为1.0mol/L时蛋白质的乳化性及乳化稳定性均达到最大分别为84.39m2/g和59.04m in;当NaCl浓度大于1.0mol/L时黑籽瓜种子蛋白质的乳化性及乳化稳定性均下降。原因是在低NaCl浓度下,参与乳化的蛋白质质量浓度大,由于电荷作用使蛋白质之间的静电斥力减小,使油滴更容易吸附在蛋白界面,但当NaCl浓度过高时,盐离子压缩了胶体的扩散双电层,破坏了静电复合物的形成,乳化能力下降[16]。
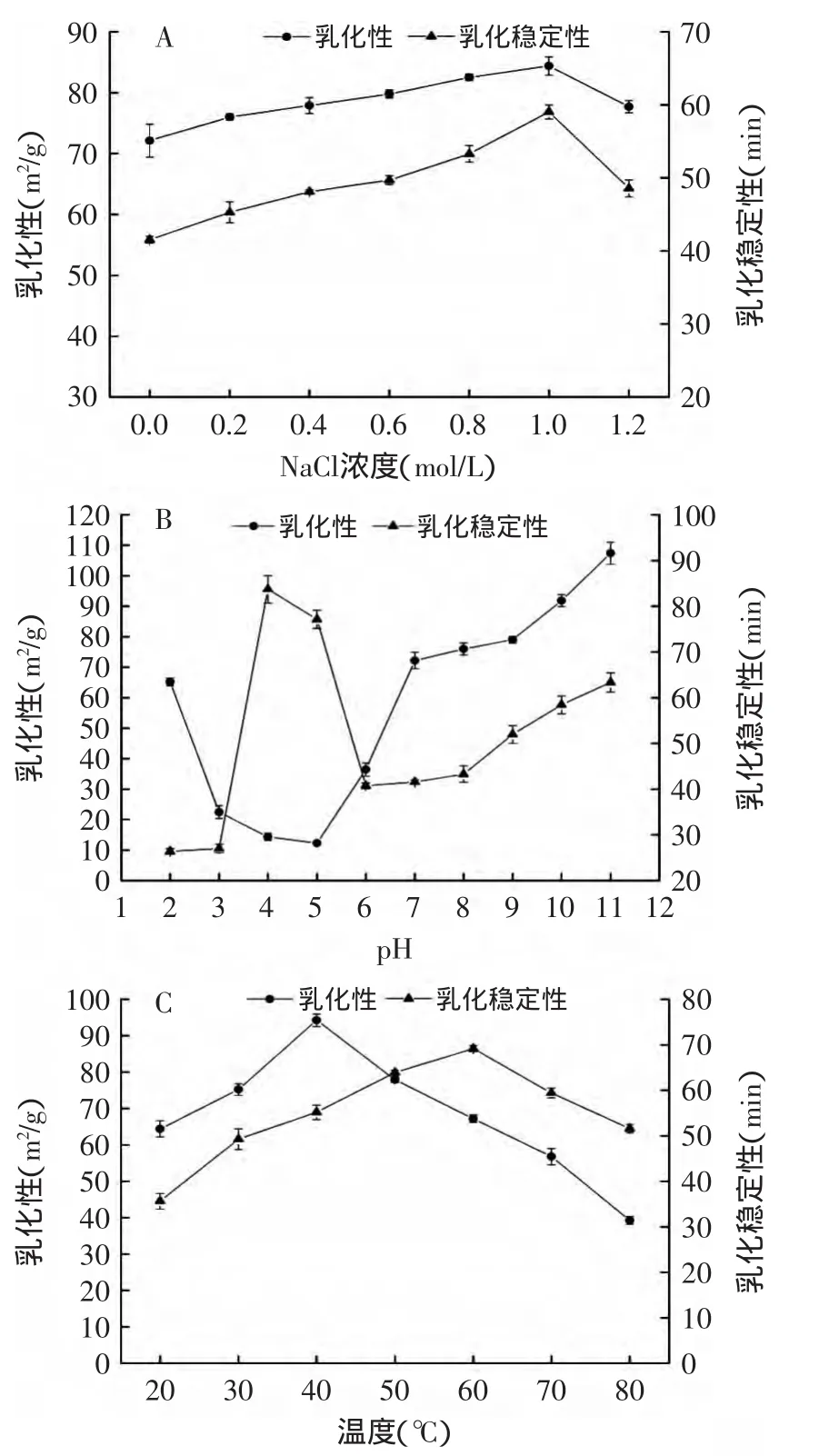
图5 pH、NaCl浓度、温度对乳化性及乳化稳定性的影响Fig.5 Effectof pH,NaCl concentration and temperature on emulsifying capacity and emulsion stability
由图5(B)可知,黑籽瓜种子蛋白质的乳化性在等电点附近最低,仅有12.28m2/g,乳化稳定性反而最好,达到83.72min。pH对黑籽瓜种子蛋白质乳化性的影响与pH对其溶解度的影响基本一致,这表明蛋白质乳化性与溶解度有密切关系。
由图5(C)可知,黑籽瓜种子蛋白质的乳化性及乳化稳定性随着温度升高均呈现先升高后降低的趋势,乳化性在40℃时达到最大值94.25m2/g,乳化稳定性在60℃时达到最大值69.16min。温度继续上升会使黑籽瓜种子蛋白质的乳化性及乳化稳定性下降,其原因是过高的温度会降低吸附在界面上的蛋白质膜的黏度和硬度,因而乳化性和乳化稳定性会降低[17]。
2.7 黑籽瓜种子蛋白质的起泡性及起泡稳定性
由图6(A)可知,当NaCl浓度处于0~0.4mol/L的的范围时,黑籽瓜种子蛋白质的起泡性随着NaCl浓度的增加而迅速增加,而当NaCl浓度在0.4~1.2mol/L时蛋白质起泡性逐渐趋于平稳。而起泡稳定性随着NaCl浓度的增加先降低后增加。这是因为NaCl的加入使得蛋白质的溶解度、黏度、展开和聚集状态发生变化,因而能改变起泡性质[18]。
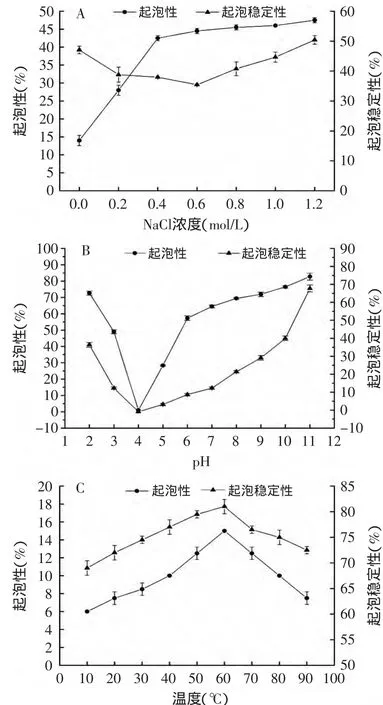
图6 pH、NaCl浓度、温度对起泡性及起泡稳定性的影响Fig.6 Effectof pH,NaCl concentration and temperature on foaming capacity and foam stability
由图6(B)可知,pH对黑籽瓜种子蛋白质起泡性的影响与pH对其溶解度的影响趋势基本一致,都呈“V”字型。蛋白质的起泡性和起泡稳定性在等电点附近均处于最小值,且泡沫大小不均匀,消失特别快。而在远离等电点时,特别是碱性范围时泡沫细腻均匀,稳定性较好。这是因为,蛋白起泡性与溶解度有密切的关系,在等电点处蛋白质聚集沉淀从而导致起泡性降低。而在远离等电点的酸碱环境中,蛋白质表面带有的正负,能增加蛋白溶解度和表面活性,从而使蛋白质的起泡性和起泡稳定性均得到改善[19-20]。
由图6(C)可知,在10~60℃的温度范围内,黑籽瓜种子蛋白质的起泡性和起泡稳定性都随着温度的增加而增加,并在60℃的时候达到最大值。当温度继续升高,蛋白的起泡性和起泡稳定性均下降。这是因为,适度的热处理会使蛋白分子伸展程度增大,提高其在水中溶解性,从而促进了蛋白质分子向气-液界面移动;当温度过高时,蛋白质趋于热变性,溶解度降低,另外高温又会导致蛋白质膜黏度降低、气泡破裂和泡沫解体,从而降低了蛋白起泡性和起泡稳定性[21]。
3 结论
黑籽瓜种子蛋白质具有相对较高的热变性温度,热稳定性较好。NaCl浓度、pH、温度等因素对黑籽瓜种子蛋白质的功能性质具有很大的影响:在较低的NaCl浓度范围(0~1mol/L)内,增加NaCl的浓度,黑籽瓜种子蛋白质的各项功性质均有明显的改善,但当NaCl浓度大于1mol/L时,继续升高浓度,会降低蛋白质的各项功能性质;温度对黑籽瓜种子蛋白质不同性质的影响不同,但是蛋白的各项功能性质都随着温度的升高先提高后降低,在50~60℃范围左右达到相对较好的状态,但当温度高于80℃后,继续升高温度,蛋白质的各项功能性质均下降;pH对黑籽瓜种子蛋白质的各项功能性质影响显著;在等电点4.5附近,除了乳化稳定性较好之外,黑籽瓜种子蛋白质的各项功能性质均较差,远离等电点,各种功能性质均得到改善。本实验探究了pH、温度和NaCl浓度对黑籽瓜种子蛋白质功能性质的影响,结果不仅可以应用于食品加工领域,改善黑籽瓜种子蛋白质的加工特性,还可以为深入研究黑籽瓜种子蛋白质的功能特性提供可靠依据。
[1]梁琪,蒋玉梅,张盛贵,等.甘肃省不同产地籽瓜瓤皮成分分析[J].甘肃农业大学学报,1999,34(1):79-83.
[2]张玉秀,赵文明.籽瓜种子蛋白质的氨基酸成分分析[J].果树科学,1992,9(4):231-233.
[3]El-Adawy TA,Taha K M.Characteristics and composition of different seed oils and flours[J].Food Chemistry,2001,74(1):47-54.
[4]郭华,侯冬岩,回瑞华,等.气相色谱—质谱法分析籽瓜中的化学成分[J].食品科学,2009,30(10):173-175.
[5]罗述博,张超,赵晓燕,等.水酶法提取籽瓜种子油脂工艺的优化[J].中国粮油学报,2012,27(12):73-77.
[6]张超,罗述博,赵晓燕,等.水酶法提取籽瓜种子蛋白质工艺的优化[J].食品工业,2012,33(12):21-24.
[7]张超,郭晓飞,李武,等.籽瓜种子蛋白质组成及其提取工艺优化的研究[J].中国粮油学报,2013,28(9):119-123.
[8]Horax R,Hettiarachchy N,Chen P Y,et al.Protein extraction optimisation,characterisation,and functionalities of protein isolate from bittermelon(Momordica charantia)seed[J].Food Chemistry,2011,124(2):545-550.
[9]Lqari H,Vioque J,Pedroche J,et al.Lupinus angustifolius protein isolates:chemical composition,functional properties and protein characterization[J].Food Chemistry,2002,76(3):349-356.
[10]Pedroche J,Yust M M,Lqari H,et al.Brassica carinata protein isolates:chemical composition,protein characterization and improvement of functional properties by protein hydrolysis [J].Food Chemistry,2004,88(3):337-346.
[11]Wani A A,Sogi D S,Singh P,et al.Characterization and functional properties of watermelon(Citrullus lanatus) Seed Protein Isolates and Salt Assisted Protein Concentrates[J].Food Science and Biotechnology,2011,20(4):877-887.
[12]张维农,刘大川,胡小泓.花生蛋白产品功能特性的研究[J].中国油脂,2002,27(5):60-65.
[13]Liu C,Wang X S,Ma H,et al.Functional properties of protein isolates from soybeans stored under various conditions[J].Food Chemistry,2008,111(1):29-37.
[14]薛蕾,李大文,尉芹,等.苦杏仁蛋白的功能特性[J].食品科学,2013,34(7):70-75.
[15]Fennema O R.食品化学[M].王璋,译.北京:中国轻工业出版社,2003.
[16]曾卫国.花生蛋白溶解性和乳化性的研究[J].农产品加工·学刊,2005,30(1):16-18.
[17]王芳,刘华,董梅红.桑叶蛋白的功能特性研究[J].食品科学,2010,31(11):81-86.
[18]Deng Q C,Wang L,Wei F,et al.Functional properties of protein isolates,globulin and albumin extracted from Ginkgo biloba seeds[J].Food Chemistry,2011,124(4):1458-1465.
[19]Mwanjala A M,Kharidah M,Jamilah B,et al.Influence of altered solvent environment on the functionality of pigeonpea(Cajanus cajan)and cowpea(Vigna unguiculata)protein isolates [J].Food Chemistry,2000,71(2):157-165.
[20]DiaelDin M R,Elfadil E.B,Abdullahi H E,et al.Fractionation,solubility and functional properties of cowpea(Vigna unguiculata)proteins as affected by pH and/or salt concentration[J].Food Chemistry,2004,84(2):207-212.
[21]张娜.棉籽饼粕蛋白提取分离及其功能特性研究[D].武汉:华中农业大学,2009.

