渗透压对于拟干酪乳杆菌发酵生产L-乳酸的影响
张 宁,田锡炜,王永红,储 炬,张嗣良
(华东理工大学生物反应器工程国家重点实验室,上海200237)
乳酸广泛应用于食品、制药、皮革、纺织工业以及化工原料方面,其最有前景的是用于合成可生物降解和具有生物相容性的聚合物,聚乳酸(PLA)[1]。基于乳酸在可持续资源方面的优势,越来越多的研究者将目光聚集在乳酸单体的生产上。近年来乳酸发酵生产的研究已经有了很大的进展,但是研究者们仍致力于寻求经济高效的发酵过程来生产乳酸[2-4]。
在影响乳酸发酵生产过程因素的研究报道中,底物及外界环境因素(如pH、通气和搅拌等)被证明能够影响乳酸菌的生长和乳酸生产。在多数有机酸发酵过程中,通常向发酵液中不断补入碱性中和剂来调节发酵液pH在合适的范围,从而有利于菌体生长和生产。但是连续补入碱性中和剂会引起发酵液中环境渗透压不断升高,这严重影响菌体的生长及产酸[5]。环境渗透压的增加往往会造成细胞生长速率和活性的降低并且影响细胞的代谢[6-10]。研究表明微生物本身具有多种渗透压应激响应机制来保护或减轻细胞受到的影响,这些机制包括自身合成可溶性溶质和渗透压保护剂[11-12]、代谢流的重新分布[13]以及细胞膜特性的改变[14-15]。海藻糖、甜菜碱以及脯氨酸通常作为渗透压保护剂,用于降低发酵过程中渗透应激对细胞的影响。Andersson等[16]向发酵培养基中添加甜菜碱来降低渗透应激对细胞的影响,使得发酵时间缩短了约32h。Xu等[17]报道了向培养基中添加1g/L脯氨酸后,细胞生长和丙酮酸产率分别增加了59%和14.3%。Purvis等[18]验证了大肠杆菌过量表达海藻糖能够促进细胞生长。工业菌株拟干酪乳酸杆菌在高糖及向发酵液中不断补入碱性中和剂的发酵情况下,观察到这些因素所造成的高渗透压对拟干酪乳杆菌生长及产酸产生了很强胁迫作用,为了降低渗透压对发酵的影响,通过比较海藻糖、甜菜碱以及脯氨酸三种渗透压保护剂,进而选择一种能够在高糖及补加碱性中和剂的拟干酪乳杆菌发酵过程中有效改善环境渗透压的保护剂,从而改善拟干酪乳杆菌工业菌株的发酵应用。
本文研究了渗透压对于L.paracasei发酵生产L-乳酸的影响,并筛选了一种渗透压保护剂来增加菌体的葡萄糖消耗速率及L-乳酸的产率。此外,通过分析胞外副产物的变化,讨论了渗透压保护剂对于L.paracasei发酵生产L-乳酸的作用。
1 材料与方法
1.1 材料与仪器
拟干酪乳酸杆菌 本实验室保藏,保存方法为菌种种子液、水、甘油以1∶2∶1的比例保存于-80℃;葡萄糖 上海惠兴生化试剂有限公司,分析纯;蛋白胨 化学试剂采购供应站,生化试剂;牛肉膏 上海蓝季科技发展有限公司,生化试剂;酵母膏 国药集团化学试剂有限公司,生化试剂;其他试剂 来源于国药集团化学试剂有限公司,分析纯。
UV-VIS-752分光光度计 上海菁华科技仪器有限公司;SBA-40D生化分析仪 山东省科学院;5L玻璃发酵罐 上海国强生化工程装备有限公司;pH计 美国Mettler Toledo公司;分析天平 上海天平仪器;回转式恒温调速摇瓶柜 上海欣蕊自动化设备有限公司制造;FM-8P全自动冰点渗透压计 上海医大仪器厂;安捷伦1100HPLC 美国安捷伦科技。
1.2 培养基
茄子瓶斜面培养基(g/L):蛋白胨10,牛肉膏6,酵母浸提物10,磷酸氢二钾2,柠檬酸二胺2,乙酸钠4,葡萄糖40,硫酸镁0.2,硫酸锰0.2,琼脂18,吐温-80 1m L,碳酸钙10,NaOH调pH 6.0,115℃灭菌20m in。
摇瓶种子培养基(g/L):蛋白胨10,酵母膏10,牛肉膏10,硫酸镁0.2,硫酸锰0.2,氯化钠0.03,硫酸亚铁0.01,乙酸钠4,柠檬酸二胺2,磷酸氢二钾2,吐温-80 1m L,碳酸钙25,NaOH调pH 6.0,115℃灭菌20m in。葡萄糖(40g/L)单独分开灭菌,115℃灭菌20m in。
摇瓶发酵培养基(g/L):蛋白胨13.33,酵母膏13.33,硫酸镁0.0133,硫酸锰0.0133,氯化钠0.0133,硫酸亚铁0.0133,醋酸钠0.67,碳酸钙40,NaOH调pH6.0,115℃灭菌2min。葡萄糖(90g/L)单独分开灭菌,115℃灭菌20m in。
5 L罐培养基(g/L):蛋白胨13.33,酵母膏13.33,硫酸镁0.0133,硫酸锰0.0133,氯化钠0.0133,硫酸亚铁0.0133,醋酸钠0.67。115℃灭菌20m in。葡萄糖(200g/L)单独分开灭菌,115℃灭菌20m in。
1.3 实验方法
1.3.1 种子培养 用水刮洗茄子平斜面后按15%的接种量接至摇瓶种子中进行培养,转速为100r/m in,温度为37℃。
1.3.2 摇瓶发酵培养 将培养至对数期的摇瓶种子按20%的接种量转接至发酵培养基中,转速为100r/m in,温度为37℃。
1.3.3 5L罐批培养 本实验采用5L搅拌式反应器进行批培养发酵,工作体积为4L。转速,通气和温度分别为150r/m in,0.025vvm和37℃,发酵过程中适用25%氨水控制发酵液pH 6.0,接种量为20%。
1.3.4 发酵上清液的制取 取10m L发酵液5000r/m in 10m in离心得上清,将上清稀释到合适浓度,检测前过滤上清液。滤液用于检测渗透压、葡萄糖、L-乳酸及副产物。
1.3.5 指标的测定
1.3.5.1 生物量的测定 采用比浊法,在620nm处用紫外分光光度计测定。本文用OD620nm来表征细胞生物量。
1.3.5.2 发酵液中渗透压、葡萄糖、L-乳酸及副产物的检测 渗透压:通过FM-8P Auto.F.P.渗透压仪进行检测。
L-乳酸:通过SB-40C生物传感分析仪进行检测。
葡萄糖:通过葡萄糖试剂盒进行检测。
胞外副产物:包括丙酮酸、甲酸、乙酸以及乙偶姻通过HPLC(安捷伦1100,美国安捷伦科技)进行检测。检测条件:采用Metacarb H Plus柱(300mm×7.8mm;Varian Inc.,PaloA lto,CA,USA)进行样品分离。工作温度为50℃,样品用5mmol/L的H2SO4以0.4m L/m in进行洗脱,并在210nm处UV检测器仪进行分析。
1.4 实验设计
1.4.1 渗透压对于L.paracasei生产L-乳酸的影响 向培养基中分别添加浓度为0、0.5、1.0、1.5、2.0mol/L的NaCl作为渗透压调节剂,将细胞在含不同浓度的NaCl,初始葡萄糖为90g/L摇瓶内37℃培养24h来研究渗透压对L.paracasei生长及产酸的影响。发酵结束后通过测定乳酸量、残糖量来观察渗透压对L.paracasei生产L-乳酸的影响。
1.4.2 渗透压保护剂的选择 向培养基中添加1mol/L的NaCl来产生一定的渗透压,为了降低L.paracasei发酵过程中的渗透压,实验中比较了海藻糖、甜菜碱和脯氨酸三种渗透压保护剂对乳酸发酵中渗透压的影响。将菌体分别在初始葡萄糖浓度为90g/L左右、含指定浓度NaCl及指定浓度不同渗透压保护剂的摇瓶内37℃培养24h,发酵结束后通过检测乳酸、残余葡萄糖、OD620nm来判断最合适的渗透压保护剂。
1.4.3 5L罐验证脯氨酸对于L.paracasei发酵生产L-乳酸的作用 本实验在5L搅拌式生物反应器中进行批发酵来验证脯氨酸对细胞生长和乳酸生产的作用。通过比较菌体在初始葡萄糖浓度200g/L,37℃培养,发酵24h后添加和未添加脯氨酸情况下菌体生长、乳酸生产、葡萄糖消耗以及有机酸生产来验证脯氨酸作为渗透压保护剂的有效性。
1.5 计算公式
乳酸平均生产速率(g/(L·h))=乳酸生成量(g/L)/发酵时间(h);
葡萄糖平均消耗率(g/(L·h))=葡萄糖消耗量(g/L)/发酵时间(h)。
1.6 数据处理
本文中所有数据均取自三组平行实验的平均值,采用Origin 8.5软件进行图形处理。
2 结果与讨论
2.1 渗透压对于L.paracasei生产L-乳酸的影响
本实验采用NaCl作为渗透压调节剂来研究渗透压对L.paracasei生长及产酸的影响(图1)。同样的发酵条件下,菌体生物量、乳酸产量和葡萄糖消耗量随着培养基中NaCl浓度的增加而迅速下降。乳酸产率从2.78g(/L·h)降至0.31g(/L·h),葡萄糖消耗率从2.47g(/L·h)降至0.08g(/L·h)。当NaCl浓度从0增加到1mol/L时,虽然菌体生物量大大下降,幅度达到39.8%,但是乳酸量仅降低了12.2%。而当发酵培养基中NaCl浓度超过1mol/L时,细胞生长和产物形成明显被抑制了。当发酵培养基中NaCl浓度为1.5mol/L时,细胞菌体及乳酸分别仅为NaCl 1mol/L时的53.9%和47.19%。当发酵培养基中NaCl浓度为2mol/L时,细胞生长已经终止,几乎无乳酸产物形成。因此在接下来的实验中,选择1mol/L NaCl作为渗透压保护剂的筛选条件进行研究。

图1 渗透压对L.paracasei发酵生产L-乳酸的影响Fig.1 Influence of the osmotic stress on L-lactic acid production by L.paracasei
2.2 渗透压保护剂的选择
渗透压保护剂是一种小分子,它有助于保持膜的完整性和蛋白的稳定性,从而保证细胞能够在极端渗透压下存活。微生物可自身合成渗透压保护剂或者从培养基中摄取[19-20]。发酵过程中常用的渗透压保护剂有海藻糖、甜菜碱和脯氨酸。为了降低L.paracasei发酵过程中的渗透压,本文比较了海藻糖、甜菜碱和脯氨酸三种渗透压保护剂对乳酸发酵中渗透压的影响。实验中通过向培养基中添加1mol/L的NaCl来产生一定的渗透压(表1)。
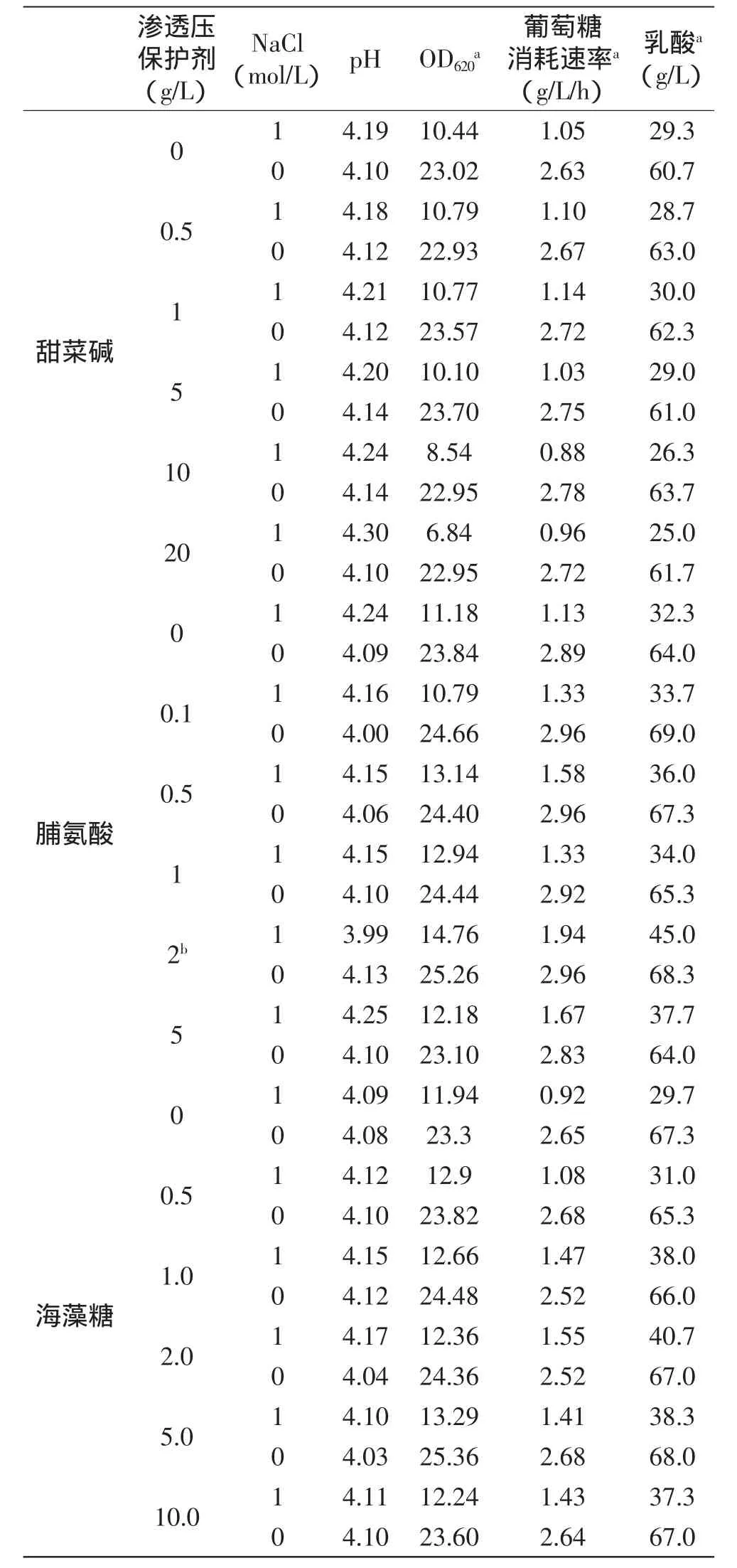
表1 添加不同浓度渗透压保护剂的发酵结果Table1 Fermentation resultswith different concentrations of osmoprotectants
从表1可以看出,发酵24h后,加入1mol/L NaCl的实验组其细胞生长、乳酸生产和葡萄糖消耗要明显低于未加NaCl的对照组。同时渗透压保护剂的加入能在一定程度上减轻对L.paracasei生长和生产的影响,特别是脯氨酸和海藻糖,其作用要明显优于甜菜碱。同时可以发现高浓度(10、20g/L)的甜菜碱对于L.paracasei生长和生产具有一定的抑制作用,这可能因为本身高浓度的甜菜碱也会产生一定程度的渗透压,从而对细胞生长和代谢造成影响。综合考虑菌体生长,乳酸生产和葡萄糖消耗,在1mol/L的渗透应激条件下,添加2g/L脯氨酸最有利于L.paracasei生长和生产,其发酵24h后,菌体生物量、乳酸产量和葡萄糖消耗速率分别为未添加脯氨酸实验组的1.39、1.36、1.72倍。因此在接下来的实验中,选择2g/L脯氨酸作为渗透压保护剂进行研究。
2.3 5L罐验证脯氨酸对于L.paracasei发酵生产L-乳酸的作用
本实验在5L搅拌式生物反应器中进行批发酵来验证脯氨酸对细胞生长和乳酸生产的作用(图2)。图2为初始葡萄糖浓度200g/L,发酵24h后添加和未添加脯氨酸情况下菌体生长、乳酸生产和葡萄糖消耗过程。
从图2中可以看出,整个发酵过程可以根据产乳酸速率分为3个阶段,分别为阶段I(0~24h,产酸快速),阶段II(24~35h,产酸较慢)和阶段III(35~60h,产酸几乎停滞)。因此选择在24h后加入2g/L的脯氨酸,这是因为在此时产酸速率明显减缓,同时在以前的实验中发现此时发酵液中渗透压与上面所述摇瓶中加入1mol/L NaCl后的初始培养基渗透压较为接近(数据未显示)。在阶段Ⅰ,由于实验组(24h加入脯氨酸)和对照组(24h未加脯氨酸)的发酵条件完全一致,因此菌体生长、产酸和耗糖都较为一致。当进入阶段Ⅱ后,虽然菌体生物量没有大的差异,但是添加了脯氨酸的实验组菌体的产酸和耗糖与对照组相比发生了明显变化。在阶段Ⅲ中,两组的产酸都几乎停滞,而且耗糖速率也大大降低,这可能是由于渗透压到达了一定的高度,此时脯氨酸对于细胞的保护作用也已经大大减弱。

图2 添加脯氨酸和未添加脯氨酸条件下,L.paracasei在5L罐中细胞生长,乳酸生产和葡萄糖消耗对比Fig.2 Fermentation progresses of cell growth,L-lactic acid production and glucose consumption by L.paracasei in a 5L bioreactorwith orwithout proline addition
表2,可知阶段Ⅱ中对照组与实验组产酸及耗糖的差异,该阶段实验组的产酸速率为2.18g(/L·h),耗糖速率为3.56g(/L·h);而对照组的产酸速率率为1.45g(/L·h),耗糖速率为2.55g(/L·h),分别增加了50.34%和39.61%。
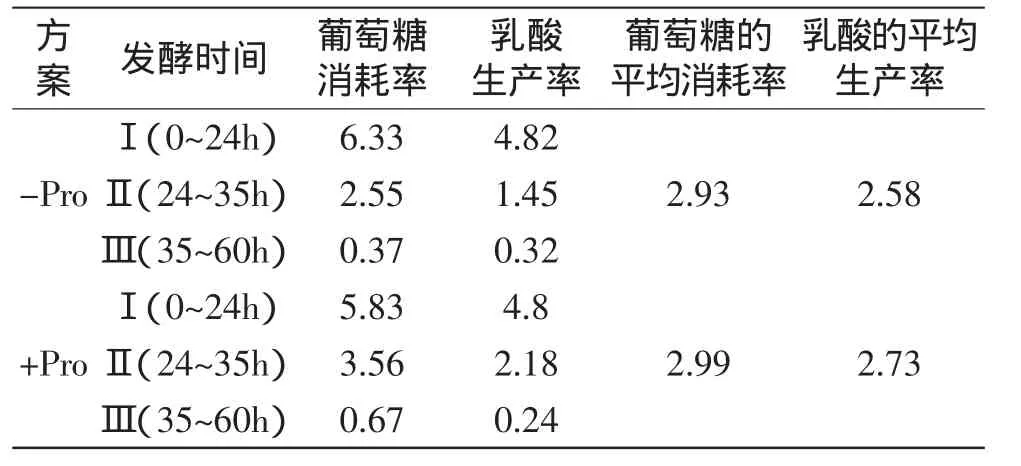
表2 脯氨酸添加和未添加条件下,L.paracasei生理参数的比较(g/(L·h))Table2 Comparison of physiological parameters on L.paracasei with orwithout proline addition(g/(L·h))
此外,脯氨酸的加入对其他胞外副产物的形成也有影响。从表3中可以看出,发酵结束时实验组中的丙酮酸、乙酸以及乙偶姻产量分别比对照组降低了42.3%、17.6%、38.8%,这可能是脯氨酸的加入有利于胞内代谢流由副产物途径流向乳酸途径。

表3 脯氨酸添加和未添加条件下胞外副产物的比较Table3 Comparison of extracellular byproductswith or without proline addition
从以上实验结果可以看出,脯氨酸能够在一定范围内有效调控细胞对环境渗透压的应激响应,有利于菌体的产酸和耗糖。
3 结论
本文研究了环境渗透压对于L.paracasei生产L-乳酸的影响,结果表明菌体生长和代谢随着环境渗透压的增加受到显著抑制。通过筛选三种渗透压保护剂,发现2g/L脯氨酸能够有效缓解高环境渗透压对于菌体的抑制。在5L罐批培养过程中,随着脯氨酸的加入,乳酸产率和耗糖率分别比未添加脯氨酸的对照组增加了50.34%和39.61%。同时胞外主要副产物的对比分析表明脯氨酸的添加能够一定程度上改变代谢流由副产物途径流向乳酸途径。本文通过添加渗透压保护剂提高了乳酸的生产,进而也对于其他有机酸发酵具有重要的借鉴意义。
[1]Md Altaf,BJNaveena,M Venkateshwar,et al.Single step fermentation of starch to L(+)lactic acid by Lactobacillus amylophilus GV6 in SSF using inexpensive nitrogen sources to replace peptoneand yeastextract-Optimization by RSM[J].Process Biochemistry,2006,41(2):465-472.
[2]Datta R,Henry M.Lactic acid:recent advances in products processes and technologies-a review[J].Chemical Technology and Biotechnology,2006,81(7):119-1129.
[3]John RP,Nampoothiri,KM Pandey.Fermentative production of lactic acid from biomass:an overview on processdevelopmentsand future perspectives[J].Applied Microbiology and Biotechnology,2007,74(3):524-534.
[4]Okano k,Tanaka T,Ogino C.Biotechnological production of enantiomeric pure lactic acid from renewable resources:recent achievements,perspectives,and limits[J].Applied Microbiology and Biotechnology,2010,85(3):413-423.
[5]Liu L,Xu QL,Li Y.Enhancement of pyruvate production by osmotic-tolerantmutant of Torulopsis glabrata[J].Biotechnology and Bioengineering,2007,97(4):825-832.
[6]William GRotha,Sharon EPorter,Mary PLeckiea.Restoration of cell volume and the reversal of carbohydrate transport and growth inhibition of osmotically upshocked[J].Biochemical and Biophysical Research Communications,1985,126(1):442-449.
[7]William G Roth,Mary P Leckie,David N Dietzler.Osmotic stress drastically inhibits active transport of carbohydrates by Escherichia coli[J].Biochemical and Biophysical Research Communications,1985,126(1):434-441.
[8]Walter R P,Morris JG,Kell D B.The roles of osmotic atress and qater activity in the inhibition of the growth,glycolysis and glucose phosphotransferase system of Clostridium pasteurianum[J].Microbiology,1987,133(2):259-266.
[9]Meury J.Glycine betaine reverses the effects of osmotic stress on DNA replication and cellular division in Escherichia coli[J].Archives ofMicrobiology,1988,149(3):232-239.
[10]Hohmann S.Osmotic stress signaling and osmoadaptation in yeasts[J].Microbiology and Molecular Biology Reviews,2002,66(2):300-372.
[11]SchubertT,Maskow T,BenndorfD,etal.Continuoussynthesis and excretion of the compatible solute ectoine by a transgenic,nonhalophilic bacterium[J].Applied and EnvironmentalMicrobiology,2007,73(10):3343-3347.
[12]Saum SH,Muller V.Salinity-dependentswitchingofosmolyte strategies in a moderately halophilic bacterium:glutamate induces proline biosynthesis in Halobacillus halophilus[J].Journal of Bacteriology,2007,189(19):6968-6975.
[13]Varela C,Agosin E,Baez M,et al.Stephanopoulos.G.,Metabolic flux redistribution in Corynebacterium glutamicum in response to osmotic stress[J].Applied Microbiology and Biotechnology,2003,60(5):547-555.
[14]Simonin H,Beney L,Gervais P.Controlling the membrane fluidity of yeasts during coupled thermal and osmotic treatments [J].Biotechnology and Bioengineering,2008,100(2):325-333.
[15]Turk M,Montiel V,Zigon D,et al.Plasma membrane composition of Debaryomyces hansenii adapts to changes in pH and externalsalinity[J].Microbiology,2007,153(10):3586-3592.
[16]Anderson C,Helmerius J,Hodge D,et al.Inhibition of succinic acid production inmetabolically engineered Escherichia coli by neutralizing agent,organic acids,and osmolarity[J].Biotechnology Progress,2009,25(1):116-123.
[17]Xu S,Zhou JW,Liu LM,et al.Proline enhances Torulopsis glabrata growth during hyperosmotic stress[J].Biotechnology and Bioprocess Engineering,2010,15(2):285-292.
[18]Purvis JE,Yomano L P,Ingram L O.Enhanced trehalose production improves growth of Escherichia coli under osmotic stress[J].Applied Environmental and Microbiology,2005,71(7):3761-3769.
[19]Brown A D,Simpson.Water relations sugar-tolerant yeasts the role of intracellularpolyols[J].JournalofGeneralMicrobiology,1972,72(3):589-591.
[20]Csonka LN.Physiological and genetic responses of bacteria toosmotic stress[J].MicrobiologicalReviews,1989,53(1):121-147.

