GTPs对PD小鼠脊髓前角星形胶质细胞过度活化的影响及机制探讨
叶 俊,磨洁琳,陈 敏
(1桂林医学院附属医院,广西桂林541001;2广西医科大学人体解剖学教研室; 3桂林医学院人体解剖学教研室)
帕金森病(PD)是一种常见于中老年人的中枢神经系统慢性神经退行性疾病,发病率随年龄的增加而增高,其病理改变主要是中脑黑质多巴胺能神经元的渐近性丢失及坏死,临床上出现肌强直、肢体震颤和运动减少等症状[1]。目前,大量致病机制假说涉及环境毒素、氧化应激、线粒体功能破坏、兴奋性氨基酸毒性、钙离子失衡、胶质细胞过度活化、自身免疫、细胞凋亡等,最终导致PD的发生、发展[2]。其中,氧化应激学说得到了广泛认可。2012年12月~2013年6月,我们观察了绿茶多酚(GTPs)对PD小鼠脊髓前角星形胶质细胞过度活化的影响,并探讨其作用机制。
1 材料与方法
1.1 实验动物及主要试剂 雄性SPF级C57BL/6J小鼠45只,6~8周龄,体质量20~25 g,由北京华阜康生物科技股份有限公司提供;饲养条件:桂林医学院实验动物中心饲养室。自由摄食、饮水,待适应环境1周后进入实验。MPTP[3]、小鼠抗大鼠胶质原纤维酸性蛋白(GFAP,Sigma公司);GTPs(浙江东方茶业科技有限公司),纯度100%,其中表没食子儿茶素没食子酸酯(EGCG)含量为70.75%;超氧化物歧化酶(SOD)及丙二醛(MDA)试剂盒(南京建成公司);其他试剂均为国产或进口分析纯。
1.2 动物分组及模型制备 45只小鼠随机分为3组各15只。模型组以MPTP腹腔注射,7 d,30 mg/ (kg·d);预防组同以上述剂量注射MPTP,但制备模型前3个月开始GTPs干预[小鼠饮水中掺入GTPs,浓度为0.1%(W/V)]至注射MPTP结束;正常组连续7 d腹腔注射与MPTP同体积的生理盐水,饮水中未加入GTPs。制模成功标准:在注射MPTP 5~10 min内出现躁动不安、立毛、竖尾、细小震颤,尤以下颌点头状震颤多见。而后活动减少,常蜷缩聚卧成团,爬行蹒跚常见后肢托曳。上述急性中毒反应于给药3 h后逐渐减弱,12 h后基本消失,但小鼠活动仍减少。
1.3 GFAP阳性细胞变化观察 末次注射药物或生理盐水次日处死动物取得样品标本。用1%水合氯醛(40 mg/kg)腹腔注射麻醉,灌注4%多聚甲醛固定(0.1 mol/L PB液配制pH值7.4),取颈膨大(颈Ⅲ~胸Ⅱ)和腰膨大(胸Ⅻ~腰Ⅲ),后固定4 h(4℃),梯度蔗糖溶液(0.1 mol/L PB液配制pH值7.4)相继下沉后横断连续冰冻切片,片厚40μm,隔三取一。切片经0.01 mol/L PBS(pH值7.4)漂洗后以3%H2O2消除内源性过氧化物酶;正常山羊血清室温封闭;小鼠抗大鼠GFAP(1∶1 000)4℃过夜,生物素结合IgG (1∶200)、链菌素抗生物素—过氧化酶(1∶200)相继室温孵育2 h。ABC法染色。切片风干,梯度乙醇脱水,二甲苯透明,中性树胶封片。阴性对照实验除以PBS代替GFAP外,其余步骤与上述相同,反应结果为阴性。光镜下观察脊髓GFAP阳性细胞变化。
1.4 GFAP阳性细胞计数 每只动物选择3张颈、腰膨大切片,观察脊髓前角,计数GFAP阳性细胞(放大倍数10×40),分析系统对细胞数进行定量测定。
1.5 星形胶质细胞变化观察 各组中随机挑选2只动物,腹腔注射1%水合氯醛(40 mg/kg)进行麻醉,经心灌注4%多聚甲醛和2.5%戊二醛的混合液200 mL。取颈膨大和腰骶膨大脊髓前角,切成1 mm3的小块,送电镜室制做超薄切片,醋酸铀—枸橼酸铅染色。电镜下观察各组脊髓前角星形胶质细胞变化。
1.6 SOD、MDA检测 各组动物分别处理结束后5 d各取8只小鼠,小鼠迅速断头取脊髓颈膨大和腰骶膨大,冰上快速分离前角组织,吸干称重后充分匀浆,离心30 min(14 000 r/min,4℃)。参照试剂盒说明书检测SOD和MDA水平。
1.7 统计学方法 采取SPSS17.0统计软件。应用单因素方差分析(ANOVA)进行处理,根据方差齐性与否选择相应的检验方法,即方差齐的资料用LSD法检验进行两两比较,方差不齐的资料两两比较用Games-Howell法检测。P≤0.05为差异有统计学意义。
2 结果
2.1 各组GFAP阳性细胞变化 结果见图1。由图1可知,各组GFAP阳性细胞形态无明显差异。
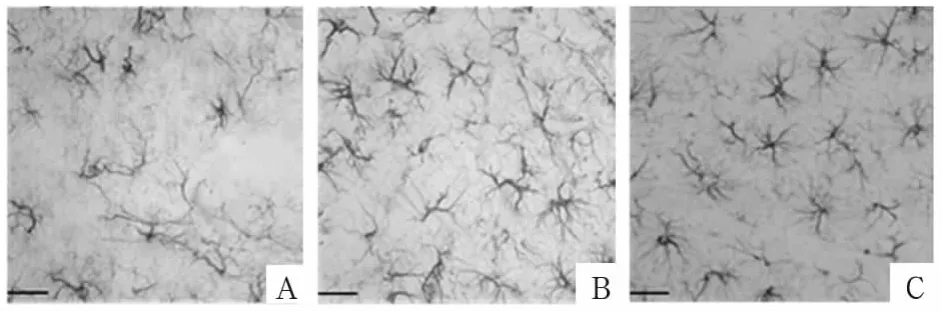
图1 各组GFAP阳性细胞(标尺示25μm)
2.2 各组GFAP阳性细胞计数 结果见表1。
表1 各组GFAP阳性细胞计数(个/视野,±s)

表1 各组GFAP阳性细胞计数(个/视野,±s)
注:与正常组比较,*P<0.01;与模型组比较,#P<0.01
组别GFAP阳性细胞颈膨大 腰膨大模型组 12.36±2.75* 13.21±3.22*预防组 9.28±1.90# 9.87±1.88#正常组6.68±1.91 7.98±1.67
2.3 各组星形胶质细胞变化 模型组出现较多活化的星形胶质细胞,增生、肥大,常成群分布,细胞胞体、胞核增大,胞质丰富,其内细胞器增多;正常组与预防组活化的星形胶质细胞较少。
2.4 各组SOD、MDA水平比较 结果见表2。
3 讨论
以往有关PD的研究通常聚焦于中脑黑质及纹状体,对于同为中枢神经系统的脊髓探究甚少。脊髓是中枢神经系统组成部分,尤其是在运动的发起、执行和控制等,脊髓前角的病变在本课题组之前的研究中已涉及,并且以GTPs预防性干预能缓解多巴胺能神经元的损伤,但GTPs是否能缓解星形胶质细胞过度活化却鲜见报道[4,5]。神经元是人脑基本的构成单位,被胶质细胞紧紧包围,胶质细胞的数量比神经元多出10~50倍,且占据了脑体积的一半。而在所有的胶质细胞中星形胶质细胞数量最多,其异常激活是PD黑质多巴胺神经元变性、缺失及进行性变性级联放大的重要原因[6~8]。中脑黑质多巴胺能神经元的渐近性丢失及坏死,路易氏体(LB)的形成是PD的特征性病理变化,但是目前研究倾向认为黑质既不是首先更不是惟一受累的部位。越来越多证据证明,在胃肠道、唾液腺、迷走神经背核都有LB的形成,提示PD病变部位更加广泛,并不局限于黑质和纹状体,涉及中枢神经系统其他部分,甚至是全身性疾病,本研究结果与此是一致的。
表2 各组SOD、MDA水平比较(±s)
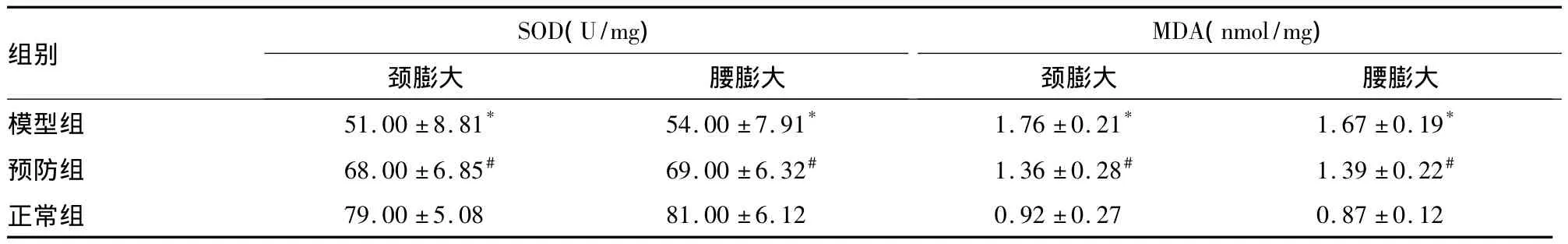
表2 各组SOD、MDA水平比较(±s)
注:与正常组比较,*P<0.01;与模型组比较,#P<0.01
组别SOD(U/mg)颈膨大 腰膨大MDA(nmol/mg)颈膨大 腰膨大模型组 51.00±8.81* 54.00±7.91* 1.76±0.21* 1.67±0.19*预防组 68.00±6.85# 69.00±6.32# 1.36±0.28# 1.39±0.22#正常组79.00±5.08 81.00±6.12 0.92±0.27 0.87±0.12
中枢神经系统常见退行性疾病如老年性痴呆、PD、多发性硬化等,星形胶质细胞的异常激活能进一步促进上述退行性疾病的病理发生和进程,其产生的大量致炎因子以及氧化应激分子导致神经元的二次损伤[9~11];同时,神经元的损伤又能刺激胶质细胞的不断激活,从而形成了病理过程的恶性循环[12]。星形胶质细胞适度激活对能保护多巴胺能神经元,而迅速增殖的星形胶质细胞将损伤部位快速隔离,形成一个相对局限封闭的环境,阻断炎症向周围区域扩散[13];释放众多神经保护因子如NGF、BDNF、GDNF,可保护多巴胺能神经元免受神经毒素的侵袭。长期、大量的不良刺激诱发星形胶质细胞过度活化,产生炎症因子如IL-1、TNF-α、IL-10及干扰素诱导蛋白等损伤多巴胺能神经元,成为PD持续进展的病理因素之一。由于先天的缺陷或环境因素的作用,中脑黑质多巴胺能细胞无法有效的清除在氧化过程中产生的某些细胞的毒物如自由基,导致其含量超过正常的范围,进而破坏脂类、蛋白和核酸等,由此产生的“氧化应激”,会导致多巴胺能细胞死亡。
GTPs是一种抗氧化剂,是植物绿茶中所提取的富含儿茶素的多酚化合物。其内大量含有的最有活性的EGCG,具有明确的抗氧化、清除自由基的积极作用[14,15]。近年来研究表明,EGCG在许多神经变性疾病中具有神经保护作用[16~18]。EGCG是GTPs的重要活性成分,主要以原型存在于血液和靶器官中,且能够通过血脑屏障渗透进入神经系统,成为其发挥神经保护作用的前提[19]。GTPs是具有公认的抗氧化及清除自由基作用[20]。本研究提示,GTPs能够减轻MPTP模拟PD模型造成的脊髓星形胶质细胞的过度活化,降低SOD及提高MDA水平和活性,增加抗氧化能力。
[1]Zhang ZX,Roman GC,Hong Z,etal.Parkinson's disease in China:prevalence in Beijing,Xi'an,and Shanghai[J].Lancet,2005,365(9459):595-597.
[2]Yang YX,Wood NW,Latchman DS.Molecular basis of Parkinson's disease[J].Neuroreport,2009,20(2):150-156.
[3]Langston JW,Ballard P,Tetrud JW,et al.Chronic parkinsonism in humans due to a product ofmepe-ridine analog synthesis[J].Science,1983,219(4587):979-980.
[4]陈敏,劳明,韦献良,等.MPTP诱导的帕金森病模型小鼠脊髓前角结构变化的观察[J].广东医学,2011,32(13):1648-1651.
[5]陈敏,黄雪芳,叶俊,等.绿茶多酚对帕金森病小鼠多巴胺能神经元保护作用研究[J].重庆医学,2013,42(7):721-723.
[6]Temple S.The devel opment of neural stem cells[J].Nature,2001,414(6859):112-117.
[7]Amor S,Puentes F,Baker D,etal.Inflammation inneurodegenerative diseases[J].Immunology,2010,129(2):154-169.
[8]Chen PC,Vargas MR,Pani AK,et al.Nrf2-mediated neuroprotection in the MPTPmousemodel of Parkinson's disease:critical role for the astrocyte[J].Proc Natl Acad Sci USA,2009,106 (8):2933-2938.
[9]Allan SM,Rothwell NJ.In flammation in centralnervous system injury[J].Philos Trans R Soc Lond B Biol Sci,2003,358(1438): 1669-1677.
[10]Akiyama H,Barger S,Barnum S,et al.Inflammation and alzheimer's disease[J].Neurobiol Aging,2000,21(3):383-421.
[11]Zaheer S,Thangavel R,Wu Y,et al.Enhanced expression of glia maturation factor correlates with glial activation in the brain of triple transgenic alzheimer's disease mice[J].Neurochem Res,2013,38(1):218-225.
[12]Craft JM,Watterson DM,Hirsch E,et al.Interleukin 1 receptor antagonist knockoutmice show enhanced microglial activation and neuronal damage induced by in tracerebroven tricular infusion of human amyloid[J].JNeuroinflammation,2005,20(2):15.
[13]Kalla R,Liu ZQ,Xu S,etal.Microglia and the early phase of immune surveillance in the axotomized facialmotor nucleus:impaired microglial activation and lymphocyte recruitment but not effect on neuronal survival or axonal regeneration inmacrophage colony stimulating factor-deficientmice[J].JComp Neurol,2001,436(2): 182-201.
[14]Nanjo F,Goto K,Seto R,etal.Scavenging effects of tea catechins and their derivatives on 1,1-diphenyl-2-picrylhydrazyl radical[J].Free RadBiol Med,1996,21(6):895-902.
[15]Raut A,Ratk A.Oxidative damage and sensitivity to nociceptive stimulus and opioids in aging rats[J].Neurobiol Aging,2009,30 (6):910-919.
[16]Chechoway H,Powers K,Smith-welle T,et al.Parkinson's disease risks associated with cigarette smoking,alcohol consumption,and caffeine intake[J].Am J Epidemiol,2002,155(8):732-738.
[17]Levitesy,Weinreb O,Maor G,et al.Green tea polyphenol(-)-epigallocatechin-3-gallate prevents N-methy-1-4-pheny-1-1,2,3,6-tetrahydropyridine-induced dopaminergic neurodegeneration[J].JNeurochem,2001,78(5):1073-1082.
[18]Liu L,Yu LC.Potential protection of green tea polyphenols against ultraviolet irradiation-induced injury on rat cortical neurons[J].Neurosci Lett,2008,444(3):236-239.
[19]Abdelmohsen MM,Kuhnle G,Rechnner AR,et al.Uptake and metabolism of epicatechin and its access to the brain after oral ingestion[J].Free Radic Biol Med,2002,33(12):1693-1702.
[20]Ounjaijean S,Thephinlap C,Khansuwan U,et al.Effect of green tea on iron status and oxidative stress in iron-loaded rats[J].Med Chem,2008,4(4):365-370.

