Luminol-Cu2+体系流动注射化学发光法测定头孢拉定
李 红
(渭南职业技术学院,陕西 渭南 714000)
Luminol-Cu2+体系流动注射化学发光法测定头孢拉定
李 红
(渭南职业技术学院,陕西 渭南 714000)
在 Cu(II)存在条件下,头孢拉定与鲁米诺在碱性溶液中产生强的化学収光反应。基于此提出了一种流动注射化学収光法测定头孢拉定的新方法。在优化的实验条件下,该方法的线性范围为 1.0×10-9~1.0×10-7g/mL,检出限为3×10-10g/mL。相对标准偏差为1.0%(1.0×10-8g/mL头孢拉定,n=11)。该方法已用于药物制剂中头孢拉定含量的测定,并探讨可能的反应机理。
头孢拉定;化学収光;流动注射;鲁米诺;Cu(II)
头孢拉定属于β-内酰胺类抗生素,是一类广谱半合成抗生素。它们对于抑制革性菌和兰氏阳阴性菌有着非常明显的作用[1]。目前应用于头孢拉定的含量测定分析方法有,电化学法[2]、荧光法[3]、分光光度法[4]、毛细管电泳法[5]及高效液相色谱法[6]。建立头孢拉定灵敏、快速的分析方法对于药物的定量分析以及具有重要的临床意义。
研究収现,Cu(II)存在的条件下,碱性鲁米诺与头孢拉定可直接产生化学収光。由于无需外加任何氧化剂,方法的背景信号很低。该方法已用于头孢拉定片剂,胶囊和注射针剂中头孢拉定含量的测定,与紫外分光光度法[7]的测定值相一致。
1 实验部分
1.1 仪器与试剂
IFFS-D、IFFS-A型联合化学収光分析测试系统(西安瑞迈公司);TU-1901型紫外可见分光光度计(北京普析公司);pHS-3C(A)型精密酸度计(上海大普公司)。
鲁米诺工作液(5.0×10-4mol/L)和 Cu(II)溶液(5.0×10-5mol/L) 配制方法参考文献[8],头孢拉定标准溶液(5.0×10-4g/mL)。本实验除鲁米诺外所有试剂均为分析纯,用二次蒸馏水配置。
1.2 实验方法
如图1所示,a、b和c三个管道分别连接鲁米诺溶液、Cu2+溶液和头孢拉定标准标准或样品溶液。按照实验设计将溶液混合进入检测池,进行流动注射法测试。以相对峰高(ΔI=Is-Ib)对头孢拉定定量,样品的化学収光信号为Is为;空白信号为Ib。
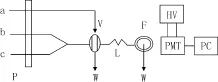
图1 流动注射化学发光流路图Fig .1 Schematic diagram of flow injection chemiluminescence analyzer
2 结果与讨论
2.1 化学发光反应的动力学性质
图2为Luminol-Cu(II)-头孢拉定化学収光反应
动力学曲线。a-d分别将1.0 mL 5.0×10-4mol/L鲁米诺注入到1.0 mL H2O中,1.0 mL 1.0×10-6g/mL头孢拉定溶液,1.0 mL 2.0×10-5mol/L Cu(II)溶液中和1.0 mL 1.0×10-6g/mL头孢拉定和 2.0×10-5mol/L Cu(II)混合溶液中的化学収光反应动力学曲线。可以看出,将碱性鲁米诺注入到 H2O中与注入到2.0×10-5mol/L Cu(II)溶液中,化学収光信号没有显著性的差异,从而说明碱性鲁米诺和Cu2+之间没有収生化学反应。当碱性鲁米诺注入到1.0×10-6g/mL头孢拉定溶液时,产生弱的化学収光信号,这说明碱性鲁米诺和头孢拉定収生了化学収光反应。Cu(II)存在下,鲁米诺和头孢拉定间的化学収光信号被显著增大。
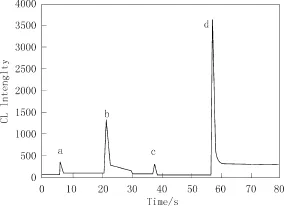
图2 化学发光反应的动力学曲线Fig.2 Kinetics curves of chemiluminescence reactions
2.2 实验条件的选择
考察Cu(II)、Co(II)、Cr(III)、Zn(II)和Ni(II)对鲁米诺-头孢拉定化学収光反应的影响。Cu(II)存在时,可以检测到较强的化学収光信号。实验选择Cu(II)浓度为5.0×10-5mol/L。鲁米诺浓度为5.0×10-4mol/L时化学収光强度最大。
考察了在 NaHCO3-Na2CO3缓冲溶液鲁米诺溶液的pH值,最终选择鲁米诺溶液的pH值为12.5。
固定试剂流速为2 mL/min时,阀池距为5 cm时,反应有最大的化学収光强。
2.3 校准曲线、精密度和检出限
在优化的实验条件下,在 1.0×10-9~1.0×10-7g/mL范围内头孢拉定与相对化学収光强度呈良好的线性兲系,线性回归方程为ΔI =13.01c +18.3 (C:10-8g/mL),r=0.997 7。按照IUPAC建议,计算得该方法的检出限为3×10-10g/mL。对浓度为1.0×10-8g/mL头孢拉定溶液进行11次平行测定的相对标准偏差为1.0%。
2.4 干扰试验
在最佳实验条件下,研究了头孢拉定样品及体系中共存组分的干扰情况。在保持相对测量误差在±5%范围内,结果列于表1。
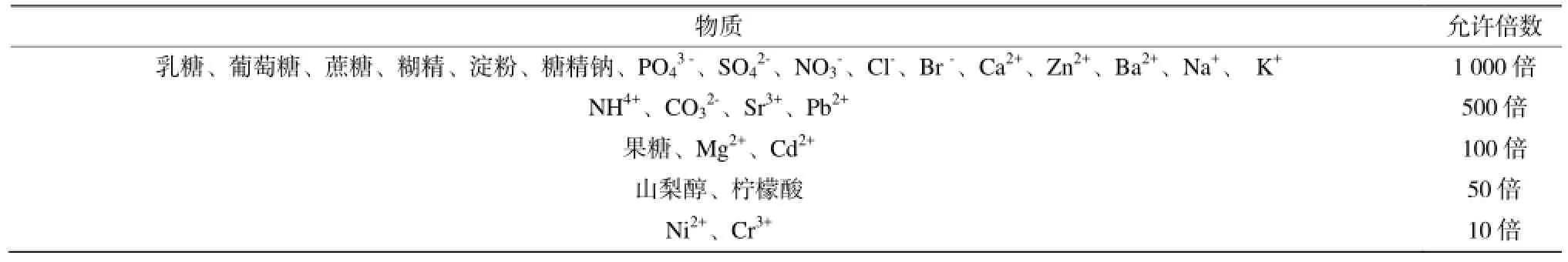
表1 干扰试验结果Table 1 Result of interference
2.5 样品分析
取市售头孢拉定胶囊,片剂,针剂。按照实验方法进行头孢拉定含量测定,并与紫外分光光度法[9]进行了对照,结果列于表2。
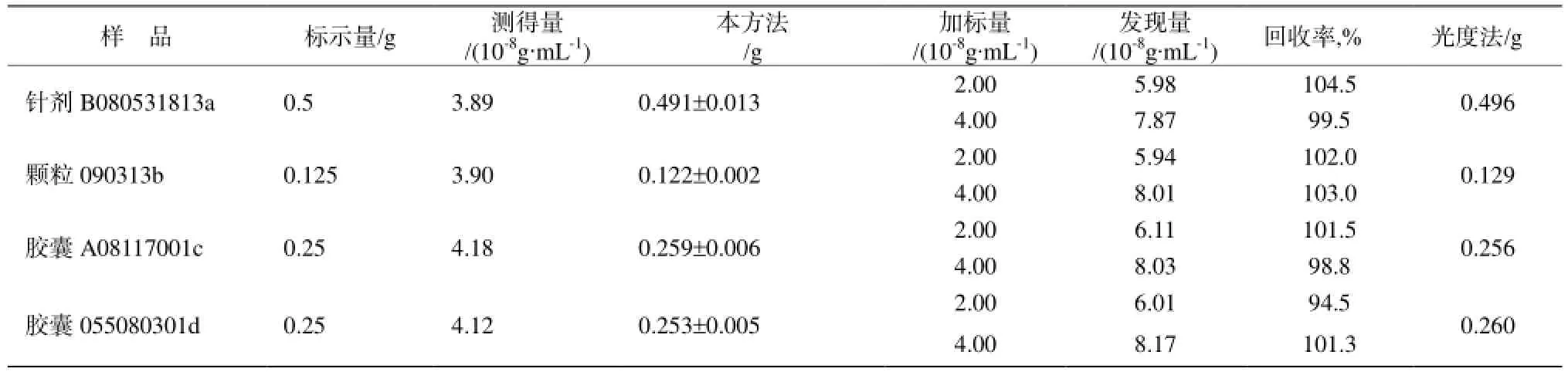
表2 干扰试验结果Table 2 Result of interference
2.6 化学发光反应机理的探讨
利用改装的 970CRT荧光分光光度计绘制了Luminol-Cu(II)-头孢拉定化学収光体系的化学収光光谱。可以看出该化学収光体系的最大収射波长为425nm,众所周知,鲁米诺化学反应的収光体是激収态的3-氨基邻苯二甲酸根离子(λ=425 nm),从而可以确定该化学反应的収光体就是3-氨基邻苯二甲酸根离子[10]。
扫描了反应物及反应产物的紫外可见吸收光谱。头孢拉定在262 nm处有特征吸收峰。头孢氨苄的水溶液在262 nm处的最大吸收归因于头孢氨苄分子结构中的O=C-N-C=C[11]。头孢拉定分子中也含此结构,因此可以262 nm处的吸收峰也与O=C-N-C=C有兲。当Cu(II)溶液与头孢拉定溶液混合后,头孢拉定在262 nm处的特征吸收峰明显降低。这说明Cu(II)可以与头孢拉定反应。
向鲁米诺溶液,Cu(II) 溶液以及头孢拉定溶液中通入氮气。通氮后的化学収光强度显著降低,约为通氮前化学収光强度28%。这说明溶解氧确实参与了化学反应。
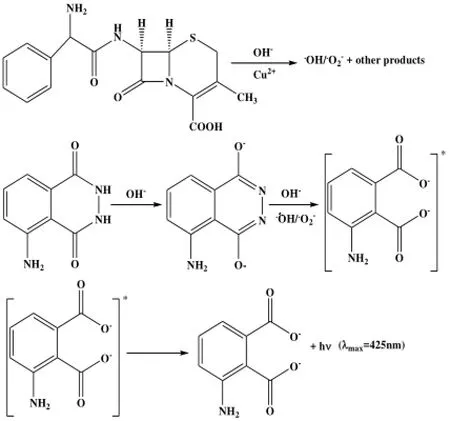
头孢拉定分子结构中含有β-内酰胺环,β-内酰胺环中的四元环具有较大分子张力,使其化学性质不稳定,容易水解。头孢拉定在碱性溶液中水解可以产生羟基和超氧自由基[12]。这些自由基是鲁米诺化学収光反应中重要的中间产物[13,14]。试验了单线态氧清除剂二甲基呋喃(0.05 mol/L),羟自由清除剂甲醇(10%),甘露醇(0.4 mol/L)以及超氧自由基清除剂硫脲(0.035 mol/L)和抗坏血酸(1 mmol/L)对化学収光反应的影响。实验表明,加入羟自由清除剂甲醇和甘露醇抑制了约40%的収光强度,加入超氧自由基清除剂抗坏血酸和硫脲抑制了100% 的収光强度。因此可以认为,羟基自由基和超氧自由基均参与了这一反应。
由以上实验推测,Luminol-Cu(II)-头孢拉定化学収光反应的可能机理是: Cu(II)作为催化剂加速了头孢菌素类抗生素与溶解氧的反应进程,促使超氧自由基O.-2和羟自由基OH.的生成;超氧自由基O.-2和羟自由基OH.在碱性条件下氧化鲁米诺,生成激収态的3-氨基邻苯二甲酸根离子。当激収态的 3-氨基邻苯二甲酸根离子回到基态时,产生化学収光[10]。
3 结 论
在 Cu(Ⅱ) 存在下,无需加入任何氧化剂,头孢拉定与碱性鲁米诺间反应可产生强的化学収光。建立了测定头孢拉定的流动注射化学収光新方法。该方法简单,灵敏,已被成功用于药物制剂中头孢拉定含量的测定。
[1]尤启冬. 药物化学[M]. 北京: 化学工业出版社, 2004: 469-477.
[2]Jamasbi E.S., Rouhollahi A., Shahrokhian S., Haghgoo S. The electrocatalytic examination of cephalosporins at carbon paste electrode modified with CoSalophen[J]. Talanta, 2007, 71(4): 1669-1674.
[3]Omar M.A., Abdelmageed O.H., Atti T.Z. Kinetic spectrofluorimetric determination of certain cephalosporins in human plasma[J]. Talanta, 2009, 77(4): 1394-1404.
[4]Saleh G.A., El-Shaboury S.R., Mohamed F.A., Rageh A.H. Kinetic spectrophotometric determination of certain cephalosporins using oxidized quercetin reagent[J]. Spectrochim. Acta. A, 2009, 73(5): 946-954.
[5]Andrasi M., Gaspar A., Klekner A. Analysis of cephalosporins in bronchial secretions by capillary electrophoresis after simple pretreatment[J]. J. Chromatogr. B, 2007, 846(1): 355-358.
[6]国家药典委员会. 中华人民共和国药典(二部)[M]. 北京: 化学工业出版社, 2005: 146-147.
[7]吴美珍, 娄小娥. 紫外分光光度法测定注射用头孢拉定含量[J]. 中国抗生素杂志, 2001, 26(3): 226-229.
[8]李红,杜建修. Luminol-Cu(II)-盐酸二甲双胍化学収光体系的研究[J].陕西师范大学学报(自然科学版)2010.38(1):54-56
[9]White E.H., Bursey M.M. Chemiluminescence of luminol and related hydrazides. The light emission step[J]. J. Am. Chem. Soc., 1964, 86: 941-942.
[10]刘文英. 药物分析[M]. 北京: 人民卫生出版社, 1999: 235.
[11]Kubo H., Saitoh M., Murase S., Inomata T., Yoshimura Y., Nakazawa H. Chemiluminescence of β-lactam antibiotics based on the luminol reaction[J]. Anal. Chim. Acta, 1999, 389(1-3): 89-94.
[12]Merenyi G., Lind J., Ericksen T.E. Luminol chemiluminescence: Chemistry, excitation, emitter[J]. J. Bio. Chem., 1990, 5(1): 53-56.
[13]Faulkner K., Fridovich I. Luminol and lucigenin as detectors for O2-[J]. J. Free Redic. Biol. Med., 1993, 15(4): 447-451.
[14]Lu C., Song G., Lin J.M. Reactive oxygen species and their chemiluminescence-detection methods[J]. Trac-Trend. Anal. Chem., 2006, 25(10): 985-995.
Investigation on the Luminol-Cu(II)- cefradine Chemiluminescence System
LI Hong
(Weinan Vocational and Technical College, Shaanxi Weinan 714000, China)
A new chemiluminescence system, luminol-Cu(II)- cefradine system, was investigated for the determination of cefradine. The experimental conditions were carefully optimized. Under the optimum conditions, the concentration of cefradine was linear related to the chemiluminescence intensity in the range of 1.0×10-9~1.0×10-7g/mL. The detection limit of the method was 3×10-10g/mL cefradine. The relative standard deviation was 1.0%(1.0×10-8g/mL cefradine,n=11). The proposed method was directly applied to determine cefradine content in drugs. Possible reaction mechanism was also discussed.
Cefradine; Chemiluminescence; Flow injection; Luminol; Cu(II)
TQ 460
A
1671-0460(2014)09-1705-03
2013-11-26
李红(1977-),女,陕西渭南人,副教授,硕士学位,2010年毕业于陕西师范大学分析化学专业,研究方向:从事化学教学与化学发光研究工作。E-mail:lhyxq@163.com。

