N/C对碳氮膜修饰的多壁碳纳米管细胞相容性的影响
赵梦鲤,李德军,董 磊,刘小绮,曹 叶
(天津师范大学物理与材料科学学院,天津300387)
多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)是由多层同心石墨片卷曲而成的无缝、中空管体[1],其管径由零点几至数十纳米,而长度可达微米甚至毫米量级,超大的长度直径比[2]赋予它们独特的电子、力学和化学特性[3-5].因此,多壁碳纳米管被用作药物和生物分子的传导工具以及组织工程中的支架[6-9],成为近年来物理、医学和生物材料等多领域的研究前沿和热点[10-13].随着研究的不断深入,纯碳纳米管也逐渐暴露出一些缺陷,如亲水性差、易在水性溶液中团聚.为了使其更好地应用于生物医学领域,必须要提高碳纳米管的亲水性及其生物相容性.功能化修饰作为一种可以有效改善碳纳米管亲水性及其生物相容性的物理、化学方法逐渐崭露头角.
共价修饰[14-18]、氟化[19]和自由基氧化[20]是目前常用的碳纳米管化学修饰方法,具有造价低廉、反应速度快和可大批量生产的优势;但同时,容易引入杂质基团、引起材料结构改变及对修饰基团的选择性等问题也成为化学修饰法难于克服的缺陷.作为一种物理方法,离子束辅助沉积(IBAD)技术将电离的原子经电场加速后快速轰击靶材,产生带电离子,然后使目标离子注入固体材料表面,从而引起材料表层成分和结构的改变,达到改善材料表面性能的目的.该技术的最大特点是不会对改性的碳纳米管的力学性能造成影响,产生的沉积层与碳纳米管附着紧密,在改善生物材料的生物相容性方面收效甚好.
课题组的前期研究已证实沉积纳米碳氮膜的多壁碳纳米管具有更优秀的细胞相容性[21],文献[22]曾报道在表面沉积不同比例纳米碳氮膜的多壁碳纳米管的抗凝血性不同.本研究对原始MWCNTs和沉积CNx(x=N/C,x=0.20,0.21,0.27)膜的MWCNTs进行了细胞黏附和增殖实验,以分析MWCNTs表面CNx薄膜的存在与N含量对其细胞相容性的影响.体外细胞实验选用小鼠成纤维细胞(L929)、人内皮细胞(EAhy926)和新西兰兔血红细胞分别与MWCNTs和3种不同N/C比的沉积纳米CNx薄膜的MWCNTs表面相接触,通过观察3种细胞在材料表面的黏附和生长情况,研究N元素剂量对沉积纳米CNx膜的MWCNTs细胞相容性的影响.
1 材料与方法
1.1 沉积纳米CNx薄膜的MWCNTs的制备
MWCNTs(中国深圳市纳米港有限公司提供)由CVD方法制备,纯度为90%,直径为40~50nm,长度为5~15μm.表面沉积纳米CNx薄膜前,将MWCNTs的水悬浮液喷涂在直径15mm、厚度0.5mm的圆形SiO2基片上,喷涂过程和具体参数见参考文献[21,23].
单面覆着MWCNTs的基片经高真空离子束辅助沉积系统(ion beam assisted deposition,IBAD)于其表面沉积CNx薄膜,并通过改变实验中辅助枪束流的大小(5、15和25mA)达到调节碳氮膜中N/C比的目的.沉积过程中溅射气体选用高纯度氩气和氮气,溅射靶材为石墨靶(纯度为99.9%),本底真空为1.9×10-4Pa,工作气压保持在 1.2×10-2~1.3×10-2Pa,加速电压为200V,放电电压为70V,溅射能量为1.05keV,溅射束流25mA,N离子辅助能量为200eV[21,23].
1.2 结构和成分特征测试
使用JOEL JEM2100型透射电子显微镜观察改性前后单根MWCNTs的表面形貌;使用PHI5000型X线能谱仪(1486.6eV的AlKα射线源)检测CNx薄膜中N和C原子百分比;使用Renishaw micro-Raman 2000型显微拉曼光谱仪(A+离子激光器的扫描波长为514nm,横向空间分辨率为0.5μm,纵向空间分辨率为2μm,波数扫描范围为40~3 200cm-1)分析修饰前后MWCNTs的原子组态;使用CAM KSV021733型光学接触角测量仪测试样品的水接触角.
1.3 细胞相容性测试
本研究在材料表面种植国标GBT1688.6-2003小鼠成纤维细胞系L929[24]和在血管形成、组织生长过程中起重要作用的内皮细胞株EAhy926,在1个生长周期内,通过体外观察材料对细胞黏附和生长的影响,研究MWCNTs和沉积CNx膜的MWCNTs的细胞相容性.取灭菌后的MWCNTs样品18个,沉积CNx膜的MWCNTs样品(CN0.20、CN0.21和 CN0.27)每种各 18个,6个为一组,分成3组(3次重复实验);将已培养48h、生长旺盛的L929细胞制成2×104个/mL细胞浓度的细胞悬浮液(细胞存活率96%),5×104个/mL的人内皮细胞悬浮液(细胞存活率97%)使用移液枪等量(700μL)滴加在样品表面.在培养箱中培养24h后,每种样品各取出1片在扫描电镜下观察材料表面L929和 E926细胞的形貌;并在 0.5、1、2、3、5和 7d时,每组样品各取1孔,用胰蛋白酶消化,将消化下来的细胞用台盼蓝染色,对活细胞进行计数,绘制生长曲线.
取健康新西兰兔耳动脉血,加入抗凝剂,并按体积比1∶1与生理盐水稀释,制成抗凝血溶液.取抗凝血溶液滴加在灭菌后的MWCNTs和沉积CNx膜的MWCNTs样品(CN0.20、CN0.21和 CN0.27)表面,每个样品700μL,培养箱中培养30min后取出,扫描电镜下观察材料表面红细胞形态.取MWCNTs和沉积CNx膜的MWCNTs样品(CN0.20、CN0.21和 CN0.27)分别放入装有5mL生理盐水的锥形瓶中;另取锥形瓶,加入5mL生理盐水和5mL蒸馏水,分别作为阴性和阳性对照组.每只锥形瓶中再加入50μL的抗凝血溶液,摇匀,使混合液充分与样品接触并相互作用,在(37±1)℃下水浴60min,最后将样品组和对照组的溶液分别移至离心管中,离心15min,观察离心管内溶液.
2 结果与讨论
文献[22]已报道,沉积纳米碳氮膜的MWCNTs中N含量受辅助枪束流大小的影响,对应辅助枪束流为5、15和25mA,N元素含量依次为17.04%、21.34%和17.54%,换算成N、C两原子的比例(N/C)依次为0.20、0.27和 0.21,记作 CN0.20、CN0.27和 CN0.21.
为获得制备样品的结构特征,并直观观察到CNx薄膜的存在,在文献[22]的基础上,对MWCNTs和沉积CN0.27膜的MWCNTs进行透射电镜(transmission electron microscope,TEM)观察,结果如图1所示.由图1(a)可以看出,MWCNTs具有典型的同心管状结构,单根MWCNTs内径约为8~10nm,管壁厚为10~15nm,外径约为 40~50nm,管壁层次清晰.图 1(b)显示了沉积CNx膜后的MWCNTs,图中白色方框内的MWCNTs最外层管壁外侧包覆有约10nm厚的涂层,结合XPS结果可知这层薄膜即为沉积在MWCNTs表面的CNx膜.由图1(b)还可以看出,CNx膜的厚度并不均匀,有些单根MWCNTs外侧包覆的薄膜较薄,有些MWCNTs甚至未被包裹.这是因为被喷涂在基片上的MWCNTs具有一定厚度,沉积过程中只有表面裸露出的MWCNTs能够接受到来自溅射源的低能粒子,故CNx膜仅在MWCNTs裸露部分沉积.同时,TEM观测到CNx膜层的最大厚度不超过10nm,因此只能包裹在MWCNTs表面,在MWCNTs与细胞接触时发挥作用,并不会影响MWCNTs喷涂在SiO2基片后形成的宏观多孔型支架结构.
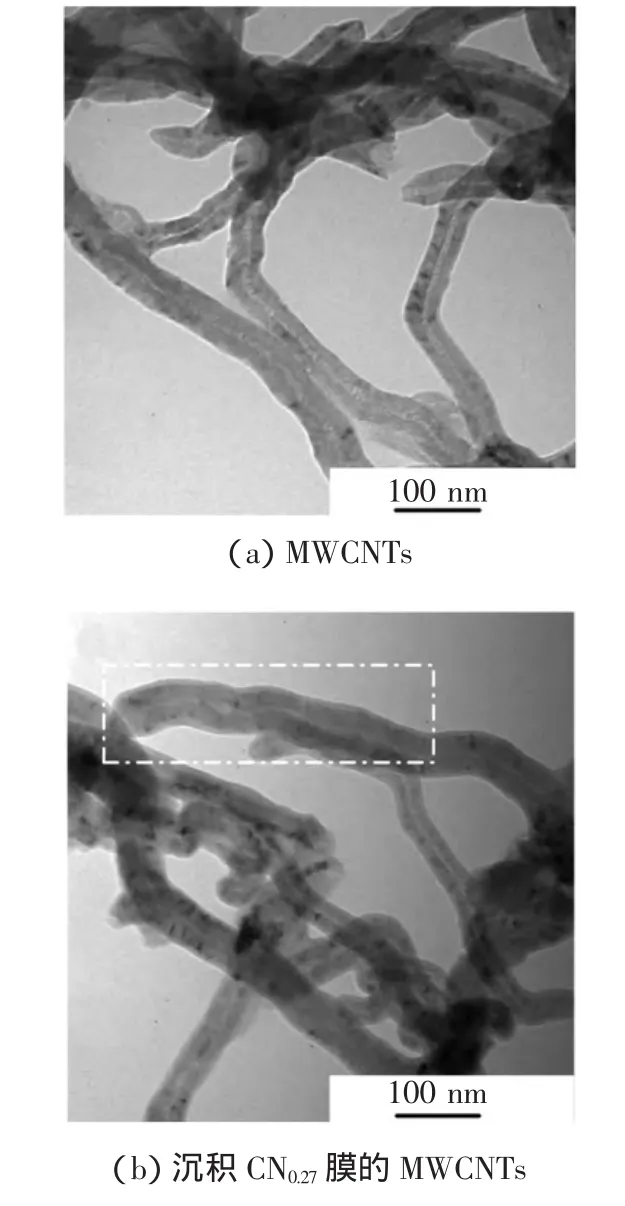
图1 MWCNTs TEM图Fig.1 TEM images of MWCNTs
图2为沉积CNx膜前后,碳纳米管在低频率波数范围内采点的显微Raman光谱图.从图2中可以看到,MWCNTs和沉积CNx膜的MWCNTs均在1350cm-1、1580cm-1和2700cm-1附近位置出现典型的峰.一般情况下,碳材料的拉曼活动模式包括2个峰:一个是由石墨或CNTs的布里渊区K点附近的光学声子模产生的D峰(1350cm-1附近);另一个来自Γ点的振动,对应E2g对称性的光学声子模G峰(1580cm-1附近).同时,由于激发的电子被有相同能量但相反波矢的声子2次散射,在2700cm-1附近会产生D峰的二阶峰(D*峰).对于完整晶体,G峰和D*峰均是拉曼活性的,而D带则是被禁戒的.当有缺陷存在时,D*模被激活.如果G峰或D*峰的强度与缺陷无关,则可以用D峰相对于G峰或D*峰的强度(ID/IG或ID/ID*)标定石墨或碳纳米管样品的无序程度和缺陷密度[25].一般文献都采用ID/IG描述缺陷大小[26-27].由图2可以发现,由于MWCNTs表面沉积了CNx薄膜,引入的N元素改变了MWCNTs的缺陷度,当N/C比为0.21时,ID/IG的比值最高,缺陷度最大.
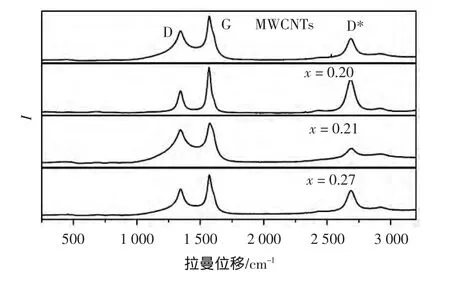
图2 MWCNTs和沉积CNx膜MWCNTs的拉曼光谱图Fig.2 Raman spectra of MWCNTs with and without CNxcoatings
文献[22]已报道了MWCNTs和沉积CNx膜MWCNTs的亲水性.纯MWCNTs的水接触角为139.96°,疏水性极强.而经IBAD表面沉积CNx后,亲水性得到了极大改善,3种沉积CNx薄膜的MWCNTs均转化为亲水材料,说明在改善MWCNTs亲水性方面实验达到了预期目标.同时,可以发现亲水性的改变规律与Raman结果相关,沉积CN0.21膜的MWCNTs缺陷度最大(接触角平均值为33.12°),亲水性最强.相反,含氮量最高的沉积CN0.27膜的MWCNTs的亲水性反而较高(接触角平均值为55.69°).一些研究表明,细胞更易在接触角为60~90°的中等湿润表面黏附增殖[28-31].所以,从接触角结果可以推测出沉积CNx膜的MWCNTs的细胞相容性将得到提高,且N/C比值的高低会对材料的细胞相容性产生影响.
图3为培养24h后,扫描电镜下MWCNTs和沉积CNx膜MWCNTs表面黏附的小鼠成纤维细胞和人内皮细胞的形态.从图3可以看出,MWCNTs表面黏附的L929和E926细胞数目均明显少于沉积CNx膜的MWCNTs,这说明在材料与细胞接触初期,润湿且亲水性较强的表面更适于细胞黏附.沉积CN0.27膜的MWCNTs表面黏附细胞数目最多,说明L929和E926细胞更容易在N含量高、中等湿润的材料表面黏附.同时,放大2500倍的SEM照片清晰地显示出,没有沉积CNx膜的MWCNTs表面黏附的单个细胞形态略微隆起,呈长条状或椭圆状,伪足细小,这说明细胞与材料结合并不牢固,细胞的分裂、增殖能力较差,如图 3(a)和图 3(d)所示.而沉积 CNx膜 MWCNTs表面的细胞形态扁平,呈三角状,伪足长且粗壮,细胞形态伸展,如图 3(b)、图 3(c)、图 3(e)和图 3(f)所示.这说明在细胞与材料接触初期,沉积CNx膜的MWCNTs对细胞无毒副作用,2种细胞在其表面生长旺盛,已准备好进一步的分裂增殖.初步判断,沉积CNx膜的MWCNTs具有优于未沉积CNx膜MWCNTs的细胞相容性.

图3 (a~c)小鼠成纤维细胞,(d~f)人内皮细胞黏附在材料表面的SEM图Fig.3 SEM images of the(a~c)mouse fibroblast cells,(d~f)human endothelial cells adhered on samples
为验证SEM的结果并观察材料与细胞长期作用的效果,在1个细胞周期内,对黏附在MWCNTs和沉积CNx膜MWCNTs表面的L929小鼠成纤维细胞进行细胞计数,绘制成生长曲线如图4所示.
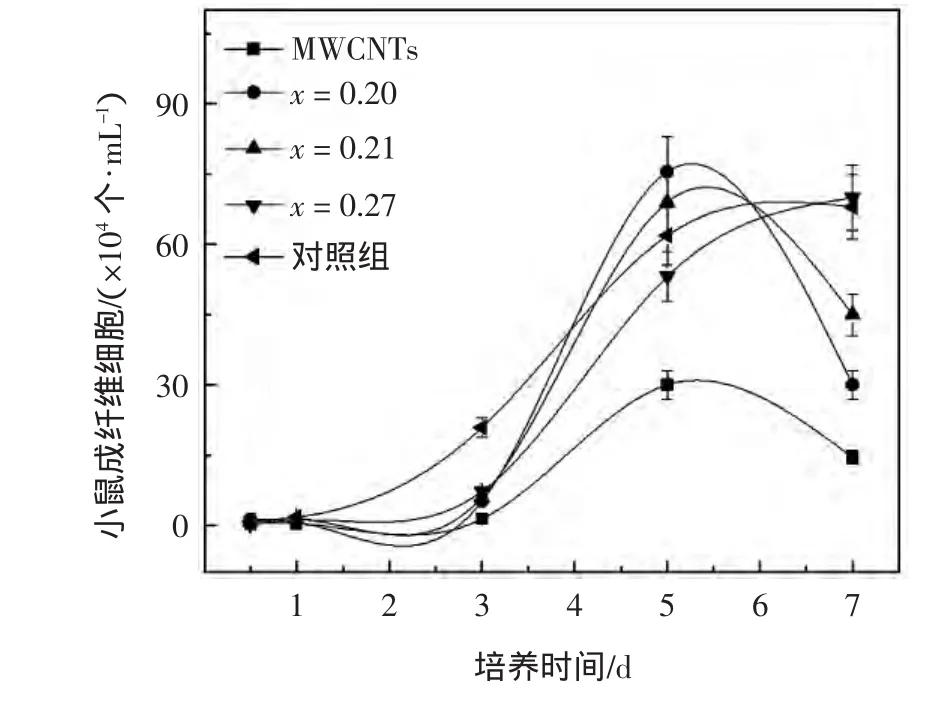
图4 MWCNTs和沉积CNx膜MWCNTs上的L929成纤维细胞数量随培养天数的变化情况Fig.4 L929mouse fibroblast cell numbers on MWCNTs with and without CNxcoating vs.incubation time
由图4可以看出,L929细胞自第3 d开始大量分裂增殖,沉积CNx膜MWCNTs表面的细胞数目明显高于MWCNTs,第5d,沉积CNx膜的MWCNTs表面的细胞数已超过对照组.沉积CN0.27膜的MWCNTs在第7d时也达到了空白对照组的细胞数目,并在其他组细胞进入衰亡期后依旧保留强劲增长趋势.总体来看,L929细胞在沉积CNx膜的MWCNTs表面生长和增殖情况良好,整个生长周期内明显超越普通MWCNTs,与用于细胞培养的24孔板(空白组)上的细胞增殖情况不相上下.这说明在MWCNTs表面沉积纳米CNx薄膜可以有效提高MWCNTs的细胞相容性,且较高的N/C比有利于细胞相容性的增强.这是因为在体外当细胞与材料相接触时,材料的亲疏水性对体液和细胞表面蛋白与材料表面相互作用具有重要影响[32].在Groth和Altankov[33-34]进行的一系列亲水、疏水材料与细胞作用界面吸附蛋白(FN,V N等)及其受体功能方面的研究中发现,细胞更好地生长于亲水性材料表面,其原因在于亲水表面吸附蛋白的数目、构型和重组能力不同.相较于MWCNTs,沉积CNx膜的MWCNTs的亲水性提高非常明显,当其与细胞接触时,细胞更容易黏附在功能化的MWCNTs表面.而且,沉积的CNx薄膜中富含N元素,N元素的存在对提高材料细胞相容性具有积极作用.
图5显示了兔血红细胞黏附在MWCNTs和沉积CNx膜MWCNTs表面上的形态.图5(a)所示的黏附在MWCNTs上的血红细胞存在大量变形,只有少数红细胞保持了原有的圆饼状,说明MWCNTs对于血红细胞具有一定的毒副作用.而在MWCNTs上沉积CNx薄膜后,红细胞的变形明显被抑制,尤其是当覆盖的CNx薄膜中N/C比较高(N/C=0.27)时,几乎看不到红细胞的变形,绝大多数红细胞呈现出健康的圆饼状形态.这说明沉积CNx膜的MWCNTs具有良好的红细胞相容性,且较高的N/C比可提高红细胞的相容性.
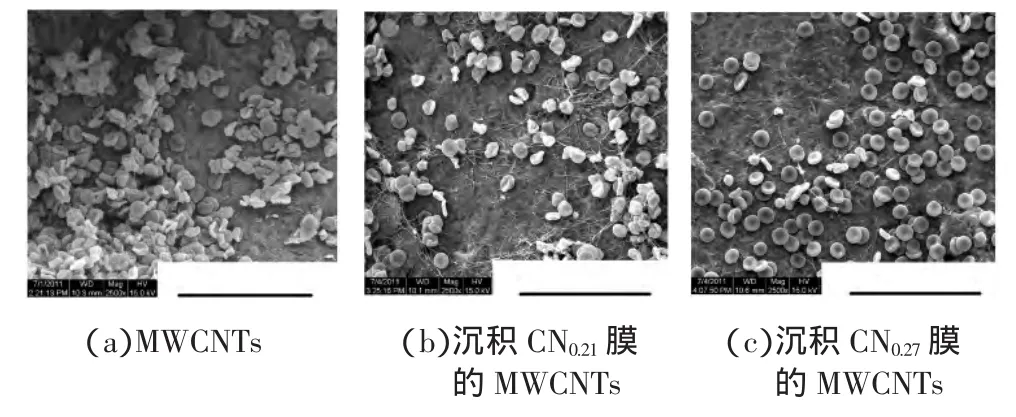
图5 兔血红细胞黏附在材料表面的SEM图Fig.5 SEM images of the rabbit blood cells adhered on samples
除了观察红细胞的形变之外,对其与材料接触后的破损状态也进行了实验测试,结果如图6所示.

图6 材料与兔血作用及离心后照片Fig.6 Images of the centrifugal rabbit blood cells adhered on samples
图6中,红细胞在生理盐水中无破损,细胞中的血红素没有释放出来,所以离心后试管底部沉淀的红细胞形成1个红色圆斑,上清液完全透明;而蒸馏水会破坏红细胞的渗透压,导致红细胞破裂,释放出血红素,因而阳性对照组离心后呈现出红色溶液状.根据与MWCNTs和沉积CNx膜的MWCNTs充分作用1h后溶液的颜色即可判断该材料是否会导致红细胞破损.由图6可以看出,MWCNTs和沉积CNx薄膜的MWCNTs均不会引起红细胞的破裂,这与图5扫描电镜的观察一致.结合小鼠成纤维细胞和兔血红细胞黏附实验的观察结果可以说明:在MWCNTs表面沉积高N/C比的CNx薄膜既不会引起红细胞破裂,也不会导致红细胞变型,MWCNTs具有良好的细胞相容性.
3 结论
本研究采用IBAD方法在MWCNTs表面沉积不同N/C比的纳米CNx薄膜,通过一系列细胞实验证实:沉积CNx膜的MWCNTs具有优于MWCNTs的细胞相容性,小鼠成纤维细胞和人内皮细胞在沉积CNx膜的MWCNTs表面形态扁平、伪足粗壮,生长增殖旺盛,且黏附其上的兔血红细胞也无破损,这说明改性后MWCNTs材料的中等湿润性表面有利于细胞相容性的提高.同时,通过对比3种不同N/C比的沉积CNx膜的MWCNTs的细胞相容性可知,N元素的存在对细胞相容性提高具有积极的促进作用,含氮量最高的沉积CN0.27的MWCNTs表面因其接触角为55.69°,更适宜细胞在其表面黏附增殖,所以具有最强的促进细胞增殖能力,对细胞毒性最小.使用离子束辅助沉积方法,通过调节轰击能量、束流大小等实验条件可以调节CNx膜中N/C比达到最大值,使MWCNTs具有最优的细胞相容性,该方法在生物医用材料改性方面具有良好的发展前景和应用价值.
[1]DRESSELHAUS M S.NT10:Recent advances in carbon nanotube science and applications[J].ACS Nano,2010,4(8):61.
[2] 赵文,张志愿.碳纳米管在生物医学领域的应用现状及展望[J].中国组织工程研究与临床康复,2007,11(9):1758-1760.
[3] LU F S,GU L R,MEZIANI M J,et al.Advances in bioapplications of carbon nanotubes[J].Adv Mater,2009,21(2):139-152.
[4] DE J N,LAMY Y,SCHOOTS K,et al.High brightness electron beam from a multi-walled carbon nanotube[J].Nature,2002,420(6914):393-395.
[5] LI Q,DONG L J,FANG J F,et al.Property-structure relationship of nanoscale ionic materials based on multiwalled carbon nanotubes[J].ACS Nano,2010,4(10):5797.
[6] VASHIST S K,ZHENG D,PASTORIN G,et al.Delivery of drugs and biomolecules using carbon nanotubes[J].Carbon,2011,49(13):4077-4097.
[7] ABARRATEGI A,GUTIÉRREZ M C,MORENO-VICENTE C,et al.Multiwall carbon nanotube scaffolds for tissue engineering purposes[J].Biomaterials,2008,29(1):94-102.
[8] NAYAK T R,JIAN L,PHUA L C,et al.Thin films of functionalized multiwalled carbon nanotubes as suitable scaffold materials for stem cells proliferation and bone formation[J].ACS Nano,2010,4(12):7717-7725.
[9]HIRATA E,UO M,TAKITA H,et al.Multiwalled carbon nanotubecoating of 3D collagen scaffolds for bone tissue engineering[J].Carbon,2011,49(10):3284-3291.
[10]WONG S S,JOSELEVICH E,WOOLLEY A T,et al.Covalently functionalized nanotubes as nanometre-sized probes in chemistry and biology[J].Nature,1998,394:52-55.
[11]KONG J,FRANKLIN N R,ZHOU C W,et al.Nanotube molecular wires as chemical sensors[J].Science,2000,287(5453):622-625.
[12]BAUGHMAN R H,ZAKHIDOV A A,De Heer W A.Carbon nanotubes:the route toward applications[J].Science,2002,297(5582):787-792.
[13]GUOYD,HUANGLY,BAEYENSWR,etal.Novelapplicationof carbon nanotubes for improving resolution in detecting human serum proteins with native polyacrylamide gel electrophoresis[J].Nano Lett,2009,9(4):1320-1324.
[14]HUANG W J,SHIRAL F,LAWRENCE F,et al.Solubilization of singlewalled carbon nanotubes with diamine-terminated oligomeric poly(ethylene glycol)in different functionalization reactions[J].Nano Lett,2003,3(4):565-568.
[15]ROBERT J C,SARUNYA B,KATERINA A D,et al.Noncovalent functionalization of carbon nanotubes for highly specific electronic biosensors[J].Proc Natl Acad Sci USA,2003,100(9):4984-4989.
[16]MOONSUB S,NADINE W S K,ROBERT J C,et al.Functionalization of carbon nanotubes for biocompatibility and biomolecular recognition[J].Nano Lett,2002,2(4):285-288.
[17]CAROLINA S M,EMMANUEL F,EDITH S,et al.Complement activation and protein adsorption by carbon nanotubes[J].Mol Immunol,2006(3),43:193-201.
[18]FANG L,AUDRADE J D.Protein adsorption on low temperature isotropic carbon:how is it related to its blood compatibility[J].J Biomarer Polym Ed,1995,7(5):439-452.
[19]ZHANG L,KINY V U,PENG H Q,et al.Sidewall functionalization of single-walled carbon nanotubes with hydroxyl group-terminated moieties[J].Chem Mater,2004,16(11):2055-2061.
[20]PENG H Q,ALEMANY L B,MARGRAVE J L,et al.Sidewall carboxylic acid functionalization of single-walled carbon nanotubes[J].J Am Chem Soc,2003,125(49):15174-15182.
[21]ZHAO M L,LI D J,GU H Q,et al.In vitro cell adhesion and hemocompatibility of carbon nanotubes with CNxcoating[J].Current Nanoscience,2012,8(3):451-457.
[22]赵梦鲤,李德军,董磊,等.多壁碳纳米管表面沉积不同N/C比的纳米碳氮膜对其抗凝血性能的影响[J].天津师范大学学报:自然科学版,2014,34(2):31-36.
[23] ZHAO M L,LI D J,GUO M X,et al.The different N concentrations induced cytocompatibility and hemocompatibility of MWCNTs with CNxcoatings[J].Surface&Coatings Technology,2013,229:90-96.
[24]中华人民共和国国家质量监督检验检疫总局.GBT 16886.5-2003医疗器械生物学评价第5部分:体外细胞毒性试验[S].北京:中国标准出版社,2003:80-88.
[25]LIANG E J,DING P,ZHANG H R,et al.Synthesis and correlation study on the morphology and Raman spectra of CN nanotubes by thermal decomposition of ferrocene/ethylenediamine[J].Dia Rel Mat,2004,13(1):69-74.
[26]FERRARI A C,RODIL S E,ROBERTSON J.Interpretation of infrared and Raman spectra of amorphous carbon nitrides[J].Phys Rev B,2003,67:155306-155325.
[27]FERRARI A C,ROBERTSON J.Interpretation of Raman spectra of disordered and amorphous carbon[J].Phys Rev B,2000,61:14095-14107.
[28]TAMADA Y,IKADA Y.Fibroblast growth on polymer surfaces an biosynthesis of collagen[J].J Biomed Mater Res,1994,28(7):783-789.
[29]WACHEM P,HOGT A,BEUGELING T,et al.Adhesion of cultured human endothelial cells onto methacrylate polymers with varying surface wettability and charge[J].Biomaterials,1987,8(5):323-328.
[30]IKADA Y.Surface modification of polymers for medical applications[J].Biomaterials,1994,15(10):726-736.
[31]HASSON J,WIEBE D,ABBOTT W.Adult human vascular endothelial cell attachment and migration on novel bioabsorbable polymers[J].Arch Surg,1987,122(4):428-430.
[32]KIESWETTER K,SCHWARTZ Z,HUMMERT T W,et al.Surface roughness modulates the local production of growth factors and cytokines by osteoblast-like MG63 cells[J].J Biomed Mater Res,1996,32(96):55-63.
[33]ALTANKOV G,THOM V,GROTH T,et al.Modulating the biocompatibility of polymer surfaces with poly(ethylene glycol):effect of fibronectin[J].J Biomed Mater Res,2000,52(1):219-230.
[34]GROTH T,ALTANKOV G,KOSTADINOVA A,et al.Altered vitro nectin receptor(alphav integrin)function in fibroblasts adhering on hydrophobic glass[J].J Biomed Mater Res,1999,44(99):341-351.

