水稻中两个同源异型结构域转录因子的亚细胞定位
李政龙,申 奥,栾维江
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
同源异型盒(homeobox,HB)是同源异型基因中都具有的保守基序,广泛存在于动物、植物和微生物中.该序列出现在真核生物进化的早期,在生物发育中具有重要功能[1].由同源异型盒编码的蛋白序列称为同源异型结构域(homeodomain,HD).植物HB转录因子家族可分为6类:HD-Zip(homeodomain-leucinezipper)、KNOX (knotted-like homeobox)、PHD-Finger(plant homeodomain-finger)、BELL(bell homeodomain)、WOX(Wuschel-related homeobox)和 ZF-HD(zinc fingerhomeodomain)[2].其中,HD-Zip由DNA同源异型结构域和附加的leucine-zipper(亮氨酸拉链)元件组成[3],主要参与调控植物正常生长以及环境胁迫后植物的生长发育[4].根据结构域的保守性、序列结构以及生理学功能,HD-Zip家族又可以分为HD-ZipⅠ、HD-ZipⅡ、HD-ZipⅢ和HD-ZipⅣ等4个亚家族[4].HD-ZipⅢ基因是近年来研究较多的一类,在植物胚胎及胚后形态发生(顶端分生组织及侧生分生组织的形成)、侧生器官的极性建立和维管组织细胞分化为叶片的功能等方面具有重要作用[5-6].如拟南芥中HD-ZipⅢ基因家族包括 AtHB8、AVB1(REV)/IFL1//REVOL UTA、AtHB15/CORONA(CAN)、AtHB9(PHV)/PHAVO-LUTA和AtHB14(PHB)等5个成员,它们在调控顶端分生组织的分化、侧部器官的极性和次生维管的发育中发挥重要作用[2].水稻中HD-ZipⅢ也有5个成员,HDZ1和HDZ2是其中的2个基因.
植物蛋白质的亚细胞定位是系统理解植物形态建成、生长发育和逆境耐性等必不可少的环节,也是功能基因组学的重要内容[7].绿色荧光蛋白(green fluorescent protein,GFP)是细胞生物学研究领域广泛使用的一种报告因子,该因子能在蓝光或紫光的激发下产生绿色荧光[8],具有检测方便、高效、无需辅助因子和底物、对宿主细胞无伤害等优点[9],常用于活细胞中蛋白的鉴定、跟踪和分析.1994年Chalfie等[10]首次用GFP作为报告蛋白,之后,GFP作为报告蛋白在多种植物、动物和微生物中均能够成功表达,并逐渐发展为一项成熟的技术[11].
本课题组构建了HDZ1和HDZ2转录因子的GFP融合表达载体,并分析其亚细胞定位,初步研究这2个转录因子在水稻中的功能和作用.
1 实验材料与方法
1.1 实验材料
水稻品种花11及烟草种植于天津师范大学人工气候箱.农杆菌菌株EHA105、pCAMBIA35S-GFP质粒由本实验室保存.
1.2 表达载体的构建
从生长约15d的水稻幼苗中提取RNA.利用RTPCR扩增HDZ1和HDZ2基因编码区(去除终止密码子序列). 所用 HDZ1的引物为 F:5′-TCAgagctc-ATTTGGCTTTGGCGAGGTAG-3′;R:5′-TACgtcgac-CACAAAGGACCAGTTGACGA-3′.HDZ2的引物为 F:5′-ATAgagctcGAGAAGAAGGAGAAGGGTCG-3′;R :5′-CTGtctagaGACGAATGACCAGTTGACGA-3′.反应条件为:95℃,3 min;94℃,30s;55℃,30s;72℃,2.5min,运行32个循环;72℃,5min.回收目的片段.用相应的酶切位点(HDZ1为samI和sacI,HDZ2为sacI和salI)与空载体pCAMBIA35S-GFP连接获得融合表达载体.
1.3 电激转化
将感受态细胞取出解冻,向感受态细胞中加入1~3 μL连接产物,轻轻混匀,加入电击杯中,冰上冷却2~3 min.将电击杯置于电击仪中1800V电击后,取出电击杯中的混合液转入1.5mL离心管中,加入LB培养液培养至1个月,28℃摇床(220r/min)活化 3 min.取200μL涂布LB平板(含50mg/L的卡那霉素或50mg/L的利福平),28℃培养2~3 d.
1.4 GFP融合载体的瞬时表达
挑取含有重组质粒的农杆菌,单克隆于液体培养基中培养2d.待菌液浓度达到OD值为0.5时,取2mL菌液加入离心管中,12000r/min离心1min,去上清液,重复加入2mL菌液,12000r/min离心1min,去上清液.加入2mL注射液(1mol/L的MgCl2、1mol/L的MES和0.2mol/L的AS),充分振荡混匀.将混合液在室温下静置4h,之后进行烟草叶片转化,3~4d后取烟草叶片表皮观察GFP瞬时表达.
2 结果与分析
2.1 基因的同源比较
HDZ1和HDZ2是水稻HD-ZipⅢ家族成员,分别编码1个由839和862个氨基酸组成的蛋白质.HDZipⅢ蛋白含有4个结构域,从N端到C端依次是同源异型结构域(HD)、亮氨酸拉链结构域(ZIP)、START结构域(START)和MEKHLA结构域,如图1(a)所示.其中,HD和ZIP结构域在植物中有较高保守性.通过对HDZ1和HDZ2蛋白的HD和ZIP序列比较,发现二者在HD结构的约60个保守氨基酸序列中,只有 7处不同,分别为第 18、19、24、26、32、39、57号残基,如图 1(b)所示.
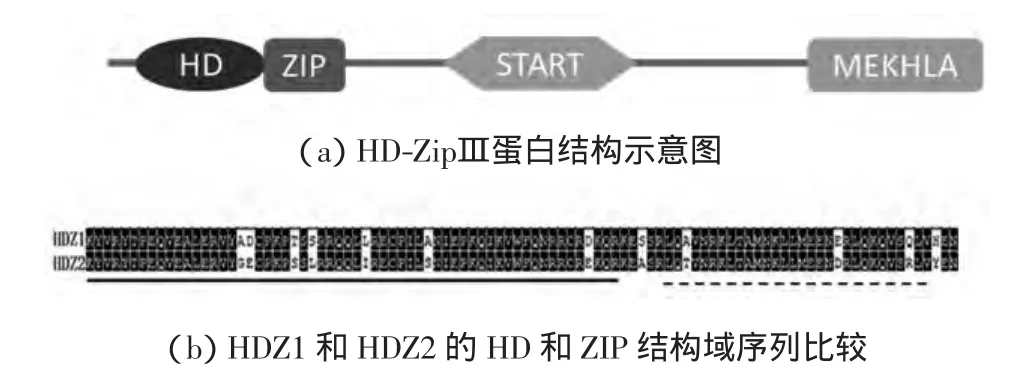
图1 HDZ1和HDZ2蛋白的结构域及同源性比较Fig.1 Homeodomain and comparison of HDZ1and HDZ2
2.2 GFP融合载体的构建及其酶切检测
按照水稻数据库中全长cDNA序列,设计带有与载体中酶切位点对应的特异性引物,用RT-PCR方法扩增目的基因的ORF(去除终止密码子序列).由于该转录因子家族在植物顶端分生组织中有较高的表达[22],因此收集发芽后15d的水稻幼苗,提取RNA,反转录后获得cDNA模板进行PCR反应.HDZ1和HDZ2的ORF长度分别为2520bp和2589bp.为了验证获得的目的基因在PCR过程中是否有碱基突变,对获得的条带进行回收纯化,电泳结果如图2a所示,再进行下一步的酶切和连接.
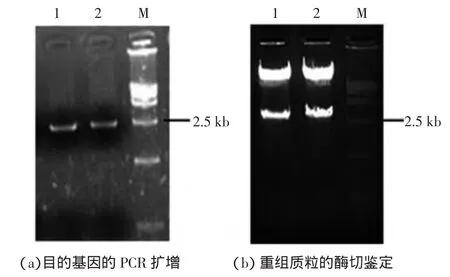
图2 目的基因和重组质粒的电泳图Fig.2 Electropherogram of target genes and recombinant plasmids
连接转化后挑取单克隆进行酶切鉴定,重组质粒都切出了预期的约2.5kb的片段,如图2b所示,进行测序.与数据库中的序列(HDZ1的基因号为LOC_Os03g01890,HDZ2为 LOC_Os03g43930)进行比对和确认,表明目的基因成功连接到载体中,可以进行下一步的亚细胞定位.
2.3 HDZ1和HDZ2亚细胞定位
重组质粒(pCAMBIA35S-HDZ1-GFP、pCAMBIA35SHDZ2-GFP)和空载体质粒(pCAMBIA35S)转入农杆菌中,注射烟草叶片进行瞬时表达,用荧光显微镜(Leica DM5000B)观察,确定HDZ1和HDZ2在细胞中的作用部位.结果表明:在空载体对照中,GFP荧光信号在整个细胞中都有表达,无表达特异性,如图3(a)和图3(e)所示;在pCAMBIA35S-HDZ1-GFP融合瞬时表达中,GFP荧光信号与明场中的气孔完全重合,如图3b~3d所示,这说明HDZ1定位在气孔细胞中,可能在植物的气孔中发挥着重要作用;pCAMBIA35S-HDZ2-GFP融合瞬时表达细胞中,GFP荧光信号主要定位于烟草表皮细胞的细胞膜上,如图 3(f)~图 3(h)所示.

图3 目的基因在烟草叶片下表皮细胞中的瞬时表达Fig.3 Transient expression of target genes in epidermal cells of leaf of tobacco
3 讨论
转录因子(transcription factors,TFs)也称反式作用因子(trans-acting factor),是一类能够与DNA或RNA中顺式作用元件发生特异性相互作用的DNA结合蛋白,通过它们之间以及与其他相关蛋白之间的相互作用激活或抑制某些基因的转录与表达[12].从蛋白质的结构分析,典型的植物转录因子由核定位信号区(nuclear localization signal,NLS)、DNA 结合区(DNA binding domain,BD)、转录调控区(transcription regulation domain)和寡聚化位点区(oligomerization site)等4个功能区域组成[13].核定位信号区将转录因子定位到细胞核[14],所以大多数转录因子定位在细胞核中,如拟南芥中的Roc5[15]、大豆中的GmERF5[16]、小麦中的W17[17]等.但也有例外,如拟南芥热激转录因子AtHsfA6a在细胞质中的表达[18].目前,关于拟南芥HDZipⅢ转录因子家族亚细胞定位方面的研究很少,仅Zhong等[19]发现IFL基因定位在细胞核.在拟南芥的维管组织生长发育过程中,ATHB8具有促进维管组织分化的作用,过量表达会导致木质素积累过多[13].REV、CAN、PHB和PHV可以调控顶端分生组织的分化和侧部器官的极性,但REV与CAN、PHB、PHV在调控维管发育过程中作用相反[20].在叶片极性建立方面,REV和PHB的显性突变体都出现了不同程度的近轴面化,产生了喇叭状叶、棒状叶和针状叶[21].水稻HD-ZipⅢ家族基因与拟南芥HD-ZipⅢ家族基因具有同源性,在功能上可能也是调控顶端分生组织的分化和侧部器官的极性.本课题组研究发现,水稻HDZ1转录因子定位在气孔细胞中,猜测该基因可能在水稻叶片的生长发育中起到一定作用;HDZ2定位在细胞膜上,其功能尚不清楚.虽然HDZ1和HDZ2具有较高的同源性,但在水稻的生长发育中所起作用是否相同有待于进一步研究.
[1] 刘国振,朱立煌.植物同源盒基因的克隆与功能研究[J].遗传,1998,20(3):42-47.
[2] 秦永芳,李登弟,李学宝.植物HD-Zip转录因子研究进展[J].细胞生物学杂志,2009,31(4):514-520.
[3]NAKASHIMA K,ITO Y,YAMAGUCHI-SHINOZAKI K.Transcriptional regulatory networks in response to abiotic stresses in Arabidopsis and grasses[J].Plant Physiol,2009,149(1):88-95.
[4] HARRIS J C,HRMOVA M,LOPATO S,et al.Modulation of plant growth by HD-Zip classⅠandⅡtranscription factors in response to en-vironmental stimuli[J].New Phytol,2011,190(4):823-837.
[5]朱莹莹,于亮亮,汪杏芬,等.HD-ZipⅢ转录因子家族与植物细胞分化[J].植物学报,2013,48(2):199-209.
[6]LUAN W J,SHEN A,JIN Z P,et al.Knockdown of OsHox33,a member of the classⅢ homeodomain-leucine zipper gene family,accelerates leaf senescence in rice[J].Science China:Life Sciences,2013,56(12):1113-1123.
[7] 邢浩然,刘丽娟,刘国振.植物蛋白质的亚细胞定位研究进展[J].华北农学报,2006,21(增刊):1-6.
[8]YANG F,MOSS L G,PHILLIPS G N J R.The molecular structure of green fluorescent protein[J].Nature Biotech,1996,14(10):1246-1251.
[9] HEIM R,CUBITT A B,TSIEN R Y.Improved green fluorescence[J].Nature,1995,373(6516):663-664.
[10]CHALFIE M,TU Y,EUSKIRCHEN G,et al.Green fluorescent protein as a marker for gene expression[J].Science,1994,263(5148):802-805.
[11]张俊莲,王蒂,张金文,等.用绿色荧光蛋白和洋葱表皮细胞检测拟南芥rd29A基因启动子活性的方法[J].植物生理学通讯,2005,41(6):815-819.
[12]BASTOLA D R,PETHE V V,WINICOV I.Alfin1,a novel zinc-finger protein in alfalfa roots that binds to promoter elements in the saltinducible MsPRP2gene[J].Plant Molecular Biology,1998,38(6):1123-1135.
[13]OHASHI-ITO K,KUBO M,DEMURA T,et al.ClassⅢhomeodomain leucine-zipper proteins regulate xylem cell differentiation[J].Plant and Cell Physiology,2005,46(10):1646-1656.
[14]罗红丽,宋凤鸣,郑重.水稻homeodomain型转录因子基因OsBIHD1在抗病和抗逆反应中起不同作用[C]//中国植物病理学会2006年学术年会论文集.北京:中国农业科学技术出版社,2006:304.
[15]ZOU L,SUN X,ZHANG Z,et al.Leaf rolling controlled by the homeodomain leucine zipper class IV gene Roc5in rice[J].Plant Physiology,2011,156(3):1589-1602.
[16]翟莹,杨晓杰,孙天国,等.大豆转录因子GmERF5的克隆、表达及功能分析[J].植物学报,2013,48(5):498-506.
[17]赵云祥,徐兆师,陈明,等.小麦ERF类转录因子W17的结合特异性及亚细胞定位分析[J].中国农业科学,2008,41(6):1575-1582.
[18]巩振辉,逯明辉,马超,等.拟南芥热激转录因子AtHsfA 6a的克隆[J].西北农林科技大学学报:自然科学版,2008,36(4):94-98.
[19]ZHONG R,YE Z H.IFL1,a gene regulating interfascicular fiber differentiation in Arabidopsis,encodes a homeodomain-leucine zipper protein[J].The Plant Cell Online,1999,11(11):2139-2152.
[20]PRIGGE M J,OTSUGA D,ALONSO J M,et al.ClassⅢhomeodomain leucine-zipper gene family members have overlapping,antagonistic,and distinct roles in Arabidopsis development[J].Plant Cell,2005,17(1):61-76.
[21]EMERYJF,FLOYDSK,ALVAREZJ,etal.Radialpatterningof Arabidopsis shoots by ClassⅢHD-ZIP and KANADI genes[J].Current Biology,2003,13(20):1768-1774.
——紫 苏

