不同食物对透明溞种群生长的影响
黄翠,刘其根,胡忠军,侯文华,吴杰洋,何光喜,陈来生
(1.上海海洋大学 农业部水产种质资源与利用重点开放实验室,上海201306;2.杭州千岛湖发展有限公司,浙江 杭州311700)
经典“生物操纵”(biomanipulation)理论就是利用大型植食性浮游动物(主要是溞属枝角类)的牧食作用来抑制浮游植物的大量生长,以控制藻类水华[1]。有研究表明,藻类食物的质量,如营养价值、毒性,以及是否形成群体等均会影响大型浮游动物的生长与发育,反之,也会影响其对浮游植物的摄食[2-4]。透明溞Daphnia hyaline是千岛湖常见的大型滤食性浮游动物[5],其生长、繁殖能力强,具有较强的摄食能力和较高的滤食效率[6],在利用生物操纵控制藻类过度增长上具有很好的应用前景。近年来,国内外有关透明溞的研究也有不少,主要集中在生物因子(食物竞争和捕食等)和非生物因子(温度和营养盐等)对种群的生长、繁殖的影响方面[7-11]。采用Logistic 生长曲线描述动物生长规律的方法已在禽类和哺乳类中得到广泛运用,但鲜见运用于水生浮游动物的研究。本研究中,以千岛湖4种常见的藻类为食物,研究了不同藻类对透明溞种群生长的影响,并揭示了透明溞在不同食物条件下的生长规律,旨在为利用透明溞控制藻类过量增长的可能性提供一定的参考依据。
1 材料与方法
1.1 材料
透明溞采自浙江省淳安县千岛湖。小球藻Chlorella vulgaris、柱孢鱼腥藻170 Anabaena cylindrica 170、铜绿微囊藻469 Microcystis aeruginosa 469、铜绿微囊藻905 Microcystis aeruginosa 905 由中国科学院水生生物研究所藻种库提供(其中的数字为各藻类在该藻种库的FACHB 编号),小球藻和铜绿微囊藻469 为不产毒品系,柱孢鱼腥藻170和铜绿微囊藻905 为产毒品系。
1.2 方法
1.2.1 透明溞的纯化培养及驯化在实验室内进行透明溞纯化培养并进行实验前的驯化,温度为20 ℃。试验中使用同一母体繁殖三代以上的出生6 ~18 h 的幼龄期透明溞作为试验对象。
透明溞驯化期间,投喂密度为5 ×105cells/mL的小球藻。小球藻用BG -11 培养基[12]在光照培养箱中培养,温度为(20 ±1)℃,表面光照为2000 lx,光照周期L∶ D=12∶ 12。在指数生长期,将小球藻离心收集,于4 ℃下保存[13]。投喂前将小球藻用双蒸水稀释到合适的浓度,小球藻的密度用血球计数板计数。由于本试验在透明溞的驯化过程中一直使用小球藻作为食物,同时考虑到在自然水体中小球藻也是透明溞的适宜天然食物,因此,本试验中使用小球藻作为对照。
1.2.2 藻类的培养 正式试验用小球藻、柱孢鱼腥藻170 、铜绿微囊藻469、铜绿微囊藻905 均用BG-11 培养基[12]在光照培养箱中扩大培养,温度控制在25 ℃,表面光照为3000 lx,光照周期L∶ D=16∶ 8,静置培养[14]。
1.2.3 透明溞的培养 试验在20 ℃的恒温光照培养箱中进行,光照强度为2000 lx,光照周期L∶ D=12∶ 12。取30 只出生6 ~18 h 的健康幼溞,放入1000 mL 盛有上海海洋大学校园湖水的烧杯中,停食1 d。试验容器为100 mL 的烧杯,每个烧杯放入100 mL 培养液和1 只幼溞。设置柱孢鱼腥藻170、铜绿微囊藻469和铜绿微囊藻905 3 个饲料处理组,投喂小球藻组作为对照组,每组均设3个平行。藻液用经0.45 μm 孔径微孔滤膜抽滤的校园湖水稀释,保证每次投喂的各组藻细胞密度为5 ×105cells/mL,每天投喂充足的各组藻类并更换试验液,投喂试验共进行25 d。试验期间,每天计数各烧杯中透明溞的种群数量、首次抱卵时间和首次产幼溞时间,计算种群密度和瞬时增长率(r)。
1.3 数据处理
Logistic 方程表达式[15]为
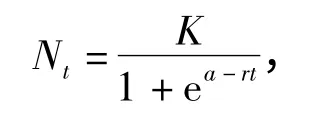
当Nt=K/2 时,透明溞种群密度增长最快,且
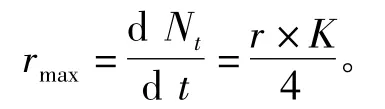
其中:rmax为溞种群最大增长速率(ind./d);Nt为t 时溞种群密度(ind./L);K 为环境容纳量;t为时间(d);r 为瞬时增长率(ind./d);a 为常数。
用Origin 8.0 绘制曲线图。采用SPSS 软件进行单因素方差分析并拟合非线性模型,利用不同日龄、种群密度资料拟合Logistic种群生长曲线,并计算出模型参数的估计值K、a、r,根据拟合度(R2)评价不同食物下透明溞种群的生长动态。
2 结果与分析
2.1 不同藻类对透明溞种群生长的影响
用相同浓度的不同藻类喂养透明溞25 d 后,透明溞的平均种群数量均达到最大值,但各组透明溞的繁殖速度和种群密度有很大差异(图1)。其中,小球藻组(对照)透明溞的种群密度最大,最大种群密度为211.22 ind./L,试验期间一直保持较高的种群密度状态;铜绿微囊藻469 组透明溞的种群增长与对照组无明显差异(P >0.05),仅次于对照组,最大种群密度为133.75 ind./L;柱孢鱼腥藻170 组与铜绿微囊藻905 组透明溞的种群密度增长缓慢,受到显著抑制,最大种群密度都不到小球藻组的1/2,分别为70.00、50.75 ind./L,两组的最大种群密度均显著低于铜绿微囊藻469 组和对照组,但两组间无显著性差异(P >0.05)。
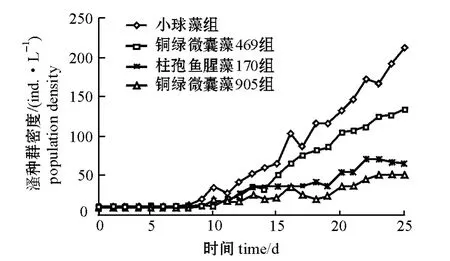
图1 不同藻类对透明溞种群生长的影响Fig.1 Effects of different algae on the population dynamics in water fleas Daphnia hyalina
从表1可见:试验期间,小球藻组透明溞的首次抱卵时间和首次产幼溞时间均比柱孢鱼腥藻170、铜绿微囊藻469和铜绿微囊藻905 组要早,分别在第6天、第9天;铜绿微囊藻469 组透明溞的首次抱卵时间比小球藻组推迟1 d,首次产幼溞时间则推迟2 d;铜绿微囊藻905 组和鱼腥藻170组透明溞的首次抱卵时间和首次产幼溞时间一致,均为第8天和第10天。
2.2 不同食物条件下透明溞的Logistic 生长模型
用Logistic 生长模型对透明溞种群生长发育规律(表2)进行拟合,根据Logistic 公式拟合小球藻、铜绿微囊藻469、铜绿微囊藻905和柱孢鱼腥藻170 组透明溞的Logistic 生长曲线如图2所示。从图2可见:培养期间,透明溞种群数量呈现J 型增长,从试验的第11天开始进入对数增长期,从第20天开始,小球藻组的透明溞进入种群密度最快增长期。
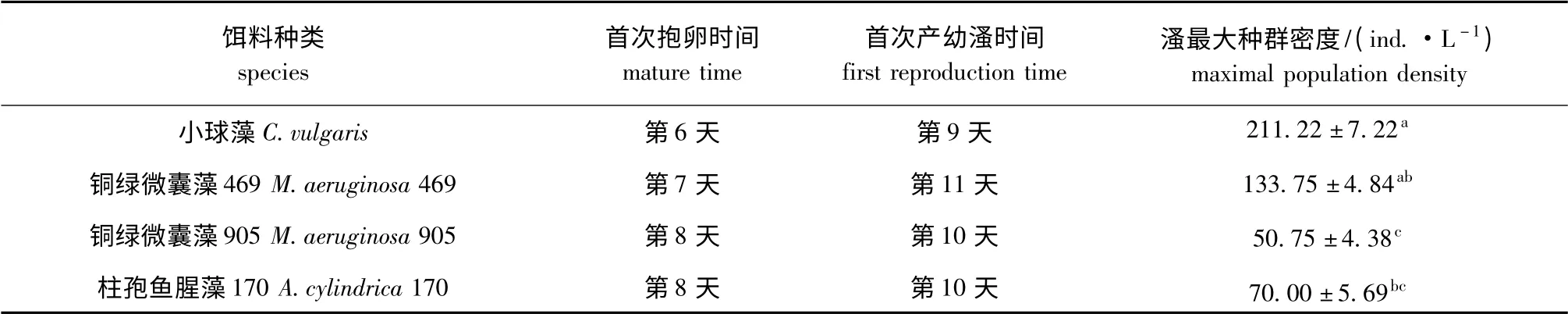
表1 4种不同藻类培养下透明溞种群参数的比较Tab.1 Comparison of population parameters in water fleas Daphnia hyaline fed four algae
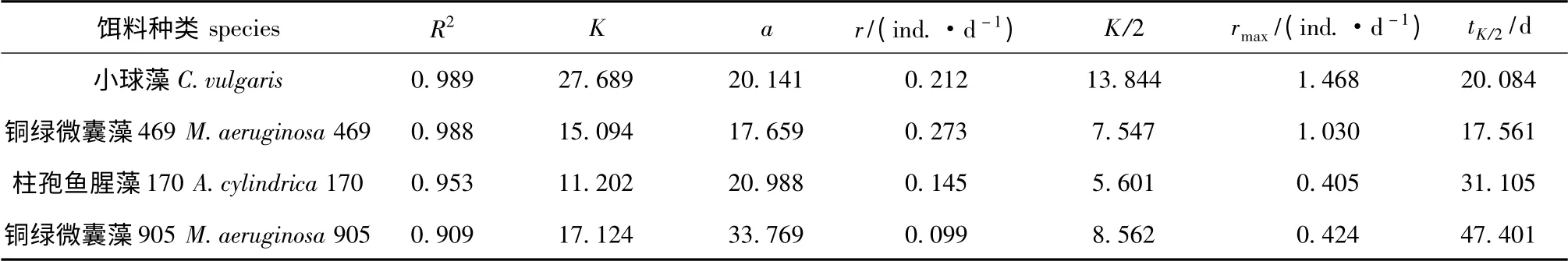
表2 4种不同藻类培养下透明溞种群生长曲线参数的比较Tab.2 Comparison of population growth curve's parameters in water fleas Daphnia hyaline fed four algae
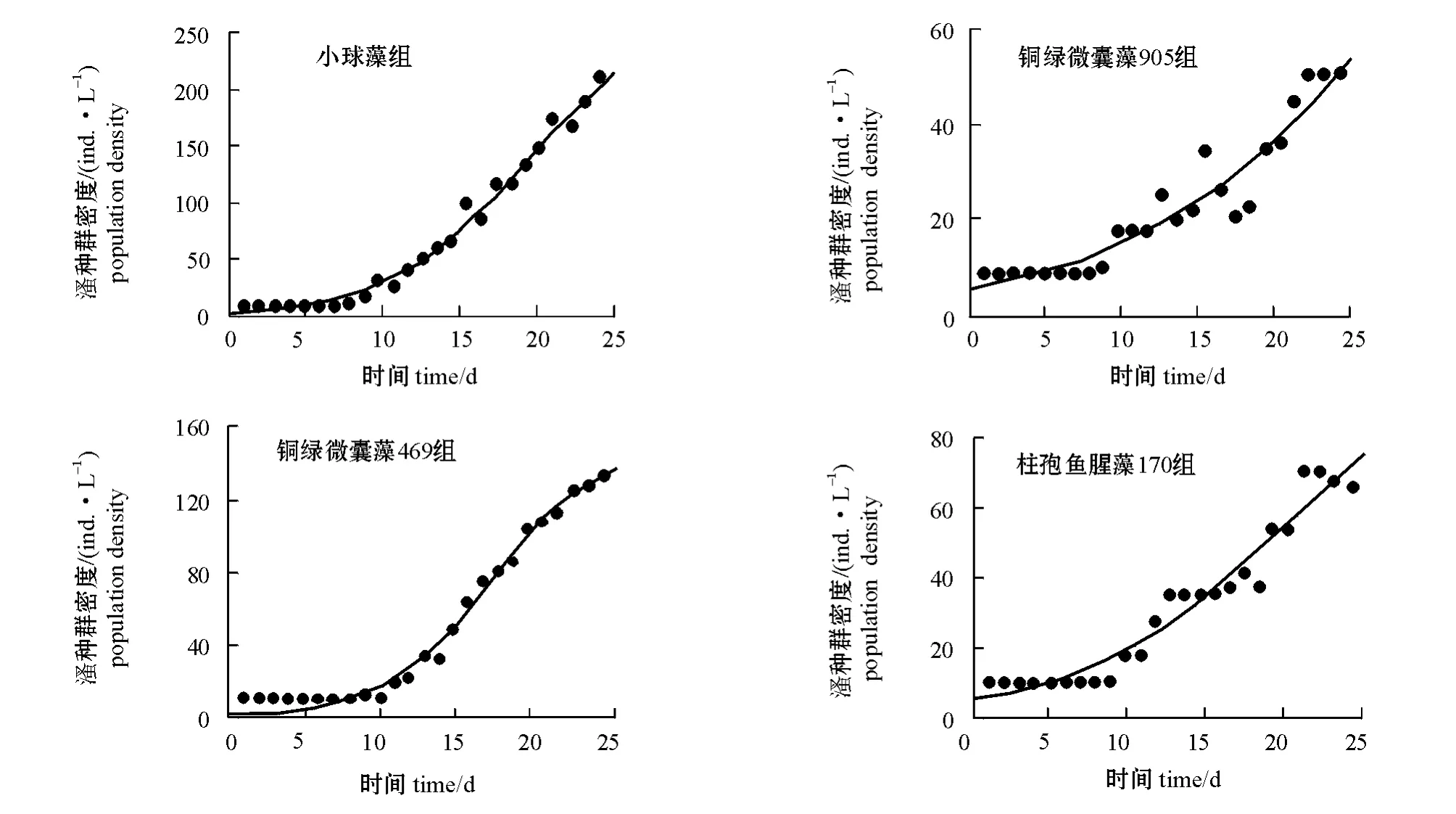
图2 4种不同藻类培养下各组透明溞的生长曲线Fig.2 Growth curve in water fleas Daphnia hyaline under four algae cultivation
小球藻组透明溞种群最大增长速率rmax=1.468 ind./d,拟合Logistic 生长方程为
N=27.689/[1+e20.141-0.212t],R2=0.989;
铜绿微囊藻469 组透明溞种群最大增长速率rmax=1.030 ind./d,拟合Logistic 生长方程为
N=15.094/[1+e17.659-0.273t],R2=0.988;
铜绿微囊藻905 组透明溞种群最大增长速率rmax=0.424 ind./d,拟合Logistic 生长方程为
N=17.124/[1+e33.769-0.099t],R2=0.909;
柱孢鱼腥藻170 组透明溞种群最大增长速率rmax=0.405 ind./d,拟合Logistic 生长方程为
N=11.202/[1+e20.988-0.145t],R2=0.953。
其中:N 为各藻类组透明溞的种群密度(ind./L);t 为培养时间(d)。从种群最大增长速率rmax来看,小球藻组透明溞的种群增长速率最快(1.468 ind./d),而铜绿微囊藻469 组、铜绿微囊藻905组和柱孢鱼腥藻170 组透明溞的种群增长速率均低于小球藻组。
3 讨论
本研究结果表明,以不同藻类为饵料时,透明溞的适应能力与增长率存在显著差异。从母体产幼溞的时间上可以看出,透明溞对4种藻类的适应能力依次为小球藻>柱孢鱼腥藻170 >铜绿微囊藻905 >铜绿微囊藻469,种群瞬时增长率依次为铜绿微囊藻469 >小球藻>柱孢鱼腥藻170 >铜绿微囊藻905,种群最大增长速率依次为小球藻>铜绿微囊藻469 >铜绿微囊藻905 >柱孢鱼腥藻170。这些结果表明,不同藻类对透明溞种群增长的饵料效应是不同的。
造成以上结果的原因可能是藻类的适口性(颗粒的大小和外形的差异)、食物的质量和营养成分等不同。透明溞主要以微型和小型浮游植物为食[16],滤食的食物大小为0.2 ~40.0 μm[17]。本试验中培养的无毒铜绿微囊藻469 没有形成群体,直径为3.0 ~7.0 μm,可能非常适合透明溞的滤食;小球藻细胞颗粒较小,直径为3.0 ~8.0 μm,是适合透明溞滤食的天然食物。但是柱孢鱼腥藻以丝状体存在,细胞一般为球形或腰鼓形,颗粒较大,可能不利于透明溞的摄食。铜绿微囊藻905和柱孢鱼腥藻170 分别产生铜绿微囊藻[18]和鱼腥藻毒素(Anatoxins)[19],它们会在溞体内富集并产生毒性作用,极大地影响了透明溞的生长和种群增长。本试验中还发现,有毒铜绿微囊藻905 组的透明溞种群产幼溞时间与柱孢鱼腥藻170 组一致,但它们的最大种群密度有明显差别,并与小球藻和无毒铜绿微囊藻469 组有显著性差异(表1)。本研究中,有毒铜绿微囊藻905 组和柱孢鱼腥藻170 组透明溞的首次产溞时间均为第8天,比小球藻组推迟2 d。因微囊藻毒素属于内毒素,当透明溞摄食后毒素可能会随着细胞的死亡而被释放出来,且在时间上有些拖延,李效宇等[18]有类似的报道,当微囊藻毒素累积达到一定量后即表现出毒性效应。史文等[20]用有毒铜绿微囊藻905 作为饵料时,大型溞在试验开始前9 d 的存活率为100%,而在随后的4 d 中出现了大量死亡;Demott等[21]和Nizn等[22]的试验研究也得出相似的结果。而鱼腥藻毒素属于外毒素,毒素形成后释放到细胞外,它能引起摄食者呼吸障碍,最后导致其死亡。此外,笔者认为,透明溞虽然能够摄食、消化有毒和无毒微囊藻,但因对营养的吸收不好,影响了透明溞的生长和繁殖,使生殖率下降。Nieuwerburgh等[23]、Olsen等[24]研究表明,食物的化学营养元素组成对溞属生长起限制性作用。不同藻类的营养组成对浮游动物的饵料效应也具有不同的作用。本研究中未对不同藻类的营养成分做分析,透明溞摄食不同藻类后营养成分的响应如何,仍需进一步研究。
在野外自然条件下,微囊藻能否被透明溞所摄食是控制水华的关键问题。林娴等[8]调查发现,在富营养化水体中透明溞能摄食群体微囊藻Microcytis sp.,且这种藻类对透明溞的生长和繁殖并没有明显的抑制作用。其原因可能是枝角类长期以来对环境的适应性产生了对藻毒素可遗传的抵抗力。本试验中所用透明溞采自中度富营养化的千岛湖,试验前经过纯化培养,由此推测,透明溞对蓝藻毒性有一定的耐受能力,并将这种耐受性遗传给后代。因此,透明溞能否有效地控制水华,仍需进一步验证。
[1]Shapiro J,Lamarra V A,Lynch M.An ecosystem approach to lake restoration[J].Biomanipulation,1975,21(6):84 -95.
[2]唐超智,于淼,阮瑞,等.微囊藻毒素对大型溞摄食行为的影响[J].西北农林科技大学学报:自然科学版,2010,38(6):180 -186.
[3]Shin K,Jang M C,Jang P K,et al.Influence of food quality on egg production and viability of the marine planktonic copepod Acartia omorii[J].Progress in Oceanography,2003,57(3):265 -277.
[4]Elendt B P.Nutritional quality of a microencapsulated diet for Daphnia magna.Effects on reproduction,fatty acid composition,and midgut ultrastructure[J].Archivfür Hydrobiologie,1990,118(4):461 -475.
[5]李共国,虞左明.浙江千岛湖浮游动物群落多样性研究[J].生物多样性,2001,9(2):115 -121.
[6]Levine S N,Zehrer R F,Burns C W.Impact of resuspended sediment on zooplankton feeding in Lake Waihola,New Zealand[J].Freshwater Biology,2005,50(9):1515 -1536.
[7]Stich H B,Lampert W.Growth and reproduction of migrating and non-migrating Daphnia species under simulated food and temperature conditions of diurnal vertical migration[J].Oecologia,1984,61(2):192 -196.
[8]林娴,韩博平.富营养化水体中自然食物对透明溞(Daphnia hyalina)生长与繁殖影响的初步实验[J].生态科学,2006,25(2):116 -121.
[9]柯志新,黄良民.溞类(Daphnia)反捕食的表型可塑性及其研究进展[J].湖泊科学,2009,21(6):758 -767.
[10]黄祥飞.温度对透明溞和隆线溞一亚种发育及生长的影响[J].水生生物学集刊,1984(2):207 -224.
[11]徐怡,胡忠军,刘其根,等.温度和不同氮磷浓度培养的小球藻对透明溞生长和繁殖的影响[J].上海海洋大学学报,2011,20(5):712 -718.
[12]Stanier R Y,Kunisawa R,Mandel M,et al.Purification and properties of unicellular blue - green algae(order Chroococcales)[J].Bacteriological Reviews,1971,35(2):171.
[13]陈炜,王秀芬,白永安,等.浓缩方法及保存条件对小球藻藻膏脂肪酸的影响[J].大连海洋大学学报,2012,27(1):1-5.
[14]梁英,范丽敏,陈书秀,等.温度对等鞭金藻塔溪堤品系细胞密度和叶绿素荧光参数的影响[J].大连海洋大学学报,2011,25(11):422 -427.
[15]Zullinger E M,Ricklefs R E,Redford K H,et al.Fitting sigmoidal equations to mammalian growth curves[J].Journal of Mammalogy,1984,65(4):607 -636.
[16]Burns C W.The relationship between body size of filter feeding Cladocera and the maximum size of particle ingested[J].Limnology and Oceanography,1968,13(4):675 -678.
[17]Boersma M,Vijverberg J.Food effects on life history traits and seasonal dynamics of Ceriodaphnia pulchella[J].Freshwater Biology,1996,35(1):25 -34.
[18]李效宇,张志娟,李磊.有毒和无毒微囊藻对大型溞生长和繁殖的影响[J].水生生物学报,2009,33(6):1198 -1201.
[19]朱国营,陈萍萍.柱孢藻毒素对草鱼淋巴细胞毒效应及氧化损伤机理研究[J].环境科学学报,2012,32(5):1199-1204.
[20]史文,刘其根,吴晶,等.不同藻类对大型溞存活和生殖的影响[J].生态学杂志,2009,28(6):1128 -1133.
[21]Demott W R,Zhang Q X,Carmichael W W.Effects of toxic cyanobacteria and purified toxins on the survival and feeding of a copepod and three species of Daphnia[J].Limnology and Oceanography,1991,36(7):1346 -1357.
[22]Nizn S,Dimentman C,Shilo M.Acute toxic effects of the cyanobacterium Microcystis aeruginosa on Daphnia magna[J].Limnology and Oceanography,1986,31(3):497 -502.
[23]Nieuwerburgh L V,Wänstrand I,Snoeijs P.Growth and C∶ N∶ P ratios in copepods grazing on N - or Si - limited phytoplankton blooms[J].Hydrobiologia,2004,514(1/3):57 -72.
[24]Olsen Y,Jensen A,Reinertsen H,et al.Dependence of the rate of release of phosphorus by zooplankton on the P∶ C ratio in the food supply,as calculated by a recycling model[J].Limnology and Oceanography,1986,31(1):34 -44.

