泥鳅鳍细胞系的构建及特性分析
马辰,王福景,李霞,秦艳杰,李雅娟
(1.大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,农业部北方海水增养殖重点实验室,辽宁 大连116023)
泥鳅Misgurnus anguillicaudatus 隶属于鲤形目、鳅科,是中国重要的淡水养殖鱼类之一,其肉鲜味美、营养丰富,不仅是良好的食材,而且还可入药,泥鳅有补中益气、养肾生精之功效。对于泥鳅的生物学研究多集中于生长繁殖[1-2]、遗传育种[3-4]等方面。近十年来,国内外对鱼类细胞系的建立和应用的研究很多,众多淡水鱼类组织细胞系相继成功建立,并被广泛应用于养殖鱼类疾病的诊断、病理学研究和环境监测方面[5-6]。Yan等[7]建立了金鱼Carassius auratus 尾鳍细胞系CFTF,病毒敏感性试验结果表明,该细胞系对蛇头鱼弹状病毒(SHRV)、鲤春病毒血症病毒(SVCV)、斑点叉尾鮰病毒(CCV)易感;肖艺等[8]建立了锦鲤Cryprinus carpiod 鳍条组织细胞系Koi -Fin,该细胞系对锦鲤疱疹病毒(KHV)敏感;谭凤霞等[9]利用草鱼CIK 细胞系测定了镉和铬的毒性。但有关泥鳅鳍细胞系的建立目前尚未见报道,为此,本研究中建立了泥鳅鳍细胞系,并研究了其细胞系的特性。
1 材料与方法
1.1 材料
试验用泥鳅于2012年5月购自大连市农贸市场,全长为8 ~10 cm,体质量为5 ~7 g,在实验室室温条件下暂养一周后用于试验。暂养期间,投喂人工配合饵料,不间断充气,每天换水一次。
试剂DMEM/F12 培养基、胎牛血清(FBS)、胰酶、青霉素-链霉素双抗溶液均为Hyclone 公司产品;人碱性成纤维细胞生长因子(bFGF)、Ⅰ型胰岛素样生长因子(IGF - Ⅰ)均为Peprotech 公司产品;硫酸软骨素为Wolsen 公司产品。其他化学试剂均为分析纯。
1.2 方法
1.2.1 原代培养 参考李霞等[10]、郭莹等[11]对大泷六线鱼组织的原代培养方法,将泥鳅在含高双抗(1000 IU/mL 青霉素,1000 μg/mL 链霉素)曝气的水中暂养24 h 后,用1‰的苯甲醇麻醉,在超净工作台上剪取泥鳅鳍组织,先后用体积分数为10%的碘伏浸泡15 min 以及青霉素和链霉素的混合液(500 IU/mL 青霉素,500 μg/mL 链霉素)浸泡30 min,再用PBS 漂洗两遍后,剪成1 mm3左右的块状并均匀接种于底面积为25 cm2的细胞培养瓶中,在CO2培养箱(5%,25 ℃)中正置干贴24 h后补加培养液至5 mL/瓶,启动原代培养至细胞长成单层。所用培养液为DMEM/F12,并添加体积分数为20%的胎牛血清(FBS)、10 ng/mL 人碱性成纤维细胞生长因子(bFGF)、20 ng/mLⅠ型胰岛素样生长因子(IGF -Ⅰ)和10 μg/mL 硫酸软骨素。
1.2.2 传代培养 待细胞长成单层后,吸出培养瓶中的培养液,加入0.25%的胰蛋白酶溶液1 mL,待细胞变圆后吸掉胰蛋白酶溶液,轻磕细胞培养瓶。将之前吸出的培养液加回,用吸管吹打,制成细胞悬液,将细胞悬液平均分装到两个培养瓶中,并向两个培养瓶中补加培养液至5 mL/瓶,在CO2培养箱(5%,25 ℃)中培养至细胞长成单层后继续用此方法传代。所用培养液配方同原代培养,待传代至30 代后去掉生长因子,所用培养液为20%FBS-DMEM/F12。
1.2.3 细胞超低温保存与复苏 配制含20%FBS、60% DMEM/F12和20%二甲基亚砜的细胞冻存液,置于冰箱(4 ℃)中过夜保存备用。取35 代生长旺盛的细胞,用0.25%的胰酶溶液消化使细胞重悬后,以1500 r/min 离心5 min,弃上清,向沉淀中加入1 mL 细胞冻存液,重悬,调整细胞浓度至1.0 ×106cells/mL,并转至冻存管中。置于冰箱中逐渐降温:4 ℃下放置30 min,-20 ℃下放置2 h、-80 ℃下放置24 h,最后放入液氮容器(-196 ℃)中保存。
取保存在液氮中30 d 的细胞,在40 ℃水中解冻,待细胞冻存液融化后转入25 ℃水浴中,然后在超净工作台上将细胞冻存液转入到离心管中,并加入等量DMEM/F12 培养基,以1500 r/min 离心5 min,弃上清,用20% FBS -DMEM/F12 培养液重悬细胞,转入到底面积为25 cm2的细胞培养瓶中,并补加培养液至5 mL/瓶,在CO2培养箱(5%,25 ℃)中培养24 h 后全量换培养基,继续培养。
取200 μL 细胞悬液加入等量胎盘蓝染色,用细胞计数板计数并计算存活率:
存活率=存活细胞数/细胞总数×100%。
1.2.4 染色体分析 待泥鳅鳍细胞传至40 代时,取处于指数生长期的细胞,加入秋水仙素,使秋水仙素终浓度达到1 μg/mL,混匀,置于CO2培养箱(5%,25 ℃)中继续培养3 ~5 h 后,用0.25%的胰酶溶液消化使细胞重悬,转入离心管中,以1500 r/min 离心5 min,收集细胞。用0.075 mol/L KCl 溶液低渗40 min,用Carnoy 固定液固定15 min,固定3次后滴片,干燥后用Giemsa 染液染色,在高倍油镜下观察并拍照,计数染色体数目。
1.2.5 细胞生长曲线及群体倍增时间的测定 待泥鳅鳍细胞传代至40 代时,用0.25% 胰酶溶液消化使细胞重悬,按每孔500 μL 接种于24 孔细胞板中,接种 密 度 为(3.0 × 104)~(5.0 × 104)cells/mL,置于CO2培养箱(5%,25 ℃)中培养,每24 h 取3 孔细胞用血球计数板计数,连续进行7 d。以培养时间(d)为横坐标,细胞密度(cells/mL)为纵坐标,绘制细胞的生长曲线。根据下式计算细胞的群体倍增时间(t'):
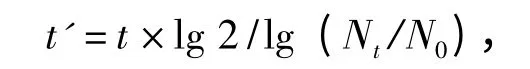
其中,Nt为时间t 时的细胞数,N0为初始接种细胞数。
1.2.6 泥鳅鳍细胞系对鲤春病毒血症病毒(SVCV)和鱼类诺达病毒(YGNNV)的敏感性试验 取60 代生长旺盛的泥鳅鳍细胞,吸去培养液,用PBS 漂洗两遍,分别向瓶内加入0.1 mL SVCV病毒液和YGNNV 病毒液,轻轻晃动培养瓶,使病毒液均匀覆盖细胞培养瓶底,放回到CO2培养箱(5%,25 ℃)中继续培养。待病毒吸附2 h 后,吸去病毒液,加入20% FBS -DMEM/F12 培养液至5 mL/瓶,置于CO2培养箱(5%,25 ℃)中继续培养。同时设置对照组,以0.1 mL DMEM/F12培养基代替病毒液,其他步骤与上述相同。逐日观察细胞形态的变化,并拍照记录细胞病变效应(CPE)。如果未出现CPE 或CPE 现象不明显,则每7 d 盲传一次细胞,直至出现明显的CPE 现象。
1.2.7 SVCV 病毒在泥鳅鳍细胞系上的滴度测定 取60 代生长旺盛的泥鳅鳍细胞,用0.25%的胰酶溶液消化使细胞重悬,调整细胞密度至(1.0 ×105)~(2.0 ×105)cells/mL,按每孔0.2 mL 接种于96 孔板中,置于CO2培养箱(5%,25 ℃)中培养,48 h 后吸去原培养液,接种病毒悬液,测定病毒滴度。病毒悬液按10 倍系列稀释,接种于上述长满细胞单层的96 孔板中,每个稀释度为8孔,置于CO2培养箱(5%,25 ℃)中继续培养,并逐日观察CPE 的出现情况。表示病毒滴度的TCID50值按照Reed等[12]的公式计算。
1.3 数据处理
试验数据用平均值± 标准差表示,并采用SPSS 软件对试验数据进行统计学分析。
2 结果
2.1 原代培养结果
泥鳅鳍组织接种到细胞培养瓶后,培养48 ~60 h 后有细胞从组织块中迁出,并呈纤维状,6 ~7 d 后组织块周围形成单层(图1),培养30 ~32 d后细胞即可长满培养瓶瓶底,形成单层。

图1 泥鳅鳍组织块周围的成纤维细胞样细胞(7 d)Fig.1 Fibroblast-like cells around loach(7 d)
2.2 传代培养及细胞系的建立
首次传代后,细胞6 ~7 d 后即可长满培养瓶瓶底并呈纤维样,连续传代10 代后,细胞增殖速度加快,2 ~3 d 即可长满单层。细胞生长稳定,为成纤维细胞样细胞。目前,泥鳅鳍细胞已传代至63 代(图2)。

图2 第63 代泥鳅鳍细胞Fig.2 Fin cells in generation 63 of loach
2.3 细胞系的保存
对冻存在液氮容器(-196 ℃)中30 d 的鳍细胞复苏后再培养,细胞形态均一,仍为成纤维细胞样,3 ~4 d 长满单层,并且可以继续传代。存活率为81.31% ±1.46%。
2.4 染色体分析
对培养40 代的鳍细胞进行染色体滴片,统计100 个形态清晰、分散好的中期分裂相,染色体数目分布从43 到52 不等,但分裂相染色体数目出现频率最高为50 条(图3),染色体数目为50 的细胞占总细胞数的86%(图4)。
2.5 泥鳅鳍细胞的生长曲线
从第40 代泥鳅鳍细胞的生长曲线(图5)可以看出,细胞在传代后的前2 d 为潜伏期,从第3天开始进入对数生长期,第4天~第6天进入稳定期,第6天后进入衰落期。通过公式计算得到,第40 代泥鳅鳍细胞的群体倍增时间为56.85 h,表明泥鳅鳍细胞生长繁殖能力旺盛。
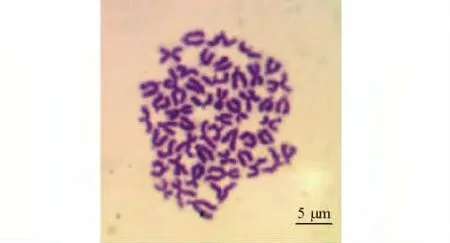
图3 泥鳅鳍细胞40 代染色体中期分裂相Fig.3 Metaphase chromosomes in fin cells from generation 40 of loach
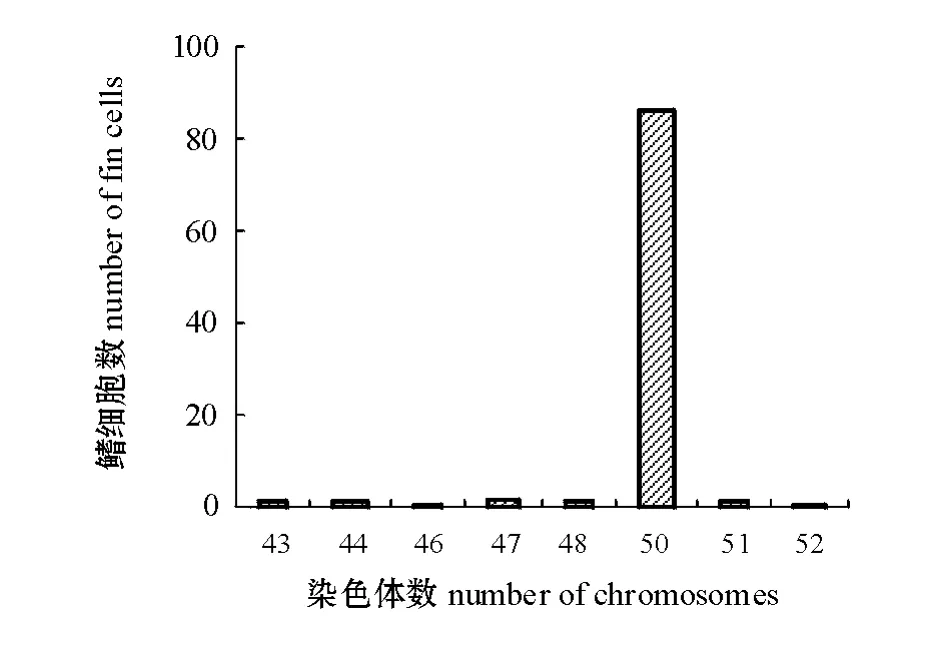
图4 第40 代泥鳅鳍细胞染色体数目的分布Fig.4 Number frequency of chromosomes at 40th generation in diploid fin cells
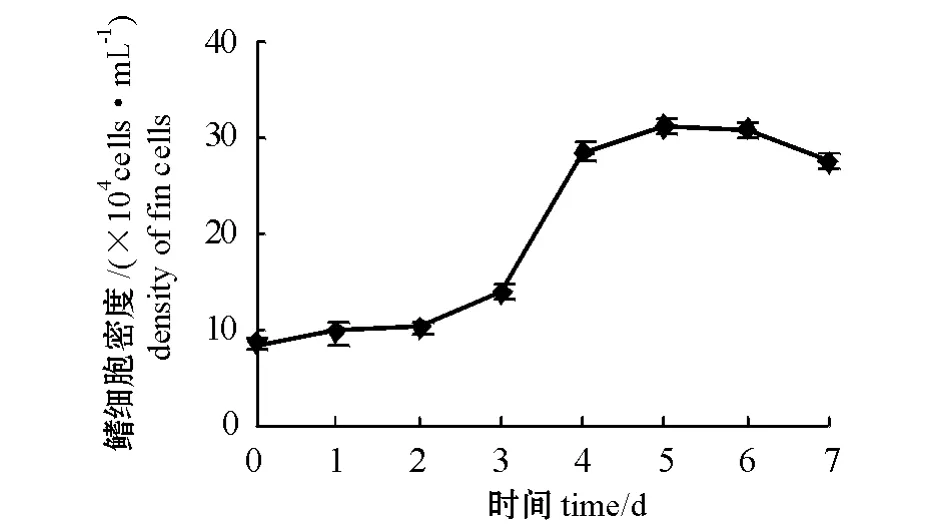
图5 第40 代泥鳅鳍细胞的生长曲线Fig.5 The growth curve of fin cells at generation 40 of loach
2.6 病毒的敏感性
泥鳅鳍细胞长满单层后,接种SVCV 病毒2 d后,细胞出现病变:细胞皱缩,变圆,聚集成团或解体死亡,单层细胞中出现空隙,随着病变的加剧,细胞空泡化和颗粒化越来越严重;接种4 d后,80%左右的细胞出现了CPE(图6 -A),但对照组正常(图6 -B)。经测定,病毒滴度为105.62TCID50/mL。在盲传3 代后发现,泥鳅鳍细胞对YGNNV 病毒不敏感,细胞未出现病变。
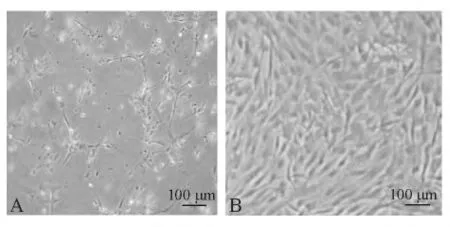
图6 泥鳅鳍细胞感染SVCV 病毒的病变图Fig.6 Cytopathic effect of fin cells from loach with spring viremia of carp virus(SVCV)
3 讨论
3.1 泥鳅鳍细胞系的建立方法
建立可以连续传代细胞系的前提和关键是能够成功的启动原代培养。鱼类原代培养的方法主要包括络合剂分散法、机械分散法、酶消化法、组织块固定法[13]。其中,组织块固定法是将剪好的组织碎块直接接种于培养瓶或培养板中进行原代培养,简便易行,成功率较高[14]。本试验中采用该方法建立了泥鳅鳍细胞系。
本研究中参考大泷六线鱼鳍、吻端、肾[10]的培养方法,在泥鳅鳍细胞培养过程中使用含20%FBS 的DMEM/F12 培养基,与魏云波[15]建立的褐点石斑鱼3种细胞系和Imajoh等[16]报道的真鲷细胞系采用的最适培养基相同。在其他鱼类细胞培养过程中也有采用L-15 培养基的,效果也较好,如Qin等[17]建立的斜带石斑鱼脾脏细胞系以及樊廷俊等[18]建立的大菱鲆鳍细胞系。
鳍组织暴露于外界环境中,所以表面携带大量细菌,而无菌培养是细胞培养成功的关键。所以原代培养的一个重要环节是对所培养的材料进行无菌处理。已有的报道大多采用酒精漂洗或双抗溶液浸泡组织[10,15],但本试验中发现,使用上述消毒方法处理鳍组织不能达到完全除菌,所以尝试使用10%的碘伏。碘伏是一种以表面活性剂为载体和增溶的不定型络合碘,具有性能稳定、使用方便、能缓慢持久释放有效碘、长效杀菌等特点,广泛应用于水产养殖业中。经碘伏和双抗溶液处理后的组织块有效降低了原代培养时的污染,而且细胞迁出、生长等均未受到影响,效果良好。
3.2 泥鳅鳍细胞染色体的分析
在不同生物中,染色体的数目和形态具有物种特异性,所以其可作为种类鉴定的基本依据之一。细胞培养中,染色体数目是鉴定细胞系种属来源以及细胞系是否发生变异的重要指标[19]。本研究中,对培养细胞进行染色体滴片,统计染色体数,发现染色体数出现范围为43 ~54,出现频率最高的为50,即该细胞系特征染色体数目为50 条。这与李雅娟等[3]报道的泥鳅染色体数目一致,证明该细胞系确实来自泥鳅组织,并且传至63 代时细胞系尚未发生染色体变异。
3.3 泥鳅鳍细胞对病毒的敏感性
利用鱼类细胞系感染扩增病毒是鱼类病毒学研究的重要内容。许多鱼类细胞系用于水生病毒的分离、鉴定和扩增,如鲈鳃细胞BF-2、石斑鱼鳍细胞GF和石斑鱼肾细胞GK 用于分离YGNNV 病毒、乌鳢呼肠孤病毒(SnRV)和石斑鱼虹彩病毒(GIV)[20-21]。本试验中所建立的泥鳅鳍细胞对SVCV 病毒敏感,而对YGNNV 病毒不敏感,这可能与YGNNV 病毒宿主主要是海水鱼类有关。SVCV 病毒感染泥鳅鳍细胞后,细胞出现典型的细胞病变效应,所培养的SVCV 病毒可以连续传代感染细胞,病毒滴度为105.62TCID50/mL。说明所建立的泥鳅鳍细胞系可以用于SVCV 病毒的分离、鉴定和体外繁殖,为今后疫苗的研制等研究提供了科学依据。
[1]雷逢玉,王宾贤.泥鳅繁殖和生长的研究[J].水生生物学报,1990,14(1):60 -67.
[2]Li G B,Wang G H,Li D H,et al.Effects of simulated microgravity on fertilization and embryonic development of Misguraus anguillicaudatus[J].Acta Hydrobiologica Sinica,2004,28(2):222-224.
[3]李雅娟,田萍萍,李莹,等.中国洪湖不同倍性泥鳅的染色体组型及形态特征比较分析[J].大连水产学院学报,2009,24(3):236 -241.
[4]印杰,赵振山,陈小奇,等.二倍体和四倍体泥鳅染色体组型比较[J].水生生物学报,2005,29(4):469 -472.
[5]Phelps N B D,Armién A G,Mor S K,et al.Spring viremia of carp virus in Minnehaha Creek,Minnesota[J].Journal of Aquatic Animal Health,2012,24(4):232 -237.
[6]李文峰,麦康森,黄健,等.鱼类细胞培养及其在病毒学研究中的应用[J].动物医学进展,2010,31(5):107 -110.
[7]Yan W,Nie P,Lu Y.Establishment,characterization and viral susceptibility of a new cell line derived from goldfish,Carassius auratus(L.),tail fin[J].Journal of Fish Diseases,2011,34(10):757 -768.
[8]肖艺,曾令兵,徐进,等.锦鲤鳍条组织细胞系的建立及其生物学特性[J].中国细胞生物学学报,2012,34(8):767 -774.
[9]谭凤霞,王敏,王卫民.利用草鱼CIK 细胞和MTT 法测定镉和铬毒性试验的优化[J].水生生物学报,2006,30(3):371-374.
[10]李霞,郭莹,秦艳杰,等.大泷六线鱼三种组织细胞有限传代及其生物学特性分析[J].水产学报,2013,37(2):149-155.
[11]郭莹,李霞,秦艳杰.大泷六线鱼鳍、吻端和肾脏组织原代培养的研究[J].大连海洋大学学报,2012,27(5):387 -391.
[12]Reed L J,Muench H.A simple method of estimating fifty per cent endpoints[J].American Journal of Epidemiology,1938,27(3):493 -497.
[13]于淼,管华诗,郭华荣,等.鱼类细胞培养及应用[J].海洋科学,2003,27(3):4 -8.
[14]曾令兵,李晓莉,张林.等.斑点叉尾鮰肾脏组织细胞系的建立及其生物学特性[J].中国水产科学,2009,16(1):75-81.
[15]魏云波.褐点石斑鱼三种细胞系的建立及其在鱼类病毒和环境污染物检测中的初步应用[D].青岛:中国海洋大学,2009.
[16]Imajoh M,Ikawa T,Oshima S.Characterization of a new fibroblast cell line from a tail fin of red sea bream,Pagrus major,and phylogenetic relationships of a recent RSIV isolate in Japan[J].Virus Research,2007,126(1/2):45 -52.
[17]Qin Q W,Wu T H,Jia T L,et al.Development and characterization of a new tropical marine fish cell line from grouper,Epinephelus coioides susceptible to iridovirus and nodavirus[J].Virol Methods,2006,131:58 -64.
[18]樊廷俊,耿晓芬,丛日山,等.大菱鲆鳍细胞系的建立[J].中国海洋大学学报:自然科学版,2007,37(5):759 -766.
[19]薛庆善.体外培养的原理与技术[M].北京:科学出版社,1999.
[20]Lai Y S,John J A,Lin C H,et al.Establishment of cell lines from a tropical grouper,Epinephelus awoara(Temminck & Schlegel),and their susceptibility to grouper irido - and nodaviruses[J].J Fish Dis,2003,26(1):31 -42.
[21]Nishizawa T,Kokawa Y,Wakayama T,et al.Enhanced propagation of fish nodaviruses in BF -2 cells persistently infected with snakehead retrovirus(SnRV)[J].Dis Aquat Org,2008,79:19 -25.

