复方紫花地丁对鸭大肠杆菌耐药质粒的消除作用
余建国 金华职业技术学院浙江金华 321007
复方紫花地丁对鸭大肠杆菌耐药质粒的消除作用
余建国 金华职业技术学院浙江金华 321007
以复方紫花地丁制剂为消除剂、十二烷基硫酸钠为对照组消除剂,以鸭大肠杆菌耐药菌株为靶细菌,进行耐药质粒体外消除试验,通过质粒DNA抽提及琼脂糖凝胶电泳方法,观察紫花地丁注射液对该耐药菌株质粒的影响。结果提示:复方紫花地丁制剂对耐药鸭大肠杆菌作用24 h,其1/2 MIC、1/4 MIC、1/8 MIC的消除率分别为6.9%、8.6%、10.2%;延长作用时间至48 h,其1/2 MIC、1/4 MIC、1/8 MIC的消除率分别为7.1%、8.9%、11.3%。结果表明:复方紫花地丁制剂对鸭大肠杆菌耐药质粒有消除作用。在一定浓度范围内,剂量与功效呈反比。
复方紫花地丁 耐药质粒 鸭大肠杆菌 消除
鸭致病性大肠杆菌(duck pathogenic Escherichia coli)是危害养鸭业的最重要的病原之一。由于抗菌类药物在养殖业中的滥用,导致大肠杆菌存在广泛的耐药性。细菌产生耐药的机制十分复杂,根据耐药状况,细菌耐药分为两类:第一类,即单一耐药因素,细菌对一类抗菌药物的所有种类都耐药;第二类,多重耐药性,因质粒或染色体介导的耐药因素,使细菌对多类抗菌药物耐药[1]。
目前,致病性大肠杆菌耐药性的解决途径主要有以下几种:一是减少抗菌药物的使用并保护现有药物。二是开发膜通透性较好的药品,使药物的内流速度大于外排;此外,研制大肠杆菌多重耐药的抑制剂及替代产品等工作也在进行中。解决耐药性问题是一项复杂、持续而艰巨的任务,且部分工作耗资巨大,按照我国的现状,这项工作依然任重道远。将耐药质粒从宿主菌中消除,使其恢复对抗生素的敏感性,是临床治疗多重耐药菌感染的新思路。
国内外有人利用理化因素和中药对耐药质粒进行消除,质粒消除后细菌的耐药性也随之丧失,并且不再恢复,但理化因素对机体毒副作用较大,而中草药由于毒副作用小、价格便宜及体内使用安全而备受重视[2]。中药制剂的开发和研究是诸多途径中逐渐引起学者重视的一种,药理学研究提示:部分中药及其提取物可以减弱甚至逆转细菌的耐药性。已经证实有抗菌作用的中药黄芩、黄连、金银花、三黄片等也能降低细菌的耐药性。一般认为中药逆转细菌耐药性的机制,包括R质粒的消除作用;抑制药物的主动外排泵、抑制β内酰胺酶活性等[3]。
紫花地丁(Herba Violae)为堇菜科(Violaceae)植物紫花地丁(Viola yedoensis Makino)的干燥全草。药理作用学研究提示:紫花地丁中所含内酯具有抗炎及体外抑菌作用[4-5]。
本试验究按照祖国传统医学中君丞佐使的配伍原则,以紫花地丁为主,辅以金银花、野菊花、蒲公英等,按一定比例配制成复方紫花地丁制剂。并选取该制剂作为消除剂,对鸭大肠杆菌耐药质粒进行体外消除试验,研究复方紫花地丁制剂对耐药质粒的消除作用,为临床上有效治疗鸭大肠杆菌病提供依据。
1 材料与方法
1.1 材料
1.1.1 药品和试剂复方紫花地丁制剂,由紫花地丁、金银花等药物制备,含生药1 g/mL,自制。十二烷基硫酸钠(SDS):购于上海市化工试剂厂,批号20130822。药敏纸片,购自杭州天和微生物试剂有限公司。
1.1.2 培养基Chapman's培养基:含蛋白胨10 g/ L、牛肉膏1 g/L、氯化钠75 g/L、琼脂18 g/L、甘露醇10 g/L、1 g/L酚红溶液25 mL,pH7.4。麦康凯琼脂、营养肉汤、营养琼脂及琼脂粉等,购自杭州天和微生物试剂有限公司。
1.1.3 菌株鸭源性大肠杆菌标准菌株K88,福建省农业科学院提供,质控对照菌株ATCC29213购于中国兽药监察所。
耐药菌的诱导:取过夜生长的敏感细菌K88培养液0.1 mL,涂于含1/2 MIC恩诺沙星的普通琼脂平板上,37℃培养16~18 h,挑取平皿上的单个菌落于营养肉汤中37℃培养过夜,次日取0.1 mL的培养液涂于含1MIC恩诺沙星的普通琼脂平板上,重复上述过程并不断增加平皿中恩诺沙星的浓度,直至细菌的MIC值提高至≥8.0 ug/mL。测定所得菌株的MIC,并经过三次平皿传代培养,证实为非适应性生长后保存备用,将该菌编为K881。
1.2 耐药性消除试验
1.2.1 质粒体外消除试验试验组:将K881菌株接种于营养肉汤中,37℃培养过夜,再接种于Chapman's培养基上培养24 h,挑取琼脂表面生长良好的单个菌落,混悬于营养肉汤培养基中,37℃培养12 h,调整菌液浓度到1×106CFU/mL,备用[6]。取100 μL菌液分别加入含不同浓度中药制剂的培养基中(制剂起始浓度为1 g/mL,依次二倍稀释至第7管,第8管不加药物作为菌液对照,第9管不加菌液作药物对照,第10管只加肉汤作空白对照),每管液体培养基总量1 mL。
37℃培养24 h和48 h,判定亚抑菌浓度。分别取24 h和48 h的1/2 MIC、1/4 MIC、1/8 MIC的3管菌液100 μL进行稀释,接种Chapman's培养基,涂匀后37℃培养24~48 h,取50 mL培养物划线接种于普通平板,37℃培养16~18 h。待长出单个菌落后,用灭菌牙签挑取500个菌落,以影印培养法,对应点种于含恩诺沙星药物不同浓度平板上和不含药物的普通平板上,37℃培养24 h,观察并记录结果。
对照组:取K881菌液20 uL,接种于含亚抑浓度消除剂(SDS,亚抑菌浓度根据文献为100 ug/mL)的营养肉汤中,37℃培养24~48 h,取50 mL培养物划线接种于普通平板,37℃培养16~18 h。取50 mL培养物划线接种于普通平板,37℃培养16~18 h。待长出单个菌落后,用灭菌牙签挑取500个菌落,以影印培养法,对应点种于含恩诺沙星药物不同浓度的平板上和不含药物的普通平板上,37℃培养24 h,观察并记录结果。进行2次重复性试验。
1.2.2 消除子的筛选与鉴定挑取在含抗菌药物的选择平板上不生长,而在不含药物的普通平板上生长的菌落,在普通培养基上传代后,再在含药平板上进行复测后证实,即为质粒消除子,并检查其菌落、菌形及染色特征[6]。
根据耐药性消除菌落数与检测菌落总数之比,计算测试菌耐药性消除率。将搜集到的消除子与原菌液同时按文献[7]改进碱裂解法进行快速质粒DNA抽提,琼脂糖凝胶电泳,以检测质粒带的消失情况。将试验组与对照组所得菌株的耐药性消除率应用统计软件SPSS 10.0进行x2检验,以比较差异性。
2 结果与分析
1)用复方紫花地丁制剂作用耐药鸭大肠杆菌24 h、48 h(1/2 MIC、1/4 MIC、1/8 MIC)后,其消除结果与SDS对照组比较,均有极显著差异(P<0.01)。表明复方紫花地制剂在体外,具有消除鸭大肠杆菌耐药质粒的作用,并且消除效果显著高于SDS对照组。用不同浓度复方紫花地丁制剂作用耐药鸭大肠杆菌,其消除结果与对照组均有显著性差异(P< 0.05),表明不同浓度的复方紫花地丁制剂对鸭大肠杆菌耐药质粒有明显的影响,在一定浓度范围内,剂量与功效呈反比。
2)同一浓度复方紫花地丁制剂在不同时间作用耐药鸭大肠杆菌,其消除结果无显著性差异(P> 0.05),表明不同作用时间对鸭大肠杆菌耐药质粒的消除没有影响(试验结果见表1-表2)。
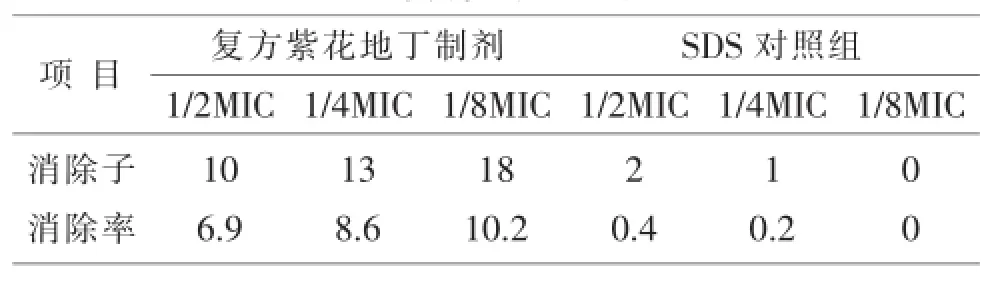
表1 不同浓度复方紫花地丁制剂作用24 h对鸭大肠杆菌耐药质粒的消除率
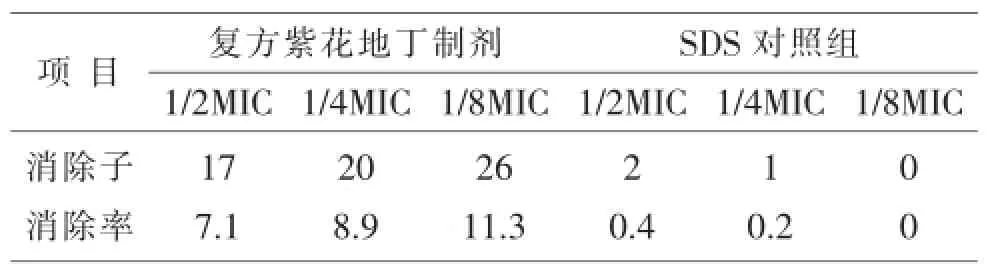
表2 不同浓度复方紫花地丁制剂作用48 h对鸭大肠杆菌耐药质粒的消除率
3)消除子质粒的检测。原始株与消除子经改进碱裂解法快速抽提质粒DNA,琼脂糖凝胶电泳观察发现,消除子均丢失1~2条质粒带,表明在复方紫花地丁制剂作用下,鸭大肠杆菌菌质粒被消除。结果见图1-图2。
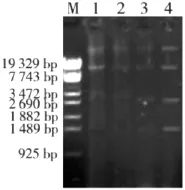
图1 复方紫花地丁制剂作用24 h对鸭大肠杆菌质粒消除的电泳图谱(M:DNA标准,1:1/2MIC消除菌株,2:1/:4MIC消除菌株,3:1/8MIC消除菌株,4:耐药菌株)
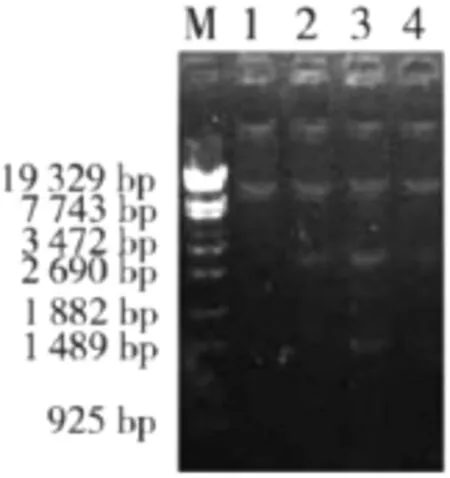
图2 复方紫花地丁制剂作用48 h对鸭大肠杆菌质粒消除的电泳图谱(M:DNA标准,1:1/2MIC消除菌株,2:1/:4MIC消除菌株,3:1/8MIC消除菌株,4:耐药菌株)
3 讨论
1)陈群等用中药黄芩与止痢灵对重耐药性大肠杆菌E10株进行了体外R质粒消除试验,发现与单一中药比较,联合用药可以显著提高消除效果[7]。本试验选用的复方紫花地丁制剂为对鸭大肠杆菌制作用的制剂,MIC为120 mg/mL,故选其作为质粒消除剂。结果提示:一定浓度复方紫花地丁液对鸭大肠杆菌的耐药质粒具有良好的体外消除作用,效果显著优于SDS。此外,复方紫花地丁液还表现出对多重耐药性的消除作用。
2)随着复方紫花地丁制剂浓度的减小,其对耐药鸭大肠杆菌的耐药质粒消除率上升,并且有显著性差异。进行重复性试验后仍呈现此规律。24 h和48 h的消除率随时间的延长有所提高,但没有显著性差异。表明在一定浓度范围内,剂量与功效呈反比;作用时间对其质粒消除效果没有显著的影响。这与陈群等的结果呈现不一致,可能与中药抑制试验尚缺乏统一标准有关。
3)有中药质粒消除试验证明,质粒条带没有消除的菌株,其抑菌圈仍有扩大。推测可能是因为部分决定耐药基因被消除,导致碱基数量减少,在凝胶电泳上不能将它们区分。或者制剂作用后菌体内环境发生改变,使一些耐药片段发生突变,成为“沉默基因”,关于此现象,将在后续试验中加以证实[8]。
4)中药制剂虽然一定程度发挥了耐药消除作用,但作用缓慢。这可能与其有效成分含量低有关。在今后的实践中,应用现代中药提取、分析、精制技术,开发抑制细菌耐药性的纯天然高活性抑制剂是比较理想的方向。此外,用于耐药性消除的中药本身都具有一定的抗菌效果,其抗菌能力的强弱与逆转细菌耐药性之间是否相关还有待进一步研究。
[1]杜银忠,谭俊.乳源鸭大肠杆菌耐药基因定位的研究[J].黑龙江畜牧兽医,2008,9(1):60-62.
[2]李苌清,周歧山,凌保东.耐药质粒消除的研究概况与展望[J].川北医学院学报,2003,18(2):168-171.
[3]王静,张淑文.中药逆转细菌耐药的研究进展[J].临床和试验医学杂志,2007,6(1):153-155.
[4]倪语星,洪秀华.细菌耐药性监测与抗感染治疗[M].北京:人民军医出版社,2002.
[5]张文平,曹镐禄,张文书,等.千里光水浸液对大肠埃希菌R质粒的消除作用[J].广东医学,2007,28(8):1238-1239.
[6]刘立新,刘芳萍,李睿,等.中药消除细菌耐药性的研究进展[J].畜牧兽医科技信息,2008,12(5):15-16.
[7]龙海英,刘衡川,方梅.质粒消除方法及消除效果的评价研究[J].中国卫生检验杂志,2007,17(3):413-415.
[8]搂恺,班睿,赵学明.细菌质粒的消除[J].微生物学通报, 2002,29(5):99-103.
Mination effcect of complex prescription Herba Violae antibiotic resistant plasmid of duck pathogenic Escherichia coli
Yu Jianguo
(Faculty of Bioengineering,Jinhua Polytechnic,Zhejiang 321007)
The multidrug resistant plasmid from the strain of complex prescription Herba Violae agent,which was isolated from the duck with pathogenic Escherichia coli,was extracted and the elimination test was performed in vitro with sodium dodecyl sulp hate as negative control.The effect of the complex prescription Herba Violae agent prescription dandelion's injection or the plasmid elimination was detected by plasmid DNA extraction and agarose gel electrophoresis,and the feasibility of the complex prescription Herba Violae agent was discussed as elimination reagent.In result,the elimination rate of resistant plasmid of 1/2,1/4 and 1/8 MIC was 6.9%, 8.6%and 10.2%respectively after t reatment of the prescription Herba Violae agent for 24 h.The elimination rate of resistant plasmid of 1/2,1/4 and 1/8 MIC was 7.1%,8.9%and 11.3%respectively at 48 h.These results showed that the elimination effect of t he complex prescription Herba Violae agent was clearly and high feasibility for clinic use.
complex prescription Herba Violae antibiotiresistant plasmid duck pathogenic Escherichia coli elimination
A
1003-4331(2014)06-0032-03

