基质金属蛋白酶1及其抑制剂在白藜芦醇治疗佐剂性关节炎中的表达
安 梅,孙和炎,卢锦森,马中飞,纵何香,叶桂萍,郭利梅,何舒宁,陈晓宇
◇基础医学研究◇
基质金属蛋白酶1及其抑制剂在白藜芦醇治疗佐剂性关节炎中的表达
安 梅1,2,孙和炎3,卢锦森4,马中飞4,纵何香4,叶桂萍4,郭利梅4,何舒宁4,陈晓宇1
目的观察基质金属蛋白酶1(MMP-1)及其抑制剂(TIMP-1)在白藜芦醇治疗佐剂性关节炎(AA)的滑膜组织和关节软骨中的表达,探讨MMP-1及TIMP-1的异常表达是否参与AA的发病机制。方法60只SD大鼠随机分为2组:正常组(10只),模型组(50只)。模型组弗氏完全佐剂注射诱导关节炎12 d后,在其足趾出现继发性免疫炎症反应时,又随机分成4组:模型对照组、白藜芦醇低剂量组(5 mg/kg)、白藜芦醇高剂量组(15 mg/kg)、阳性对照雷公藤多苷组(100 mg/kg)。大鼠每天均灌胃给予溶媒或药物,持续16 d后处死大鼠;免疫组化法检测滑膜组织MMP-1、TIMP-1表达;滑膜组织匀浆,Western blot法检测MMP-1、TIMP-1蛋白含量。结果白藜芦醇能明显抑制模型组大鼠病理损害程度,模型组滑膜组织MMP-1、TIMP-1高表达,白藜芦醇治疗组能抑制MMP-1、TIMP-1的高表达,在抗关节炎的作用上有相关性。结论白藜芦醇具有抑制AA大鼠的炎症作用,防止关节退变的病理变化,其机制与调节大鼠的基质金属蛋白酶在滑膜组织和关节软骨的表达有关。
佐剂性关节炎;白藜芦醇;基质金属蛋白酶1;基质金属蛋白酶抑制剂-1;免疫印迹;大鼠
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症和关节破坏为特征的慢性自身免疫性疾病,其病理特点表现为滑膜细胞类肿瘤样增生,引起软骨及骨的破坏。基质金属蛋白酶(matrix metalloproteinase,MMPs)是一族降解几乎所有细胞外基质(extracellular matrix,ECM)为主要功能的酶,若MMPs分泌过量,或与MMPs抑制剂(tissue inhibitor of metalloproteinase,TIMPs)比例失衡,将导致滑膜组织和软骨的ECM过量降解,在RA的发生及发展过程中起着重要的作用[1]。白藜芦醇是一种天然活性多酚化合物,主要存在于虎杖、葡萄等植物中,白藜芦醇口服在肠道以葡萄糖醛酸酯形式吸收,其吸收和消除均较快。白藜芦醇具有抗增殖及调节免疫等多重功效,为RA等疾病的治疗提供了新的思路,其可能在抗风湿的同时减少免疫抑制剂的使用,降低RA复发,改善患者预后[2]。笔者应用免疫组织化学法、Western blot法检测佐剂性关节炎(adjuvant arthritis,AA)大鼠滑膜组织MMP-1、TIMP-1的表达,以探讨其与AA大鼠软骨和骨的退变之间的关系。
1 材料与方法
1.1 实验动物分组及给药
健康雄性SD大鼠,清洁级,体重160~180 g,购自安徽医科大学实验动物中心。大鼠自由摄食饮水,室温(25±2)℃,适应环境1周后随机分为2组:正常组(10只)、模型组(50只)。模型组以弗氏完全佐剂(freund's complete adjuvant,FCA)(卡介苗80℃、1 h灭活后与高压消毒的液体石蜡充分碾磨混匀,配成10 mg/ml的乳剂)于每鼠右后足趾皮内注射0.1 ml致炎。于致炎第12天,模型组大鼠随机均分为4组:模型对照组,白藜芦醇低、高剂量(5、15 mg/kg)组和阳性药雷公藤多苷(100 mg/kg)对照组,每周称体重1次,根据体重适时调整用药剂量,连续灌胃(10 ml/kg)给药16 d,正常组及模型组给予等剂量溶媒的0.5%(m/V)羧甲基纤维素钠。
1.2 主要仪器与试剂
足跖容积测量仪YLS-TA购自山东医学科学院;全自动高速冷冻离心机GL20A购自湖南仪器仪表总厂;白藜芦醇购自美国Sigma公司,纯度>98%,溶于无菌0.5%羧甲基纤维素钠中;兔抗大鼠MMP-1、TIMP-1一抗均购自美国Santa Cruz公司;生物素化山羊抗兔IgG二抗购自北京中杉金桥生物技术有限公司;BCA试剂盒、ECL化学发光试剂盒购自美国Amersham Life Sciences公司。
1.3 关节炎症指数评分参照课题组先前建立的方法[3],在AA大鼠致炎后第12天,每4 d进行一次关节炎指数评分,记录各组大鼠多发性关节炎病变的发生和严重程度。每只足爪按以下标准评分:0分,正常;1分,踝关节红斑和轻微肿胀;2分,踝关节至跖关节或掌关节红斑和轻微肿胀;3分,踝关节至跖趾关节或掌关节红斑和中度肿胀;4分,踝关节到趾关节红斑和重度肿胀,最高评分12分。用排水法测定大鼠左踝关节(非致炎侧)以下的容积变化(Δml),以致炎后-致炎前的差值表示其肿胀度,观察各组大鼠继发性炎症肿胀情况。第28天麻醉下处死各组大鼠,每组4只进行石蜡包埋形态学检查,另6只迅速取踝关节滑膜组织,液氮冻存,检测MMP-1和TIMP-1蛋白表达。
1.4 踝关节免疫组化SP染色和软骨细胞MMP-1和TIMP-1阳性细胞分数计数按照SP试剂盒说明书操作,大鼠踝关节以4%多聚甲醛固定,脱钙,脱水,石蜡包埋,5 μm厚连续切片,采用SP法进行免疫组化染色:3%过氧化氢灭活内源性过氧化物酶,微波行抗原修复,5%羊血清封闭20 min,分别滴加兔抗大鼠MMP-1和TIMP-1单克隆抗体(浓度1∶200),4℃孵育过夜,滴加生物素化羊抗兔IgG二抗,37℃孵育20 min,DAB显色、苏木精复染、脱水、透明、封片,光镜下观察。每项检测均设阴性对照,以PBS代替一抗。光镜下组织切片呈棕黄色颗粒性沉积区域为阳性染色部位。参照文献[4]计算阳性细胞细胞分数,每张MMP-1、TIMP-1免疫组化切片随机选取9个视野,其中软骨表层、中层和下层各3个视野,在400倍光镜下,计算每个视野的MMP-1、TIMP-1阳性细胞数和细胞总数,用细胞分数(%)=阳性细胞数/细胞总数×100%表示,最大值为100%。由两位独立的观察者分别对每张切片进行细胞计数,评分误差率控制在5%以内,取两者均值计分。
1.5 Western blot法检测MMP-1和TIMP-1蛋白表达将液氮中冻存的各组滑膜组织分别取样,按BCA试剂盒说明书操作,测定总蛋白含量后分装,置-80℃冰箱备用。各组蛋白分别取50 μg,煮沸变性,进行SDS-PAGE分离,将蛋白质电转移法至硝酸纤维素膜。硝酸纤维素膜在10%脱脂奶粉的PBST缓冲液中4℃封闭过夜,分别加兔抗鼠MMP-1(1∶1 500)和TIMP-1(1∶1 500)和兔抗鼠β-actin抗体(1∶1 000),37℃孵育2 h,加入辣根过氧化物酶标记的羊抗兔IgG(1∶1 000),37℃孵育2 h,ECL试剂盒化学荧光法显色,利用Image J灰度分析软件Western blot结果作半定量分析。
1.6 统计学处理
2 结果
2.1 白藜芦醇对大鼠继发炎症的影响
致炎后模型组大鼠右足(注射测)开始肿胀,出现继发性炎症病变(对侧)出现于致炎后的第12天左右,表现为左侧和前足肿胀,呈进行性加重,行动不便,站立不稳。模型组大鼠左足较相应时间点的正常组足爪关节明显肿胀,差异有统计学意义(P<0.01);白藜芦醇治疗组和雷公藤多苷组降低了AA大鼠多发性关节炎指数,白藜芦醇大剂量治疗组较小剂量组更为明显,见表1。
2.2 白藜芦醇对AA大鼠继发性足肿胀的影响
表1 白藜芦醇对AA大鼠继发炎症的多发性关节炎指数评分的影响(n=10,±s)

表1 白藜芦醇对AA大鼠继发炎症的多发性关节炎指数评分的影响(n=10,±s)
与正常组比较:ΔΔP<0.01;与模型组比较:*P<0.05,**P<0.01
组别多发性关节炎指数第12天第16天第20天第24天第28天正常0.58±0.820.79±1.060.91±1.120.97±1.220.96±1.42模型5.8±2.2ΔΔ6.9±2.6ΔΔ8.3±2.8ΔΔ9.2±2.7ΔΔ7.52±2.27ΔΔ白藜芦醇(5 mg/kg)5.7±1.65.9±2.26.2±2.3*6.9±2.7*4.9±1.7**白藜芦醇(15 mg/kg)5.3±1.85.7±1.95.5±1.8**5.4±1.9**3.7±1.4**雷公藤多苷(100 mg/kg)5.6±1.75.8±2.25.4±1.9**4.9±1.8**3.9±1.5**
通过足趾排水法测定大鼠非致炎侧足趾踝关节容积变化(Δml),以致炎后-致炎前的差值表示其肿胀度,自致炎第12天起,连续灌胃给药16 d,并在不同时间测定AA大鼠非致炎侧足爪容积,观察白藜芦醇对AA大鼠继发性足肿胀的影响。见表2。与AA模型组比较,白藜芦醇自用药8 d后开始发挥疗效,白藜芦醇(5、15 mg/kg)和阳性药雷公藤多苷可明显抑制AA大鼠的继发性足肿胀,以15 mg/kg白藜芦醇组作用更为显著。
表2 白藜芦醇对AA大鼠继发性足肿胀病变的影响(n=10,±s)

表2 白藜芦醇对AA大鼠继发性足肿胀病变的影响(n=10,±s)
与正常组比较:ΔΔP<0.01;与模型组比较:*P<0.05,**P<0.01
组别足肿胀度(Δml)第12天第16天第20天第24天第28天正常0.09±0.080.12±0.050.15±0.050.22±0.080.24±0.07模型0.47±0.17ΔΔ0.55±0.17ΔΔ0.73±0.27ΔΔ0.91±0.31ΔΔ0.74±0.26ΔΔ白藜芦醇(5 mg/kg)0.41±0.160.48±0.130.56±0.18*0.73±0.24*0.57±0.18*白藜芦醇(15 mg/kg)0.42±0.170.47±0.210.53±0.17*0.62±0.25**0.41±0.20**雷公藤多苷(100 mg/kg)0.39±0.160.45±0.180.47±0.14**0.58±0.21**0.47±0.21**
2.3 免疫组织化学法观察白藜芦醇对AA大鼠踝关节的MMP-1、TIMP-1蛋白表达和软骨细胞分数的影响MMP-1、TIMP-1蛋白阳性反应为黄色或棕黄色颗粒,主要定位于滑膜组织及软骨的胞核和胞质中。实验结果表明,在AA大鼠滑膜衬里层细胞胞质内MMP-1、TIMP-1亚基呈高表达状态;而不同浓度的白藜芦醇明显降低了MMP-1、TIMP-1在滑膜组织及软骨组织中的表达,且随着白藜芦醇治疗浓度的增加,MMP-1、TIMP-1蛋白阳性反应逐渐减弱,见图1,提示白藜芦醇可能通过影响MMP-1、TIMP-1的活性而改善AA模型大鼠的基质的失衡状态。每张MMP-1、TIMP-1免疫组化切片随机选取9个视野,计算MMP-1、TIMP-1阳性细胞分数,AA模型大鼠软骨细胞MMP-1、TIMP-1阳性细胞计数明显高于正常组,而雷公藤多苷和不同浓度的白藜芦醇明显降低了AA大鼠MMP-1、TIMP-1的软骨细胞的阳性细胞计数,且随着白藜芦醇治疗浓度的增加,MMP-1、TIMP-1软骨细胞的阳性细胞计数越小,提示白藜芦醇能改善AA模型大鼠的软骨细胞的失衡功能状态,见表3。
2.4 白藜芦醇对关节滑膜组织中MMP-1、TIMP-1蛋白表达的影响与正常组比较,模型组关节滑膜组织中MMP-1、TIMP-1的表达明显上调,而白藜芦醇各剂量组滑膜组织中MMP-1、TIMP-1蛋白表达水平远低于模型组,但仍高于正常组。与模型组比较,雷公藤多苷治疗组两蛋白表达也降低。凝胶成像系统分析表明,白藜芦醇对AA大鼠滑膜组织MMP-1、TIMP-1蛋白表达,经5、15 mg/kg白藜芦醇治疗AA模型大鼠滑膜组织MMP-1、TIMP-1蛋白较AA模型滑膜组织明显降低,见图2。

图1 大鼠踝关节免疫组化结果 SP×400A:正常组;B:模型组;C:白藜芦醇(5 mg/kg)组;D:白藜芦醇(15 mg/kg)组;E:雷公藤多苷(100 mg/kg)组;1:MMP-1;2:TIMP-1
表3 MMP-1、TIMP-1在各组动物模型软骨中表达的细胞分数(n=24,±s)

表3 MMP-1、TIMP-1在各组动物模型软骨中表达的细胞分数(n=24,±s)
与正常组比较:ΔΔP<0.01;与模型组比较:*P<0.05,**P<0.01
项目正常组模型组白藜芦醇(5 mg/kg)组白藜芦醇(15 mg/kg)组雷公藤多苷(100 mg/kg)组MMP-17.26±0.8359.82±9.26ΔΔ26.12±7.31*14.90±1.75**15.70±1.82**TIMP-12.42±0.877.58±1.66ΔΔ4.54±1.87*3.42±1.43**4.09±1.27*
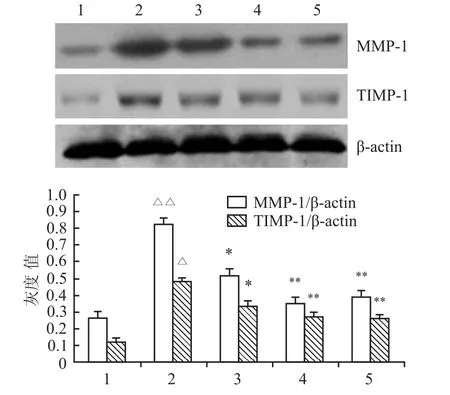
图2 Western blot分析不同浓度白藜芦醇作用AA大鼠滑膜组织MMP-1、TIMP-1蛋白表达(n=3,±s)1:正常组;2:模型组;3:白藜芦醇(5 mg/kg)组;4:白藜芦醇(15 mg/kg)组;5:雷公藤多苷(100 mg/kg)组;与正常组比较:ΔP<0.05,ΔΔP<0.01;与模型组比较:*P<0.05,**P<0.01
3 讨论
TIMPs是MMPs的特异性抑制物,对维持软骨基质合成与降解的平衡有重要的生理意义,MMPs异常表达和其抑制剂TIMP间动态平衡的失调是目前RA发病机制研究热点之一。胶原酶亚族MMP-1可降解基质的Ⅰ、Ⅱ、Ⅲ、Ⅷ、Ⅹ型胶原和蛋白多糖等,对软骨基质中含量最多的Ⅱ型胶原的降解起关键的作用[5]。故MMP-1与TIMP-1的表达变化反映RA关节软骨细胞外基质Ⅱ型胶原代谢变化。本研究结果表明,在AA模型组大鼠的病变发展过程中,滑膜组织、软骨中MMP-1、TIMP-1的表达呈逐渐升高趋势,且MMP-1的表达升高幅度远远高于TIMP-1的表达,故MMP-1的表达升高可能是RA病理性发展的原因之一。滑膜组织、软骨中MMP-1/TIMP-1的表达失衡导致Ⅱ型胶原结构破坏及蛋白多糖过度降解,使软骨基质成分降解,软骨细胞失去保护屏障,炎性因子更易于攻击软骨细胞,导致软骨失去正常的弹性及变形能力,加重使关节软骨功能恶化,进一步加重软骨破坏[6]。本实验中模型组大鼠左足较相应时间点的正常组继发性足肿胀、足爪关节炎指数明显,差异有统计学意义,说明AA大鼠模型建立。
目前RA治疗上主要依赖激素及免疫抑制剂等,其毒副作用较大;而生物制剂的价格昂贵,患者依从性差。白藜芦醇存在于21科、31属的72种食用或药用植物中,尤以葡萄、虎杖和花生含量高。体外试验[7]表明白藜芦醇通过抑制核因子κB(nuclear factor κB,NF-κB)活性,进而抑制白介素-1(interleukin-1,IL-1)β、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)产生、阻滞细胞周期、阻断疾病的发展;其抑制环氧合酶(cyclooxygenase,Cox-2)、抗氧化、抗血小板聚集的作用可改善病情和症状,对RA具有标本兼治的独特药理作用。田静等[7]证实白藜芦醇呈剂量依赖性阻滞RA成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)细胞周期、降低磷脂酰肌醇3(PI3K-Akt)信号通路Akt磷酸化水平,发挥抑制FLS增殖、诱导FLS凋亡作用,具有治疗RA的潜在价值。本课题组也显示白藜芦醇能在体外通过磷酸化细胞外信号调节激酶(phospho-extracellular signal-regulated kinase,p-ERK)通路抑制滑膜细胞生长,从而治疗AA大鼠关节炎症状[8]。但白藜芦醇治疗RA的整体动物实验研究的报道较少,杜金烽等[9]研究发现,白藜芦醇能够通过降低实验大鼠血清抗CⅡ抗体水平对胶原诱导的大鼠关节炎有抗炎作用。本实验复制的大鼠AA模型,肉眼及镜下观察到滑膜组织充血、水肿、增厚,滑膜细胞呈增生状态,并有明显的炎细胞浸润;软骨表面有不同程度的糜烂、缺损,软骨细胞排列紊乱,细胞减少,与RA的病理形态学变化相似,表明模型复制成功。本研究表明白藜芦醇能明显抑制AA大鼠继发炎症,对AA大鼠关节有很好的保护作用。免疫组化结果显示AA大鼠软骨细胞大量表达的MMP-1、TIMP-1虽增加,但相对于MMP-1表达甚少,呈现MMPs/TIMPs的失衡,不能抑制MMP-1对ECM的过度降解。关节软骨属于透明软骨,其基质主要由蛋白多糖和胶原原纤维等组成,其特殊结构和生化特性使软骨具有弹性、张力及吸收和分散负荷的能力。关节软骨的正常结构和功能维持有赖于软骨细胞和基质成分在形态与代谢方面的正常与稳定[10]。
本实验中白藜芦醇明显改善了AA关节症状及病理变化,其机制可能与其抑制滑膜组织和软骨基质的降解作用有关,本实验为将白藜芦醇进一步开发和利用成为治疗RA的药物提供一定的实验依据,对将其研制成安全、高效、经济、有自主知识产权的RA新型药物具有一定潜在的应用前景。本实验仅从一方面探讨MMP-1及TIMP-1与AA的关系,MMPS家族中其他亚型间的相互作用在RA的发病中亦起着重要的作用,这些都有待于今后进一步研究。
[1] Kim K R,Park K K,Chun K S,et al.Honokiol inhibits the progression of collagen-induced arthritis by reducing levels of pro-inflammatory cytokines and matrix metalloproteinases and blocking oxidative tissue damage[J].J Pharmacol Sci,2010,114(1):69-78.
[2] Xuzhu G,Komai-Koma M,Leung B P,et al.Resveratrol modulates murine collagen-induced arthritis by inhibiting Th17 and B-cell function[J].Ann Rheum Dis,2012,71(1):129-35.
[3] Chen X Y,Li J,Cheng W M,et al.Effect of total flavonoids of Chrysanthemum indicum on the apoptosis of synoviocytes in joint of adjuvant arthritis rats[J].Am J Chin Med,2008,36(4):695-704.
[4] 李 干,李 奇,林荔军,等.IL-1、MMP-1及TIMP-1在兔骨性关节炎模型滑膜、软骨中的表达[J].实用医学杂志,2011,27(15):2721-3.
[5] Zhao H,Yang Z,Wang X,et al.Triptolide inhibits ovarian cancer cell invasion by repression of matrix metalloproteinase 7 and 19 and upregulation of E-cadherin[J].Exp Mol Med,2012,44(11):633-41.
[6] Upadhyay A,Sharma G,Kivivuori S,et al.Role of a LIF antagonist in LIF and OSM induced MMP-1,MMP-3,and TIMP-1 expression by primary articular chondrocytes[J].Cytokine,2009,46(3):332-8.
[7] 田 静,高洁生,陈进伟,等.白藜芦醇对TNF-A诱导类风湿关节炎成纤维样滑膜细胞的影响[J].中国中药杂志,2010,35(14):1878-82.
[8] Chen X Y,Wang Z C,Li J,et al.Regulation of synoviocyte activity by resveratrol in rats with adjuvant arthritis[J].Exp Ther Med,2013,6(1):172-6.
[9] 杜金烽,李 芬,田 静,等.白藜芦醇对胶原诱导大鼠关节炎的抗炎作用研究[J].中华风湿病杂志,2009,13(2):123-6.
[10]肖 会,徐建华,周小妹,等.类风湿关节炎患者亚甲基四氢叶酸还原酶基因多态性与甲氨蝶呤治疗的相关性研究[J].安徽医科大学学报,2011,46(11):1157-61.
Effect of MMP-1,TIMP-1 of resveratrol on rats with adjuvant arthritis
An Mei1,2,Sun Heyan3,Lu Jinsen4,et al
(1Dept of Tissue Embryology,4Dept of Clinical Medicine,Anhui Medical University,Hefei 230032;2Dept of Human Anatomy,Anhui Medical College,Hefei 230601;3Dept of Orthopedic,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo investigate the expression of matrix metalloproteinases 1(MMP-1)and tissue matrix metalloproteinases inhibitor-1(TIMP-1)of synovial tissues and articular cartilage in rats with adjuvant arthritis(AA),to explore whether there is a relation between pathogenesis of AA and expression of MMP-1 and TIMP-1.Methods60 SD rats were randomly divided into 2 groups:normal control group(n=10)and model group(n=50).The model group was injected freund's complete adjuvant induced arthritis.When the right paw was induced after 12 days and secondary immune-inflammatory feet were swelled,the rats were randomly divided into 4 groups,and each group had 10 rats:model,resveratrol low dose group(5 mg/kg),resveratrol high dose group(15 mg/kg),positive control tripterygium wilfordii glycoside(TWG,100 mg/kg),qd×18 day;after inducing inflammatory paw,the expressions of MMP-1 and TIMP-1 in synovial tissue and articular cartilage were detected by immunohistoehemistry.MMP-1 and TIMP-1 protein content in synovial tissue was detected by Western blot.ResultsResveratrol could inhibit model group rats pathological damage,compared with the AA model group,synovial tissue expression of MMP-1 was significantly higher in resveratrol-treated groups(P<0.05,P<0.01),the expression of TIMP-1 was also higher(P<0.05).There was a correlation in the role of the anti-inflammation.ConclusionResveratrol inhibits the inflammation of AA rats and prevents the pathological changes of the joint degeneration,its mechanism is related to regulation of matrix metalloproteinases in synovial tissue of rats and the expression of articular cartilage.
adjuvant arthritis;resveratrol;matrix metalloproteinases 1;matrix metalloproteinases inhibitor-1;Western blot;rats
R-332
A
1000-1492(2014)06-0701-05
2014-02-17接收
国家自然科学基金(编号:81373421);国家级大学生创新创业训练计划项目(编号:201310366007);安徽省自然科学基金(编号:1208085MC53)
安徽医科大学1组织胚胎学教研室、4临床医学系,合肥2300322安徽医学高等专科学校解剖教研室,合肥 2306013安徽医科大学第一附属医院骨科,合肥 230022
安 梅,女,讲师,硕士研究生;陈晓宇,男,博士,副教授,硕士生导师,责任作者,E-mail:cxyayd@163.com孙和炎,男,副主任医师,责任作者,E-mail:sunyu20055@sohu.com

