高脂血症对小鼠睾丸StAR和P450scc表达的影响及辛伐他汀的干预作用
王慧君,吕正梅,戎玉罗,王 琦,叶宁宁,程媛媛,张 凯
高脂血症对小鼠睾丸StAR和P450scc表达的影响及辛伐他汀的干预作用
王慧君1,2,吕正梅1,2,戎玉罗3,王 琦1,2,叶宁宁3,程媛媛3,张 凯4
目的探讨高脂血症(HL)影响小鼠睾丸睾酮合成机制及辛伐他汀(SIMV)的干预作用。方法18只C57BL/6J雄性小鼠随机均分为3组:HL组、SIMV组和正常对照组(CTRL组);4个月后测血脂、体重;3β-HSD免疫组化法检测睾丸间质细胞;RT-PCR法和Western blot法检测类固醇激素合成急性调节蛋白(StAR)与细胞色素P450胆固醇侧链裂解酶(P450scc)的表达。结果①HL组和SIMV组体重、总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)明显高于CTRL组(P<0.05);SIMV组体重和TC比HL组显著下降(P<0.05),LDL-C无明显变化。②HL组StAR和P450scc的mRNA与蛋白表达较CTRL组显著下调(P<0.05,P<0.01);SIMV组较HL组则两者表达均升高(P<0.01)。③3β-HSD免疫组化染色显示各组小鼠睾丸间质细胞数差异无统计学意义。结论SIMV可以改善HL引起的睾丸间质细胞合成睾酮能力下调。
睾丸;StAR;P450scc;高脂血症;辛伐他汀
代谢综合征(metabolic syndrome,MS)是多种代谢成分异常聚集的病理状态,主要组分包括超重或肥胖、高血压、高血脂、糖耐量异常和糖尿病、高胰岛素血症伴胰岛素抵抗等。高能高脂饮食摄入过多和运动量过少是MS发生的两大直接诱因[1-3]。MS会对身体机能的许多方面造成损害,性腺机能减退即是其中之一[4]。研究[5-7]表明MS可能通过多种途径导致雄性性腺机能减退:①外周脂肪组织芳香化作用增强,睾酮向雌二醇转化增加;②炎症因子和瘦素分泌增多,使垂体促性腺激素的合成减少或作用减弱;③肥胖抑制雄激素结合球蛋白的合成;④胰岛素抵抗可能减少促性腺激素的释放等。哺乳动物体内95%的雄激素由睾丸间质细胞(Leydig细胞)合成分泌,类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)和细胞色素P450胆固醇侧链裂解酶(cytochrome P450 side-chain cleavage enzyme,P450scc)是调控Leydig细胞睾酮合成的关键蛋白/酶。辛伐他汀(simvastatin,SIMV)为临床常用降脂药物,主要作用是降低总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。有文献[8]报道,SIMV可改善高胆固醇血症引起的精液质量与雄性生育力下降。该研究采用高脂饮食复制高脂血症(hyperlipidemia,HL)动物模型,观察HL小鼠Leydig细胞StAR和P450scc表达水平的改变,同时分析SIMV处理对高脂饮食小鼠睾酮合成能力的影响。
1 材料与方法
1.1 实验动物
18只C57BL/6J雄性小鼠,6周龄,SPF级,体重19~23 g,购自安徽医科大学实验动物中心。
1.2 主要试剂与仪器
SIMV购自杭州默沙东有限公司;免疫组化SABC试剂盒、DAB显色试剂盒购自北京中杉金桥生物技术有限公司;抗3β-HSD抗体、抗P450scc多克隆抗体、辣根过氧化物酶(HRP)标记山羊抗小鼠IgG和山羊抗兔IgG均购自武汉博士德生物公司;抗StAR抗体购自美国CST公司;抗βactin抗体购自美国Santa Cruz公司;TRIzol和RTPCR试剂盒购自大连宝生物工程有限公司;引物由上海生工生物工程股份有限公司合成;血脂检测采用日本OLYMPUS AU640全自动生化分析仪;免疫组化染色摄片采用日本OLYMPUS BX51光学显微镜。
1.3 方法
1.3.1 动物分组和饲养 18只C57BL/6J雄性小鼠随机平均分成3组喂养:①HL组给予高脂饲料(1%胆固醇、10%猪油、10%蛋黄粉、20%蔗糖、59%维持料)喂养,制备HL动物模型;②SIMV组给予相同高脂饲料,并以SIMV 5 mg/(kg·d)灌胃;③正常对照组(CTRL组)给予普通饲料喂养。小鼠均自由摄食、饮水。每周称量小鼠体重,并根据体重调整SIMV用量。
1.3.2 血脂测定 4个月后实验结束,摘除小鼠眼球取血,分离血清,检测血脂。
1.3.3 免疫组化染色 迅速打开小鼠腹腔,取出睾丸组织,固定于4%多聚甲醛,石蜡包埋、切片,切片常规脱蜡至水,枸橼酸盐修复,3%H2O2孵育阻断内源性过氧化物酶,正常山羊血清封闭;加抗3β-HSD抗体(1∶50),4℃孵育过夜;生物素标记羊抗兔IgG工作液37℃孵育1 h;免疫组化SP工作液37℃孵育30 min;DAB显色,苏木精复染后脱水、透明、封片。以PBS代替一抗作阴性对照。
1.3.4 RT-PCR法检测 取新鲜睾丸组织约50 mg,加0.5 ml TRIzol充分匀浆,酚-氯仿法提取组织总RNA。取2 μg总RNA反转录获得cDNA,再进行PCR反应。PCR反应条件为:94℃预变性3 min,94℃变性时间30 s,60℃退火时间30 s,72℃延伸时间20 s,设置循环30次,72℃延伸时间10 min,4℃终止。引物序列见表1。PCR产物于琼脂糖凝胶中电泳,采用凝胶电泳成像分析系统观察、拍照。用Gel-Pro Analyzer软件分析目的条带灰度值,以目的条带与β-actin条带灰度值的比值表示目的基因mRNA的相对含量。

表1 RT-PCR的引物序列
1.3.5 Western blot法检测 取约50 mg睾丸组织,加入200 μl RIPA裂解液和2 μl PMSF充分匀浆,提取组织总蛋白,Lowry法测定蛋白浓度并定量。蛋白上样量取约100 μg,12%SDS-PAGE电泳分离蛋白;恒流转至PVDF膜,5%脱脂牛奶封闭后TBST洗膜;一抗孵育(抗StAR抗体按1∶1 000稀释、抗P450scc抗体按1∶200稀释、抗β-actin抗体按1∶100稀释)4℃过夜,37℃孵育二抗(按1∶1 000稀释)1 h;常规TBST洗膜后ECL化学发光,X线片显影、定影。实验结果拍照并用Gel-Pro Analyzer软件进行分析。
1.4 统计学处理
采用SPSS Statistics V17.0统计软件分析,数据以±s表示,多组间比较采用单因素方差分析,两两比较采用SNK法。
2 结果
2.1 体重和血脂
HL组和SIMV组体重、TC和 LDL-C较CTRL组均明显升高,差异有统计学意义(P<0.05);SIMV组体重和TC明显低于HL组,差异有统计学意义(P<0.05),LDL-C降低不明显;各组总三酰甘油(TG)和高密度脂蛋白胆固醇(HDLC)差异无统计学意义。见表2。
表2 各组小鼠体重与血脂比较(n=6,±s)
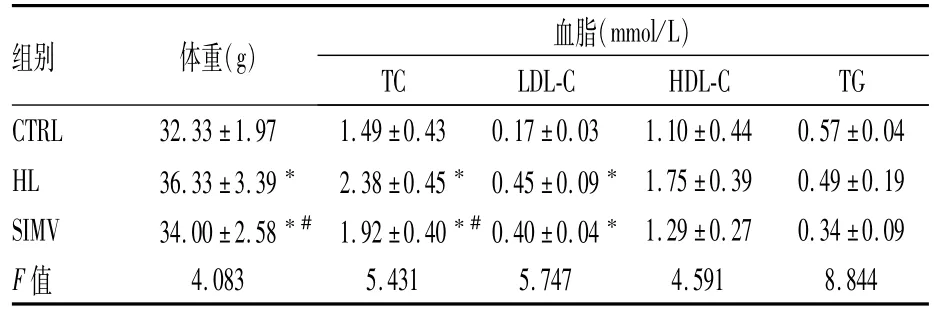
表2 各组小鼠体重与血脂比较(n=6,±s)
与CTRL组比较:*P<0.05;与HL组比较:#P<0.05
组别体重(g)血脂(mmol/L)TCLDL-CHDL-CTG CTRL32.33±1.971.49±0.430.17±0.031.10±0.440.57±0.04 HL36.33±3.39*2.38±0.45*0.45±0.09*1.75±0.390.49±0.19 SIMV34.00±2.58*#1.92±0.40*#0.40±0.04*1.29±0.270.34±0.09 F值4.0835.4315.7474.5918.844
2.2 睾丸Leydig细胞
3β-HSD特异性表达于睾丸组织Leydig细胞细胞质中,阳性染色呈棕黄色,生精小管呈阴性反应。每张切片随机选取10个400倍高倍镜视野,光镜下计数睾丸Leydig细胞数,统计分析显示各组小鼠睾丸组织Leydig细胞数差异无统计学意义。见图1、表3。

图1 各组小鼠睾丸组织Leydig细胞3β-HSD蛋白免疫组化染色×400A:HL组;B:SIMV组;C:CTRL组
表3 各组小鼠睾丸组织Leydig细胞计数均值比较(n=6,±s)

表3 各组小鼠睾丸组织Leydig细胞计数均值比较(n=6,±s)
组别Leydig 细胞计数均值CTRL111.4±2.351 HL103.8±1.847 SIMV99.1±2.501
2.3 睾丸组织StAR和P450scc的mRNA表达
HL组睾丸组织Leydig细胞StAR和P450scc的mRNA表达比CTRL组降低(P<0.05);经SIMV干预后,StAR和P450scc表达均升高(P<0.01),见图2。
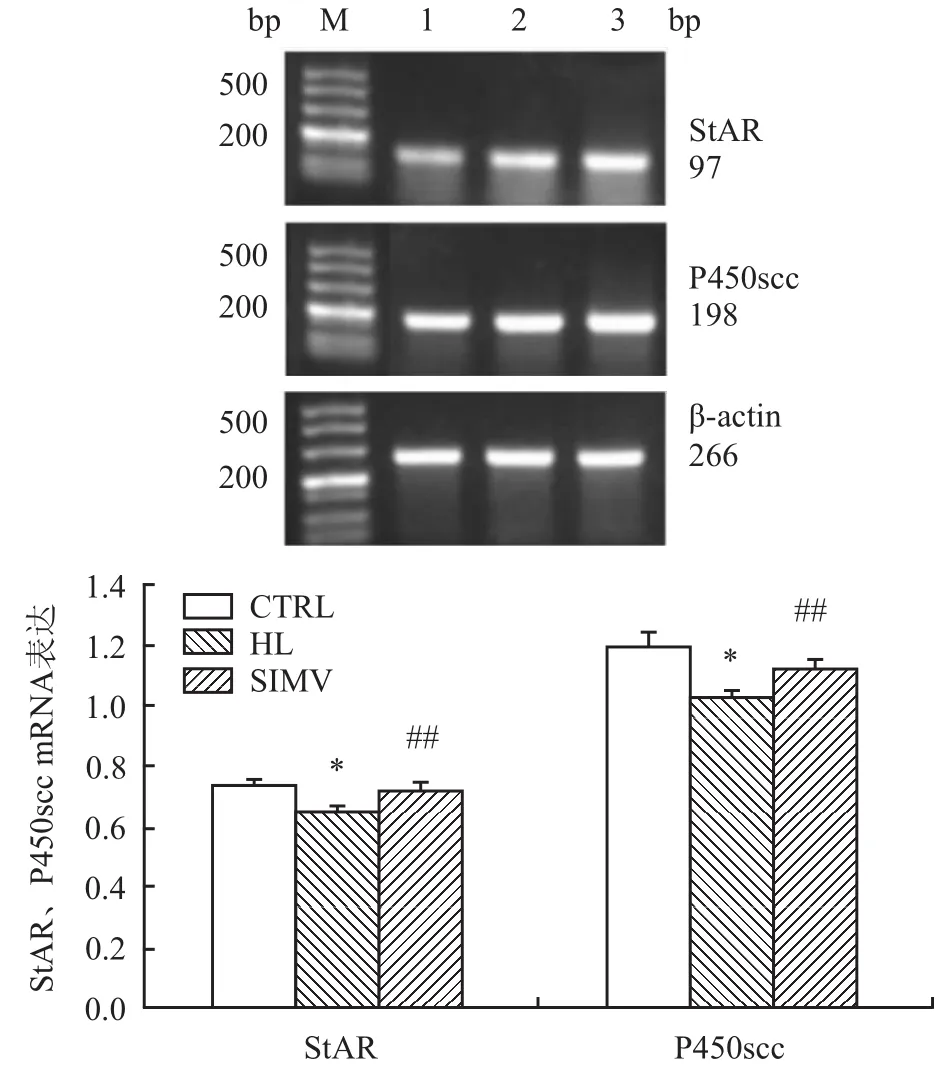
图2 RT-PCR法检测睾丸组织StAR和P450scc的mRNA水平M:Marker;1:HL组;2:SIMV组;3:CTRL组与CTRL组比较:*P<0.05;与HL组比较:##P<0.01
2.4 睾丸组织StAR和P450scc的蛋白表达
睾丸组织Leydig细胞StAR和P450scc蛋白表达在HL组明显低于CTRL组(P<0.01);SIMV组表达较HL组上调(P<0.01),见图3。
3 讨论
许多临床资料证实肥胖相关的代谢性疾病能引发睾酮水平低下。本课题以高脂饮食建立HL小鼠模型,研究睾丸Leydig细胞合成睾酮能力的变化及降脂药SIMV处理后对生殖功能的影响。
该研究结果显示,高脂饮食诱发HL小鼠的睾丸组织StAR和P450scc的mRNA与蛋白表达较正常饮食小鼠明显下调;经SIMV处理后,高脂饮食小鼠StAR和P450scc的表达则有显著增加。StAR调节睾丸Leydig细胞合成睾酮过程的限速步骤:胆固醇由线粒体外膜向内膜的转移;P450scc调控睾酮合成酶促反应的关键步骤:胆固醇侧链裂解转化为孕烯醇酮。StAR和P450scc表达下调,表明HL可使Leydig细胞合成睾酮的能力降低。Yamamoto et al[9]研究指出,HL可导致精子发生障碍,部分原因可能由于Leydig细胞的分泌功能受到损害。SIMV可上调StAR和P450scc的表达,表明其对高脂饮食小鼠睾丸的睾酮合成障碍具有保护作用。

图3 Western blot法检测睾丸组织StAR和P450scc的蛋白水平1:HL组;2:SIMV组;3:CTRL组与CTRL组比较:**P<0.01;与HL组比较:##P<0.01
该研究表明,高脂饮食小鼠睾丸Leydig细胞计数和正常饮食小鼠并无明显差异。因此,HL小鼠睾丸组织StAR和P450scc的表达下调不是因为Leydig细胞数目有所减少。线粒体结构和功能的完整是Leydig细胞正常合成睾酮所必需的条件[10]。高脂饮食可引起血脂增高,睾丸局部代谢状态发生改变,产生过量自由基,引发睾丸微环境的氧化应激(OS),使线粒体DNA受到损伤[6]。课题前期研究[11]显示,HL小鼠睾丸Leydig细胞的线粒体出现空泡化改变。完整的线粒体膜电位也是StAR转运胆固醇所必需的,而活性氧能够破坏线粒体膜电位的完整性,继而影响StAR的转运效率和睾酮的合成[12]。
有文献[8]报道,抗氧化剂可以显著改善高胆固醇血症引发的精子异常和雄性生育力下降。有研究[13]表明,抗氧化剂褪黑素可有效保护HL导致的小鼠睾丸组织超微结构损伤。SIMV有降脂、降低动脉粥样硬化的风险等功效;同时,长期应用可以改善与高血脂相关的OS[14]。研究结果显示,经SIMV处理后的高脂饮食小鼠血清LDL-C略有降低(种属差异性可能是LDL-C降低不明显的原因[15]),TC显著下降。因此推测SIMV可能通过调节血脂代谢紊乱和改善OS,减轻Leydig细胞线粒体结构和功能的损害,从而保护其合成睾酮的能力,保障精子的正常发生。
SIMV可能还通过其他的作用机制保护高脂饮食小鼠Leydig细胞的睾酮合成能力。肥胖及内脏脂肪组织分泌脂肪因子和激素的增加会促进性腺机能减退的发生[5]。超重可负反馈调节下丘脑-垂体-性腺(HPG)轴,使睾酮合成下降。本研究结果表明:SIMV的干预使高脂饮食小鼠体重增加的趋势得到遏制,从而可能通过减少脂肪组织脂肪因子和激素的分泌,对HPG轴的负反馈调控作用进行调节,进而增加Leydig细胞的睾酮合成,提高体内的睾酮水平。SIMV对HPG轴的影响也值得进一步研究。
本课题阐明了HL导致睾丸Leydig细胞合成睾酮能力下降的分子机制及降脂药SIMV对高脂饮食小鼠Leydig细胞睾酮合成能力的保护作用,这对HL及MS相关男性生育力下降的预防和治疗具有一定的临床参考意义。
[1] Cornier M A,Dabelea D,Hernandez T L,et al.The metabolic syndrome[J].Endocr Rev,2008,29(7):777-822.
[2] Katcher H I,Hill A M,Lanford J L,et al.Lifestyle approaches and dietary strategies to lower LDL-cholesterol and triglycerides and raise HDL-cholesterol[J].Endocrinol Metab Clin North Am,2009,38(1):45-78.
[3] Balamurugan G,Shantha A.Effect of Erythrina variegate seed extract on hyperlipidemia elicited by high-fat diet in wistar rats[J].J Pharm Bioallied Sci,2010,2(4):350-5.
[4] Guay A T.The emerging link between hypogonadism and metabolic syndrome[J].Androl,2009,30(4):370-6.
[5] Du Plessis S S,Cabler S,McAlister D A,et al.The effect of obesity on sperm disorders and male infertility[J].Nat Rev Urol,2010,7(3):153-61.
[6] Rato L,Alves M G,Dias T R,et al.High-energy diets may induce a pre-diabetic state altering testicular glycolytic metabolic profile and male reproductive parameters[J].Androl,2013,51(3):495-504.
[7] Kasturi S S,Tannir J,Brannigan R E.The metabolic syndrome and male infertility[J].J Androl,2008,29(3):251-9.
[8] Shalaby M A,el-Zorba H Y,Kamel G M.Effect of alpha-tocopherol and simvastatin on male fertility in hyper-cholesterolemic rats[J].Pharmacol Res,2004,50(2):137-42.
[9] Yamamoto Y,Shimamoto K,Sofikitis N,et al.Effects of hypercholesterolaemia on Leydig and Sertoli cell secretory function and the overall sperm fertilizing capacity in the rabbit[J].Hum Reprod,1999,14(6):1516-21.
[10]Allen J A,Shankara T,Janus P,et al.Energized,polarized,and actively respiring mitochondria are required for acute Leydig cell steroidogenesis[J].Endocrinol,2006,147(8):3924-39.
[11]张 凯,贾雪梅,汪 渊,等.高脂饮食对小鼠睾丸超微结构的影响[J].安徽医科大学学报,2008,43(6):624-7.
[12]Diemer T,Allen J A,Hales K H,et al.Reactive oxygen disrupts mitochondria in MA-10 tumor Leydig cells and inhibits steroidogenic acute regulatory(StAR)protein and steroidogenesis[J].Endocrinol,2003,144(7):2882-91.
[13]张 凯,吕正梅,贾雪梅,等.褪黑素对高脂饮食小鼠睾丸Bcl-2和Bax表达的影响[J].安徽医科大学学报,2013,48(4):368-71.
[14]Farah R,Shurtz-Swirski R,Dorlechter F.Primed polymorphonuclear leukocytes constitute a possible link between inflammation and oxidative stress in hyperlipidemic patients:effect of statins[J].Minerva Cardioangiol,2010,58(2):175-81.
[15]Wang Y X,Martin-McNulty B,Huw L Y,et al.Anti-atherosclerotic effect of simvastatin depends on the presence of apolipoprotein E[J].Atherosclerosis,2002,162(1):23-31.
Effect of simvastatin on expression of StAR and P450scc in testis of mice with hyperlipidemia
Wang Huijun1,2,Lü Zhengmei1,2,Rong Yuluo3,et al
(1Dept of Histology and Embryology,2Central Laboratory of Molecular Function,
3The 2012 General Practice Medicine Specialty,Anhui Medical University,Hefei 230032)
ObjectiveTo investigate the effect of hyperlipidemia(HL)on the testosterone synthesis of Leydig cells and the protection conferred by simvastatin(SIMV)treatment.MethodsEighteen C57BL/6J male mice were randomlydivided into hyperlipidemia group(HL group),simvastatin treatment group(SIMV group)and control group(CTRL group).After 4 months,the body weight and serum lipid profiles were detected.Leydig cells were evaluated by 3β-HSD immunohistochemical staining.Expressions of steroidogenic acute regulatory protein(StAR)and cytochrome P450 Cholestero side chain lyase(P450scc)were determined by RT-PCR and Western blot.ResultsThe high-fat diet led to a significant increase in body weight,total cholesterol(TC)and low density lipoprotein cholesterol(LDL-C)in HL group and SIMV group as compared to CTRL group(P<0.05).A significant decrease in body weight and serum TC was noticed in SIMV group in comparison with HL group(P<0.05).The decreased mRNA and protein expressions of testicular StAR and P450scc were observed in hyperlipidemic mice as compared to CTRL group(P<0.05,P<0.01).The StAR and P450scc expressions were significantly improved in SIMV group in comparison with the HL group(P<0.01).There were no significant differences of Leydig cells number among these experimental groups.ConclusionSIMV may have a role in protecting Leydig cell function against metabolic damage caused by HL.
testis;StAR;P450scc;hyperlipidemia;simvastatin
R 322.64;R 361.2;R 589.2
A
1000-1492(2014)06-0711-05
2013-12-20接收
安徽省高等学校省级自然科学研究面上项目(重点)(编号:KJ2013A148);2013年国家级大学生创新创业训练计划项目(编号:0111015103)
安徽医科大学1组织胚胎学教研室、2分子机能中心实验室、32012级全科专业,合肥 2300324安徽中医药大学组胚生物学教研室,合肥 230038
王慧君,女,硕士研究生;
吕正梅,女,副教授,硕士生导师,责任作者,E-mail:lvzm99@126.com

